当归芍药散对糖尿病肾损伤大鼠肾小管上皮细胞转分化的影响
刘岳轩 陈文钰 陈言 马梦舸 王鹏禹 刘湘花 高小玲 金艳 刘晨 吴效通 王晓 李晓冰
(1河南中医药大学,河南 郑州 450008;河南中医药大学 2第二临床医学院;3第三临床医学院)
糖尿病肾病(DN)以微量蛋白尿、肾小球和肾衰竭为特征,是糖尿病主要并发症之一〔1〕。研究发现,肾小管间质纤维化(TIF)是DN的重要病理结局,而肾小管上皮细胞转分化(EMT)被认为是TIF的主要发病机制之一〔2〕。当归芍药散(DSS)是传统中药方剂,研究表明,DSS在临床上常用于DN的治疗且疗效显著〔3,4〕。本文前期动物实验也发现,DSS可显著降低糖尿病早期肾损伤大鼠24 h尿蛋白及β2-微球蛋白水平,改善肾小球及肾小管病理损伤状况〔5〕。然而,DSS对DN的作用机制尚不明确。本研究观察DSS对DN模型大鼠的肾保护作用,并从肾小管上皮细胞转分化角度探究其作用机制。
1 材料与方法
1.1实验动物 SPF级SD大鼠70只,体质量(220±20)g,由郑州大学实验动物中心提供,许可证号:SCXK(豫)2017-0001。
1.2药品与试剂 当归芍药散(当归、芍药、川芎、茯苓、白术、泽泻,比例为1∶4∶2∶1∶1∶2,河南中医药大学第一附属医院);雷公藤多苷片(湖南千金协力药业有限公司,批准文号:国药准字Z43020138);即用型免疫组化试剂盒(Maxim,中国);Anti-Vimentin (Aviva Systems Biology,CA,美国);Anti-E-cadherin抗体、Anti-α-SMA(CST,Boston,美国)。
1.3实验仪器 FORMA 700型超低温冰箱购于Thermo公司;石蜡包埋机、切片机购于德国LEICA公司;Western印迹系统购于Bio-Rad公司;BS224型电子天平购于北京塞多利斯仪器系统有限公司。
1.4DN大鼠模型的建立与分组 实验前,所有大鼠适应性喂养1 w。根据随机区组分组法对所有大鼠进行分组,随机选择8只作为正常组,常规动物饲料喂养,其余62只大鼠给予高脂高糖饲料4 w。高糖高脂大鼠按照55 mg/kg腹腔注射链脲佐菌素(STZ)制备糖尿病模型。72 h后,选取空腹血糖≥16.7 mmol/L大鼠作为糖尿病大鼠〔5〕。随后将高脂高糖糖尿病大鼠随机分为模型组、DSS低剂量(DSS-L)组、DSS中剂量(DSS-M)组、DSS高剂量(DSS-H)组、雷公藤多苷(TP)组。根据“人-鼠体表面积折算法”,DSS高、中、低剂量组分别给予21、14、7 g/(kg·d)的DSS灌胃治疗,雷公藤多苷组灌胃6 mg/(kg·d)的雷公藤多苷,模型组和正常组灌胃生理盐水,各组连续干预8 w。
1.5免疫组织化学试验 将肾组织固定在4%多聚甲醛缓冲液中,石蜡包埋,切片。将制好的石蜡切片置于电热恒温干燥箱中,60 ℃烘烤3 h;将干燥的石蜡切片进行常规二甲苯脱蜡,下行梯度乙醇水化,蒸馏水洗;抗原修复;滴加3%过氧化氢(H2O2)室温孵育10 min以灭活内源性酶,磷酸盐缓冲液(PBS)洗3次,每次3 min;每张切片滴加正常山羊免疫血清封闭,室温孵育10 min后甩去多余液体,滴加1∶100比例稀释波形蛋白(Vimentin)、E-钙黏蛋白(cadherin)、α-平滑肌肌动蛋白(SMA),4 ℃冰箱过夜;从冰箱取出恢复至室温后,PBS洗涤(3 min×3次);每张切片滴加聚合物增强剂(试剂A),室温20 min,PBS洗涤;每张切片滴加酶标抗鼠兔聚合物(试剂B),室温10 min,PBS洗涤;二氨基联苯胺(DAB)显色,显微镜下控制反应时间,苏木素复染,蒸馏水充分水洗终止显色;切片经梯度酒精脱水干燥,二甲苯透明,中性树胶封片;使用相差显微镜200倍视野下拍照。结果判定标准及方法:阳性表达的部位显色呈棕黄色,且其显色强度明显高于其背景无特异性染色的部位,细胞核显色呈浅蓝色。使用Image J-ProPlus6.0软件分析免疫组化的光密度值。
1.6Western印迹 每100 mg组织加入1 ml添加了苯甲基磺氟(PMSF)的RIPA,使用匀浆机匀浆,充分裂解后,4 ℃下12 000~16 000 r/min离心5 min,立即吸取上清进行组织蛋白提取,二喹啉甲酸(BCA)法蛋白定量。取蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)结束后,将蛋白转至聚偏氟乙烯(PVDF)膜,5%脱脂牛奶室温封闭2 h,用α-SMA抗体(1∶1 000)、 Vimentin抗体(1∶4 000),E-cadherin抗体(1∶1 000)于4 ℃孵育过夜,Tris盐酸缓冲液吐温(TBST)洗涤,用辣根过氧化酶(HRP)标记的二抗室温孵育1 h,化学发光显影,用Tanon6600发光成像工作站图像采集。蛋白相对表达量计算为目的蛋白灰度值/内参蛋白灰度值。
1.7统计学方法 采用SPSS21.0软件进行单因素方差分析。
2 结 果
免疫组化和Western印迹检测结果可见,与模型组比较,正常组、DSS-M组、DSS-H组及TP组E-cadherin水平显著升高,Vimentin表达水平明显降低(P<0.05,P<0.01);正常组、DSS-H组和TP组α-SMA水平显著降低(P<0.05,P<0.01);此外,Western印迹检测结果可见,与模型组比较,DSS-M组α-SMA蛋白表达水平显著下调(P<0.01)。见表1、图1、图2。

图1 免疫组织化学检测E-cadherin、α-SMA及Vimentin表达
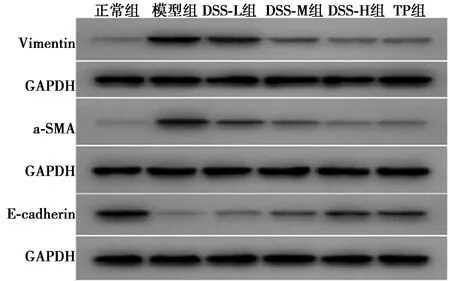
图2 Western印迹检测E-cadherin、α-SMA及Vimentin表达

表1 各组E-cadherin、α-SMA及Vimentin表达水平
3 讨 论
DSS以健脾化湿,利水活血为基础,在临床治疗DN中收效甚广〔4,6〕。研究表明,方中当归、芍药均可发挥不同程度降血糖及肾保护作用〔7~10〕,本课题组前期研究发现,DSS可改善糖尿病肾损伤大鼠肾小球增大、系膜细胞及基质增生、肾小管变性及炎症细胞浸润〔5〕,提示DSS对DN大鼠有一定治疗作用。研究表明,DN主要病理基础是TIF,而肾小管上皮细胞EMT是造成TIF的重要原因之一〔11〕。在EMT过程中,肾小管上皮细胞丧失了原有的细胞形态和结构,失去其特征蛋白E-cadherin,进而被α-SMA和Vimentin所取代,基底膜结构逐渐破坏,上皮细胞分化为肌成纤维细胞,从而具有了迁移和侵袭能力,间质纤维组织堆积,最终形成纤维化〔12〕。E-cadherin减少和消失是上皮细胞转分化的标志,且二者相互作用,E-cadherin的减少会加速EMT进程。本研究结果提示,糖尿病肾损伤大鼠EMT进程被DSS明显抑制,且在DSS高剂量时治疗效果最好。综上,DSS可一定程度改善糖尿病肾损伤,其对肾脏的保护机制有可能与其逆转肾小管上皮细胞转分化有关。

