8例伴低钾血症的先天性肾上腺皮质增生症患儿护理体会
杨亚会,苏 喆,王 立,刘春妍,邰 印
深圳市儿童医院内分泌科,广东 深圳 518038
先天性肾上腺皮质增生症(CAH)是一组因肾上腺皮质激素合成途径中酶的缺陷而引起的常染色体隐性遗传病。常见的CAH 类型有21-羟化酶缺乏(21-OHD)、11β-羟化酶缺乏(11β-OHD)、17-羟化酶缺乏(17-OHD)、类脂性肾上腺皮质增生症、3β-羟类固醇脱氢酶缺乏、18-羟化酶缺乏(18-OHD),其中21-OHD 缺乏者最多见,占90%以上[1]。21-OHD 常见的类型为失盐型(SW)、单纯男性化型(SV)及非经典型。其电解质紊乱的特点为低血钠、高血钾,同时可能伴有酸中毒,这是其最常见的临床表现。但是临床上也会遇到伴有低钾血症的CAH 患儿,需要分析原因,积累经验。基于此,本研究分析2015 年8 月—2019 年5 月深圳市儿童医院内分泌科收治的8 例伴低钾血症的CAH 患儿的临床资料,总结护理体会,旨在提高临床医护的认识,现报告如下。
1 病例资料
1.1 患儿1
57 d,男。新生儿期诊断CAH,21-OHD,SW,出院后家长自行停药。因“腹泻、呕吐、精神差、进食减少10 d”入院,体重2.5 kg (出生体重2.6 kg),血压75/42 mmHg(1 mmHg=0.33 kPa),严重脱水貌,皮肤色素沉着明显,精神反应差。入院时,钠105.0 mmol/L,钾5.5 mmol/L,按肾上腺危象处理,予以生理盐水20 mL/kg快速补液,氢化可的松10 mg(50 mg/m2)首剂静脉输注,建立静脉双通路,留置胃管,Q3 h 鼻饲配方奶40 mL,心电监护监测生命体征,记录24 h 出入量,口服及静脉补钾后,1 d 内血钾上升至3.7 mmol/L。
1.2 患儿2、患儿3
患儿2、患儿3为同卵双胎,女,在出生后2个月诊断CAH,21-OHD,SV。入院前1 d 出现呕吐,5 次/d,均为非喷射性胃内容物,伴有腹胀、恶心、无发热、腹泻等症状。家长自行予以氢化可的松加倍,9-α 氟氢可的松(FC)暂停服用。入院后嘱其卧床休息,采取合适体位,以防窒息,协助患儿及时用温水漱口,做好口腔护理,及时更换脏污的衣物、被褥,开窗通风。呕吐停止后,给予患儿少量、清淡、易消化的食物。积极予以补液补钾治疗,2~3 d后血钾均可上升至3.7 mmol/L以上。
1.3 患儿4、患儿5
患儿4、患儿5,男,因“发现阴茎增大”入院。查体:身高、体重均在+3 SD 以上,血压偏高,患儿4:125/79 mmHg, 患儿5:130/90 mmHg。皮肤黝黑,可见色素沉着,睾丸均为1.5~2.0 mL。患儿4阴茎7.0 cm×2.6 cm,阴毛PH 2期,肾上腺超声提示肾上腺增大,睾丸超声无异常,骨龄12.0岁(较年龄超前8.8岁)。患儿5:阴茎7.0 cm×2.5 cm,睾丸超声提示睾丸残余瘤,骨龄12.6 岁(较年龄超前9.1 岁)。两者促肾上腺皮质激素(ACTH)均增高,低钾程度均为轻度低钾,血钠均在正常范围(见表1)。完善中剂量地塞米松抑制试验及基因检测,诊断CAH,11β-OHD,经氢化可的松治疗量后血钾上升至3.7 mmol/L,出院随访血压波动在90/60 mmHg左右。
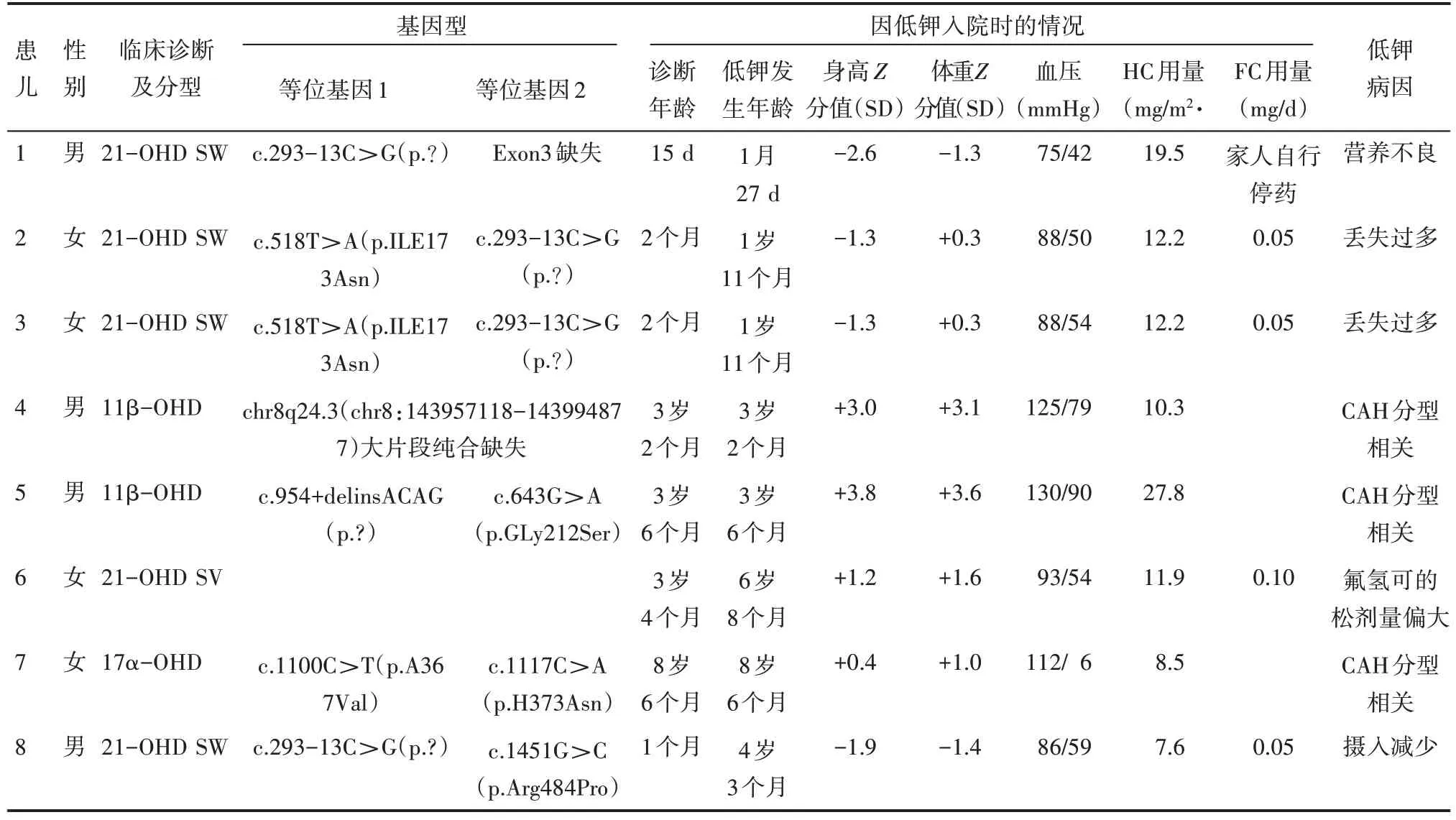
表1 8例CAH患儿一般情况

表2 8例CAH患儿激素水平、电解质比较
1.4 患儿6
目前,年龄6 岁8 个月,女,3 岁4 个月时因“外阴异常”诊断CAH,21-OHD,SV。6 岁8 个月继发中枢性性早熟,本次入院查电解质钾3.5 mmol/L,追问病史,母亲增加了氟氢可的松的剂量,给予氟氢可的松减量,复查血钾上升至3.6 mmol/L。
1.5 患儿7
目前,年龄8 岁6 个月,女,4 岁时因“右侧腹股沟嵌顿性斜疝”就诊,超声未显示正常子宫、卵巢。染色体为46,XY,当时行双侧性腺(睾丸)切除术,并继续按女性抚养。为进一步明确诊断入院,身高133.8 cm(+0.4 SD),体重31.9 kg(+1 SD), 血压112/63 mmHg。无多毛、痤疮,双侧腋毛A1 期,双侧乳房B1 期,乳晕着色正常,女性外阴,阴唇无色素沉着,阴毛PH1期。实验室检查提示血钾轻度低下(见表1),ACTH、孕酮、17-OHD 稍高,经ACTH 兴奋实验及基因检测确诊为CAH 17α-OHD。予以氢化可的松治疗后复查血钾上升至3.6 mmol/L。
1.6 患儿8
男,4 岁3 个月,出生1 个月后诊断为CAH,21-OHD,SW。本次因“发热,胃口差进食少”入院,不伴有腹胀、恶心等胃肠道症状。实验室检查提示轻度低钾(见表1)。积极予以患儿药物及物理降温,嘱其卧床休息,多饮温水,予以清淡、易消化饮食,同时注重提高饭菜的可口度。主动与患儿进行交流,向其讲解饮食的重要性,告知患儿多进食含钾丰富的食物,如香蕉、橘子等,以改善其胃肠道不适症状,同时注意保持患儿口腔清洁。1 周后复查血钾为3.9 mmol/L。
2 护理
2.1 与CAH分型有关导致低钾血症的护理
根据分型,17α-OHD 在17-OHD 的情况下,皮质醇、睾酮合成减少,负反馈调节使ACTH 升高,盐皮质激素合成通路上的去氧皮质酮(DOC)大量增加,引起低肾素性高血压和低钾血症[2],如本研究患儿7。而11β-OHD 是由于CYP11B1 基因突变,导致11-DOC 不能升高,皮质醇下降,DOC 升高,DOC 具有盐皮质激素保钠排钾的作用,可引起低钾血症和高血压[3],如本研究患儿4、患儿5。从CAH 的这2 例分型中可以看出,17α-OHD 和11β-OHD都会导致低钾血症。钾是维持细胞代谢和功能的重要阳离子,可保持机体渗透压的正常,并维持酸碱平衡及心肌细胞的功能。血清钾的正常范围是3.5~5.5 mmol/L,当血钾低于3.5 mmol/L 时为低钾血症,轻者可出现恶心、呕吐、腹胀、便秘、头晕、乏力等症状,重者会出现肌腱反射迟钝、呼吸困难、昏迷等症状。当血清钾降至2.5 mmol/L 以下时,甚至会出现室性期前收缩、室性心动过速、室性颤动、心律失常等严重症状,对人体危害极大。因此,对患儿进行水电解质监测变得尤为重要。患儿入院后立即遵医嘱,予其静脉采血,检测内容包括钾、钠、碳酸氢盐、17-羟孕酮、雄烯二酮、孕酮、肾素活性(卧位)等。根据检测到的结果及时进行干预。本研究患儿4 入院后查血钾为3.4 mmol/L、患儿5入院后查血钾为2.6 mmol/L,患儿7入院后查血钾为3.3 mmol/L,对于此类低钾患儿应立即予以氢化可的松治疗。激素替代治疗是CAH患儿最主要的治疗方法。在儿童用药中优选氢化可的松作为CAH患儿基本和终身的替代治疗药物[4]。在用药的同时,密切观察患儿的精神反应、进食情况、尿量情况、有无低血糖表现,严格按医嘱记录出入量。护理人员应告知患儿多食用一些含钾丰富的食物,如香蕉、橙子、山药等,并指导患儿出院后遵医嘱服药,积极控制原发病,不可随意调整药量,保持良好的饮食及生活方式,定期复查。注意监测血压并定期复查电解质。后续复查3 例患儿血钾均可上升至3.6 mmol/L以上。
2.2 与丢失增多有关导致低钾血症的护理
大多数钾存在于人体的细胞内,少量存在于细胞外,起到维持细胞新陈代谢、调节体液渗透压、维持酸碱平衡的作用。钾离子是人体不可缺少的重要电解质,其作用主要是维持神经系统、肌肉的正常功能,人体一旦缺钾,正常的运动就会受到影响,并且还会出现神经类疾病[5-6]。腹泻患儿由于钾离子丢失过多,摄入少,易导致低钾血症。本研究患儿2、患儿3 病程中都伴有呕吐、腹泻等症状,均是由于电解质丢失过多,钾离子丢失,导致低钾血症。患儿2 血钾最低为2.7 mmol/L,患儿3 血钾最低为3.3 mmol/L。患儿2、患儿3 为同卵双胎,均诊断为CAH、21-OHD、SV。目前,此类型替代治疗的皮质醇有属糖皮质激素的氢化可的松和属盐皮质激素的氟氢可的松。相关文献[7-8]指出,对于轻中度感染时(发热体温高于38 ℃、中等重度腹泻)氢化可的松增加至原剂量的2~3 倍,分4次服用至病愈。而属盐皮质激素的氟氢可的松主要的作用是保钠和排钾,其可以促进肾小管重吸收,并排泄钾,应立即停用,同时对患儿进行补钾治疗。患儿病程中伴有呕吐,口服补钾效果差,与医生沟通后直接予其静脉补钾。静脉补钾时钾浓度≤0.3%,补钾速度不超过40.0 mmol/h,补液时,护士要加强巡视,注意观察患儿输注部位皮肤有无红肿热痛,谨防静脉炎的发生,并观察患儿的心率、呼吸、肌张力、尿量等情况。护理人员还应该积极主动地与患儿家长进行沟通交流,通过肢体语言等方法缓解家长焦虑、紧张的情绪,制定适宜的个性化宣教,并将患儿低钾血症的发病原因、临床表现及需要重点关注的注意事项及时告知患儿家长。另外,还要给予患儿精心的护理,引导患儿心理积极向上、乐观开朗,使其能够建立信心,勇敢地战胜病魔。指导患儿家长多注意饮食方面的问题,为患儿准备清淡、易消化饮食,多食高维生素、富含钾的食物、蔬菜、果汁等,不要食用高油脂的食物,重视饮食补钾。 患儿出院后护理人员应指导其保持良好的饮食及生活方式,遵医嘱服药,积极控制原发病,监测血压并定期复查电解质,防治各种急、慢性并发症[9]。
2.3 与摄入减少有关导致低钾血症的护理
患儿进食少,引起低钾血症,如患儿8。患儿本次因“发热,胃口差进食少”入院,不伴有腹胀、恶心等胃肠道症状。实验室检查提示,血钾最低为3.2 mmol/L。低钾血症的危害在于造成水电解质酸碱平衡紊乱,影响身体的各个器官和系统,会给身体带来危害,若不能采取有效措施积极治疗,则会严重影响患儿的身体健康。考虑到患儿有发热,积极予以患儿药物及物理降温,嘱其卧床休息,多饮温水,予以清淡、易消化的饮食,同时注重提高饭菜的可口度。口服补钾是最直接、方便且简单易行的办法,具有维持时间长的优点,早期大剂量口服补钾对于治疗低钾血症具有良好疗效[10-11]。遵医嘱给予患儿10%氯化钾注射液口服,在尿量正常后开始静脉补钾。治疗期间记录24 h 出入量,尤其是尿量,注意监测 血压、脉搏的变化,视病情监测24~48 h。在血钾达到正常水平后停止静脉补钾,继续给予口服补钾,补钾量为10 %氯化钾每次10 mL,3 次/d,持续1~3 d。而10%氯化钾注射液口感比较差,对胃肠道又有刺激作用,容易导致患儿出现恶心、呕吐、腹泻等胃肠道反应,同时10%氯化钾注射液味道苦涩,患儿很难配合坚持治疗。有研究[12]结果表明,10%氯化钾注射液与橙汁同饮不影响治疗效果。医护人员积极与患儿家长沟通,在取得家长同意后,将10%氯化钾注射液加入患儿喜欢喝的橙汁中一同饮用。观察患儿无不良反应后,继续采用此法让患儿饮用。1 周后复查血钾上升至3.9 mmol/L。考虑到患儿在住院期间出现了焦虑、恐惧的不良情绪,这些情绪可能还会导致其出现心率失常、心悸等症状,对患儿的生活质量造成更为严重的影响。为此,护理人员开始加强对患儿的护理干预,实行了一系列的健康教育。首先,让患儿在进食前选择含钾量更多的食物。其次,为了保证患儿能够有更好的睡眠,为其安排单间病房,争取做到早睡早起。最后,开展治疗性游戏,在与患儿沟通交流中介绍低钾血症的相关疾病知识,使患儿更了解发生低钾血症的原因、临床表现、危害以及治疗方法,提升患儿对疾病的认识和依从性,配合医护人员的治疗。最后,护理人员还要告知患儿家长相关病情,让家长对患儿疾病情况和治疗措施充分了解,以便其能够辅助患儿进行治疗[13]。出院后,告知家长由于患儿长期服用激素,容易导致抵抗力低下,易发生感染,应加强营养,注意劳逸结合,少去人群聚集的地方[14]。
2.4 营养状态差导致低钾血症的护理
患儿营养不良,吸收能力较差,导致低钾血症,如患儿1。患儿入院时精神反应差、严重脱水貌,伴有腹泻、呕吐等临床症状,考虑患儿发生了肾上腺危象,立即遵医嘱,按肾上腺危象处理。建立静脉双通路,予生理盐水20 mL/kg 快速补液,氢化可的松10 mg(50 mg/m2),首剂静脉输注,心电监护监测生命体征,记录24 h出入量。留取血标本,送检验科化验,注意保护血管,尽量选择粗直的静脉血管,减轻钾输注时的不适感。遵医嘱用药,动态调整钾的输注量,及时复查血气水平,密切关注血钾的变化。补钾过多很容易引起高钾血症,这一点要引起高度重视,严密观察患儿的临床症状,及时复查血钾指标,根据具体情况制定个性化的补钾计划,更加精确地控制患儿的血钾水平,使补钾更具有针对性。在补钾治疗前先采血确定血钾指标,能够有效避免因补钾量过少或过多而引发的一系列并发症。同时,为了取得患儿家长的理解与配合,提前告知患儿及家长,临床可能需要多次抽血化验,目的是为了能够让患儿的低血钾情况得到有效治疗,争取让家长能理解护士多次采血的操作,为接下来的治疗打下良好的基础。除此之外,还要定时监测患儿的生命体征,如呼吸、心率、血压等变化情况,密切观察患儿的呼吸频率,一旦发生异常,应立即报告医生。避免患儿在治疗期间出现呼吸肌麻痹、室颤等严重情况,导致病情恶化,从而危及生命[15-16]。同时,考虑到患儿喂药困难,予其留置胃管,Q3 h 鼻饲配方奶40 mL,并将10%氯化钾注射液稀释到配方奶中,通过鼻饲的方法补钾。口服及静脉补钾后,1 d内血钾上升至3.7 mmol/L。
2.5 药物相关导致低钾血症的护理
氟氢可的松过量时盐皮质激素过多,保钠排钾作用增强,体内钾被过多排出时就会导致低钾血症,如患儿6。此类患儿应立即调整药物剂量,同时注意增加含钾丰富食物的摄入,后复查血钾上升至3.6 mmol/L。护理人员应对家长行健康教育,告知其应严格遵医嘱用药,告知家长不要轻易调整药量,在发生应激性事件如感染、手术等情况时,应遵医嘱适量调整激素用药,如未按医嘱用药会导致CAH 控制不佳。当CAH 控制不佳时,ACTH 和血管紧张素Ⅱ增高,可能刺激肾上腺皮质残余细胞增生,发生性腺肾上腺残余瘤(ART)[17],如患儿5。同时也会发生肾上腺危象、继发中枢性性早熟、肾上腺腺瘤、成年矮身材等并发症。因此,临床医生和家长往往对替代不足更加重视。国内CAH 指南[18]建议所有CAH 患儿均需监测盐皮质激素缺乏或过量的迹象。临床医生应根据血压、血清钠、钾和血浆肾素活性定期重新评估盐皮质激素和钠的剂量。如未遵医嘱用药,不仅会导致低钾血症的发生,还会引起一系列的并发症,作为护理人员应告知家长这些危害,以引起家长对遵医嘱用药的重视。
综上所述,当发现CAH患儿发生低钾血症时,需要从CAH 的类型、摄入减少、丢失增多、盐皮质激素剂量以及合并疾病等方面进行分析、治疗,积极采取护理措施和宣教。

