石灰石制备食品级球霰石碳酸钙微球及其机理研究
蒙 梅,谢 燕,鲁镜镜,冯伦伟,刘 艳
(贵州大学化学与化工学院,贵阳 550025)
0 引 言
碳酸钙(CaCO3)是自然界中常见的矿物成分,主要以方解石(calcite)、文石(aragonite)和球霰石(vaterite)三种矿物形式存在[1-2]。球霰石为亚稳态晶体,容易溶解-再结晶转化成热力学性质更稳定的文石或方解石[3],但其具有白度高、溶解性好、比表面积大及生物兼容性强等特点,在食品工业[4]、生物医药[5]和复合材料[6]等领域极具应用前景和经济效益。在应用范围方面,食品级CaCO3比工业级CaCO3具有更广泛的利用价值,当CaCO3产品质量符合《食品安全国家标准 食品添加剂 碳酸钙》(GB 1886.214—2016)[7]标准要求时,可应用于碱性剂、固化剂、营养补充剂、填充剂和保健食品等领域中,这在一定程度上满足了CaCO3的高值利用[8]。
目前CaCO3的制备研究多使用CaCl2、Ca(OH)2、Ca(NO3)2等化合物作为直接钙源,生产成本较高。此外,将石灰石矿进行盐酸酸解处理后,可用于制备高纯度的CaCO3,但是此工艺产生的氯化物副产物难以回收利用,给环境造成了一定压力。而使用硝酸为酸解剂时,副产物硝酸铵钙可作为氨肥进行回收[9],从而实现了石灰石的高值化利用。CaCO3的制备方法有碳化法、复分解法及水/溶剂热法等[10-12]。碳化法被广泛应用于CaCO3的晶体合成研究,这一方法不仅能获得多晶型的CaCO3,同时能实现CO2的捕获和永久封存[10]。单一相球霰石型CaCO3的合成取决于溶液介质的温度、pH值以及过饱和度等条件[13]。此外,引入晶型控制剂可促进球霰石的稳定合成。例如,Luo等[14]以L-天冬氨酸为晶型控制剂,在碳化法体系中合成了球霰石晶体。赵历[15]以CaCl2为原料,通过氨水调控溶液的初始pH值,利用CO2气体模板法制备了球霰石。使用氨(NH3)作为晶型控制剂,不仅能合成单一的球霰石相,还因为NH3具有易挥发性,不会给体系引入其他杂质。在NH3存在的体系中,铵根离子(NH4+)已被证明对亚稳态球霰石晶体的生长和稳定具有促进作用[16]。然而,Mani等[17]证明,当CO2和NH3同时存在时,会生成氨基甲酸根(NH2COO-)。因此,本文在此基础上提出NH2COO-和NH4+共同诱导生成球霰石的机理。
本文以石灰石为原料,HNO3为酸解剂、Ca(OH)2为沉淀剂对石灰石进行除杂后制得Ca(NO3)2溶液,以Ca(NO3)2溶液为钙源,在氨氛围下,利用CO2碳化法制备球霰石型食品级CaCO3。采用扫描电子显微镜(FESEM)、X-射线衍射仪(XRD)以及红外光谱(FTIR)等技术手段分析产物的形貌和晶型结构,探讨碳化工艺参数对CaCO3晶型的影响,同时提出NH2COO-对球霰石影响的机理。
1 实 验
1.1 原 料
石灰石取自贵州息烽,主要成分见表1。高纯CO2气体、硝酸、氨水(质量分数为22%~25%)、氢氧化钙、氢氧化钠和无水乙醇均为分析纯。去离子水为实验室自制。

表1 石灰石的主要成分
1.2 碳酸钙制备
1.2.1 硝酸钙制备
取5.00 g石灰石于250 mL三口烧瓶内,在搅拌的过程中缓慢滴加45 mL 2 mol/L的HNO3酸解反应至无气泡生成,过滤除去酸不溶物杂质;继续向滤液中加入少量的Ca(OH)2,搅拌使溶液pH≈11.80,静置使杂质充分沉淀,二次过滤制得Ca(NO3)2溶液。
1.2.2 碳酸钙制备
取40 mL Ca(NO3)2溶液于250 mL三口烧瓶内,匀速搅拌,向溶液中通入CO2气体,同时缓慢滴入15 mL不同浓度的NH3·H2O进行反应;通气15 min后,继续匀速搅拌反应一段时间,所得CaCO3样品经陈化后用真空抽滤,并使用去离子水和无水乙醇洗涤3~5次;滤饼置于60 ℃的干燥箱内烘干,得到CaCO3产物。
1.3 样品表征
采用荷兰Panalytical Zetium 型的X射线荧光光谱仪(XRF)分析样品的化学组成,采用美国赛默飞Quattro S型的场发射扫描电子显微镜(FESEM)观察样品的形貌,采用日本理学Ultima IV型X射线粉末衍射仪(XRD)分析样品的物相组成及晶体结构,采用Nicolet IS5型的傅里叶变换红外光谱仪(FTIR)测样品中官能团的种类,推断样品的晶体结构。
2 结果与讨论
2.1 去除杂质
由石灰石成分分析(表1)可知,石灰石中含有酸不溶物SiO2和金属元素Fe、Al、Mg等。根据SiO2不溶于酸的特点,选择HNO3溶解石灰石,使Ca2+溶解进入溶液,过滤后实现Ca2+与酸不溶物的分离。由于大部分金属阳离子的氢氧化物都是难溶物,根据金属离子完全沉淀(c<10-5mol/L)的pH-pKsp图[18](见图1)可知,当pH=11.13时,Mg2+可完全沉淀,而Ca(OH)2完全沉淀的pH=13.37,其他金属离子杂质的氢氧化物沉淀完全时pH值相对较小。因此,本文通过调节溶液pH值,以Mg2+除尽为杂质完全去除标准,利用分步沉淀法实现杂质与Ca2+的完全分离。通过控制HNO3加入量以及调控溶液pH值来优化除杂条件,制备Ca(NO3)2溶液。
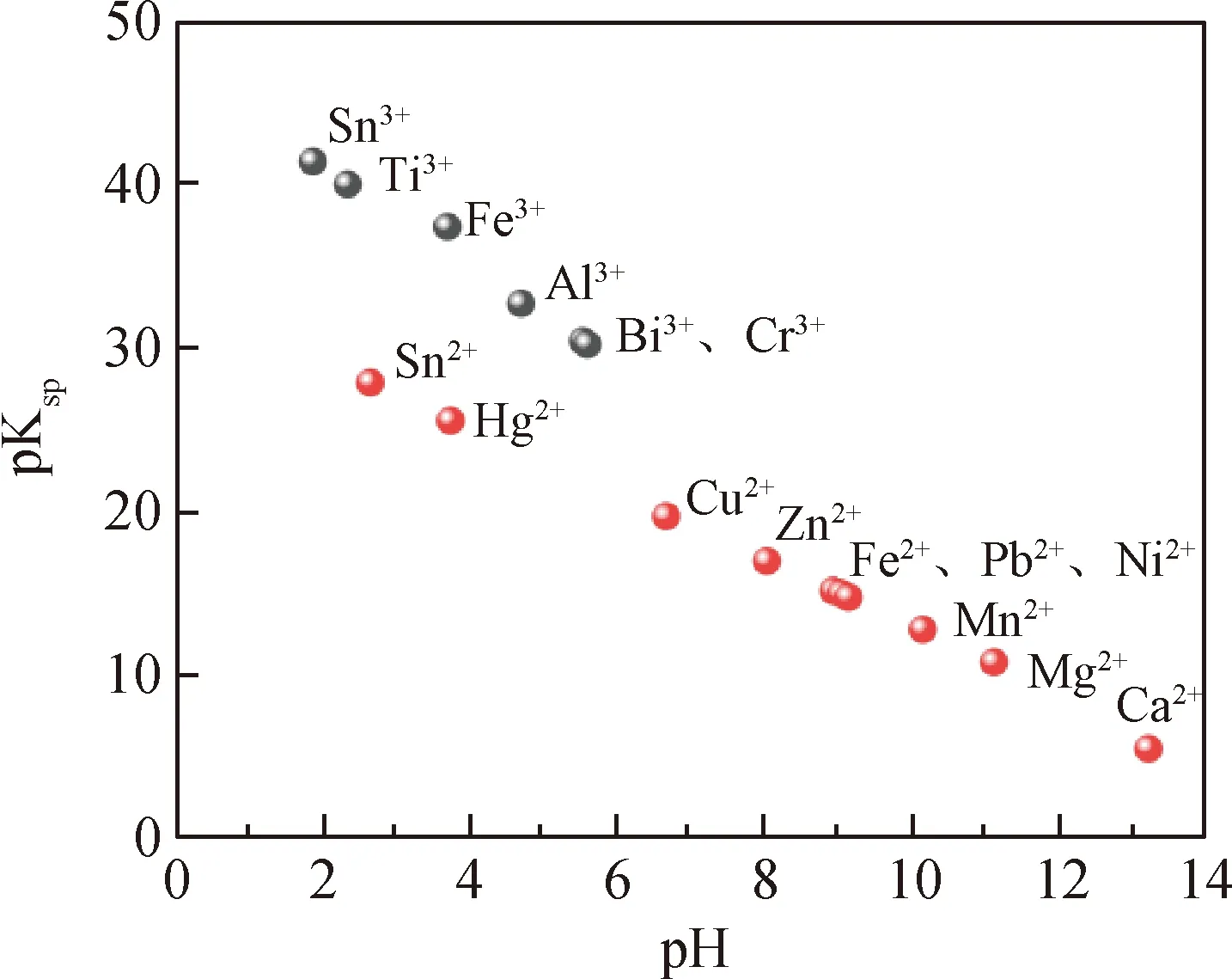
图1 金属离子沉淀的pH-pKsp图[18]
2.1.1 硝酸投加量的选择
不同HNO3投加量下滤渣占原料的质量分数以及滤液中Ca2+的浓度变化如图2所示。由图2(a)可知,滤渣含量随着HNO3投加量的增加而下降,当加入2 mol/L HNO3与石灰石的比值达到9∶1(mL∶g,下同)时,滤渣质量趋于稳定,此时滤渣中基本只存在酸不溶物。图2(b)表明Ca2+的浓度随着HNO3投加量的增加而增加,当HNO3用量与石灰石质量比达到9∶1时,原料中的Ca2+大量析出,此时溶液中Ca2+浓度基本达到稳定。因此,从经济实用性分析,选择HNO3与石灰石的用量最佳比值为9∶1。

图2 HNO3投加量对滤渣占原料质量分数和滤液中Ca2+浓度的影响
2.1.2 除杂pH值优化
为避免引入杂质,选用Ca(OH)2为沉淀剂。Ca(OH)2不仅可以沉淀Fe、Al、Mg等金属杂质,同时引入了Ca2+参与反应。加入Ca(OH)2调控Ca(NO3)2溶液的pH值,除杂后滤液中Ca2+和Mg2+浓度随溶液pH值变化如图3所示。从图3可知,随着溶液碱性增强,溶液中Mg2+含量大幅减少。理论上,当pH=11.13时,Mg2+浓度小于10-5mol/L[8],但为了进一步去除杂质元素,本研究以pH=11.80为杂质沉淀完全的最佳pH值。
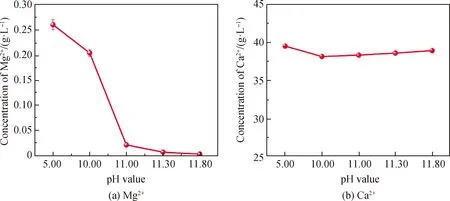
图3 不同pH值下Ca(NO3)2溶液中Mg2+与Ca2+浓度的变化
2.2 反应参数对碳酸钙晶型的影响
在氨氛围下,向精制后的Ca(NO3)2溶液中通入CO2气体制备CaCO3沉淀,研究反应参数对CaCO3晶型的影响。
2.2.1 NH3·H2O浓度对碳酸钙晶型的影响
图4和图5为不同NH3·H2O浓度下碳化产物的FESEM照片和XRD谱。由于没有添加剂的作用,当CaCO3沉淀时,CaCO3迅速结晶形成热力学性质极不稳定的无定形碳酸钙(ACC),然后向纳米球霰石颗粒转变。而球霰石为亚稳态晶体,在溶液介质中容易转换成更稳定的方解石晶相[19]。因此,当未添加NH3·H2O时,制得的CaCO3为菱形晶体,且表面有大量的纳米球霰石颗粒附着(图4(a))。对应XRD谱(图5)显示,此时CaCO3样品存在尖锐的方解石(104)晶面(2θ=29.4)特征峰,而球霰石的(110)晶面(2θ=24.9)特征峰较弱,表明在无NH3作用时,碳化产物为方解石和球霰石混合晶相。当添加浓度为2%(质量分数,下同)的NH3·H2O时(图4(b)),CaCO3为球霰石和方解石混合晶相,且在NH3的作用下,纳米球霰石团聚形成球霰石晶体微球。随着NH3·H2O浓度增加,方解石的(104)晶面衍射峰减弱,当NH3·H2O浓度为6%时,CaCO3为团聚的球霰石微球(图4(c)),此时XRD谱上方解石的晶面特征峰消失,只存在球霰石的特征峰,表明CaCO3为单一的球霰石相。NH3·H2O浓度为13%时,CaCO3呈较为均匀的球霰石微球(图4(e)),且当NH3·H2O浓度继续增加,CaCO3的形貌基本不再发生变化,通过XRD分析样品均为单一的球霰石相。可见,在浓度较高的NH3·H2O溶液中,合成的球霰石晶型完整,且颗粒大小更加均匀。因此,选用13%的NH3·H2O浓度为制备球霰石的最佳条件。

图4 不同NH3·H2O浓度下碳化产物的FESEM照片
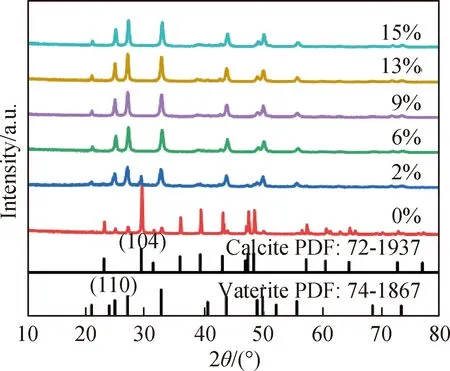
图5 不同NH3·H2O浓度下碳化产物的XRD谱
2.2.2 CO2流量对碳酸钙晶型的影响
利用FESEM分析不同CO2流量下的碳化产物,FESEM照片如图6所示,各CO2流量制得的CaCO3均为球型晶体。当CO2流量为0.05 L/min时,由于CO2流量较低,CaCO3沉淀速度较慢,且由于静电作用,局部区域晶体结晶不均匀,形成的部分晶体颗粒粒径较大[15]。随着CO2流量增加,CaCO3晶体粒径明显变小,且逐渐呈均匀大小的微球晶体。XRD谱(见图7)显示,在不同CO2流量下制备得到的产物均为球霰石。考虑到在低流量条件下,合成的CaCO3颗粒不均匀、粒径较大,且流量较低时CaCO3沉淀速度较慢,不利于CaCO3的合成。因此,选用CO2流量为0.5 L/min为碳化反应的最佳条件,制备得到均匀的球霰石晶体微球。

图6 不同CO2流量下碳化产物的FESEM照片

图7 不同CO2流量下碳化产物的XRD谱
2.2.3 反应温度对碳酸钙晶型的影响
图8和图9分别为不同反应温度下碳化产物的FESEM照片和XRD谱。由FESEM照片(图8)可知,随着反应温度升高,CaCO3从球型晶体逐渐向团聚的纺锤体转变。当温度为15 ℃时,根据XRD谱(图9),CaCO3的结晶态衍射峰不明显,说明此时产物主要为ACC。这主要是因为在温度较低的溶液中,晶体成核速率较小,因此不稳定的晶体能够稳定存在,从而形成ACC。由于ACC极不稳定,当温度升高时,ACC的稳定性被破坏并向球霰石晶体转变[19]。因此,当反应温度为25 ℃时,产物为单一相球霰石。然而,球霰石为亚稳态晶体,溶解度较低,在温度较高的溶液中易发生溶解-再结晶向稳定的方解石转变[20]。当升温至35和45 ℃时,球霰石的晶体表面开始溶解成团聚的纺锤体球霰石,且XRD谱中出现了较弱的方解石(104)晶面的衍射峰,表明产物中存在少量的方解石。因此,过高的反应温度不利于球霰石的可控合成,选择反应温度25 ℃为球霰石合成的最佳温度。

图8 不同反应温度下碳化产物的FESEM照片

图9 不同反应温度下碳化产物的XRD谱
2.2.4 反应时间对碳酸钙晶型的影响
不同反应时间下制备CaCO3的FESEM和XRD表征如图10和图11所示。当反应时间为25和45 min时(图10(a)、(b)),CaCO3均为微球晶体,XRD谱(图11)分析表明,此时产物均为单一相球霰石,随着反应时间增加,球霰石逐渐向方解石转化。当反应时间增加至60 min时,出现了少量菱形方解石晶体(图10(c))。反应时间继续增加至180 min,方解石的(104)晶面特征衍射峰增强,产物中的菱形方解石晶体增多,但主要以球霰石微球晶体为主。综上可得,增加反应时间会使亚稳态球霰石向稳定的方解石晶相转变,不利于球霰石的合成。因此,选择25 min为制备球霰石的最佳时间。

图10 不同反应时间下碳化产物的FESEM照片
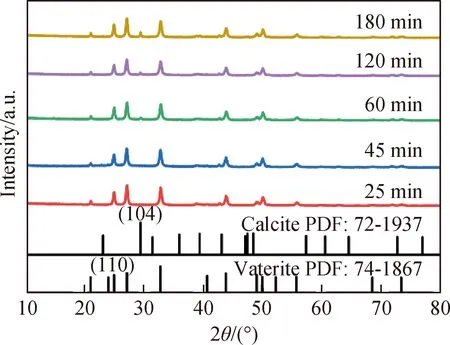
图11 不同反应时间下碳化产物的XRD谱
2.3 球霰石的生长机理分析
NH3对CaCO3晶型有较大的影响。结合图4和图5分析可知:当体系中不存在NH3时,碳化反应生成的CaCO3以菱形方解石为主;当反应体系中加入一定量NH3后,产物为单一球霰石型CaCO3。说明在碳化反应体系中,NH3是调控球霰石晶体形态的关键因素。以Ca(NO3)2为钙源,在氨氛围下的碳化体系中制备CaCO3,其反应及其反应平衡常数Keq见式(1)~(4)[17]。

(1)
(2)
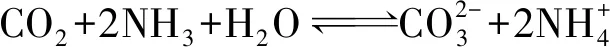
(3)
(4)


图12 CaCO3晶体的生长示意图
2.4 最佳条件下制备碳酸钙的表征分析
2.4.1 产物的形貌表征
在室温(25 ℃)条件下,选择NH3·H2O浓度为13%、CO2流量为0.5 L/min、反应时间为25 min为最佳反应条件,利用碳化法制得球霰石型CaCO3。图13是在最佳反应条件下由碳化法制得球霰石产物的FESEM照片,其中图13(b)为图13(a)的放大图,可以明显看到,产物为3~5 μm的微米级球型晶体颗粒,样品颗粒分布较为均匀。

图13 球霰石的FESEM照片
2.4.2 产物的结构分析

2.4.3 产物的纯度分析
根据《食品安全国家标准 食品添加剂 碳酸钙》(GB 1886.214—2016)[7]要求分析CaCO3产物的各项指标,结果如表2所示。由表2数据可知,产物中CaCO3质量分数高达99.5%,而杂质含量均优于国家标准要求,因此样品可作为食品添加剂应用于食品工业。
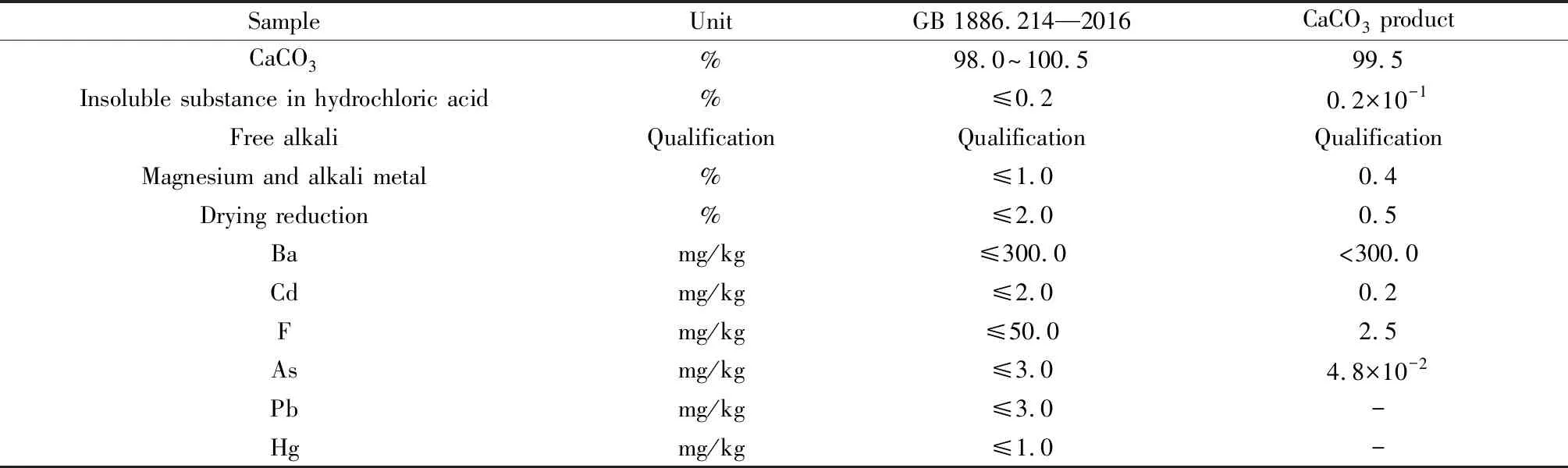
表2 CaCO3产物的纯度分析
3 结 论
1)以石灰石为原料,通过HNO3酸解和Ca(OH)2除杂后,在氨氛围下采用CO2碳化法制备CaCO3。当NH3·H2O浓度为13%时,CaCO3为单一相球霰石微球,且球霰石的晶体颗粒大小均匀,结晶度较好;未添加NH3时,在碳化体系中制得球霰石和方解石的混合晶型。故NH3能促进球霰石的稳定合成。
2)当CO2流量为0.5 L/min、反应温度为25 ℃、反应时间为25 min时为球霰石合成的最佳条件。在低温时,有不稳定的ACC形成,随着温度升高,CaCO3的溶解度降低,ACC向亚稳态球霰石快速转化,并通过溶解-再结晶少量形成方解石。

4)制得的产品CaCO3的质量符合《食品安全国家标准 食品添加剂 碳酸钙》(GB 1886.214—2016)要求,可应用于食品工业。

