PET/CT 中18F-FDG 摄取值联合血清CEA 水平预测肺腺癌EGFR突变的价值
王运 朱红洲 高心逸 嵇建峰 庞伟强 易贺庆 靳水 龙斌 吴红霞 叶雪梅 李林法
肺癌是全球发病率和死亡率最高的恶性肿瘤。非小细胞肺癌(non-small cell lung cancer,NSCLC)约占所有肺癌的85%,其中肺腺癌是最常见的病理类型,近70%的NSCLC 初诊时已处于晚期[1-2]。具有表皮生长因子受体(epidermal growth factor receptor,EGFR)突变的NSCLC 对EGFR 酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)高度敏感。这部分患者在EGFR 靶向治疗辅助下,中位总生存期和无进展生存期均可以得到改善[3]。因此,确定EGFR 突变对肺腺癌治疗优化具有重要意义,临床指南建议在治疗前进行初步EGFR 基因检测。然而,目前EGFR 基因分型须通过组织活检进行,存在缺乏可用组织、有创检查不良事件以及并发症的局限[4]。因此,探索一种无创、便捷的方法来预测EGFR 的突变状态显得尤为重要。最近报道,氟18-脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)摄取程度是NSCLC 的一个重要预后因素[5]。血清癌胚抗原(carcinoembryonic antigen,CEA)是评价肺腺癌最常用的肿瘤标志物,最近有研究进一步证明NSCLC 患者血清CEA 水平是吉非替尼治疗是否有效的重要预测指标,它可能与EGFR 突变有关[6]。目前肺腺癌EGFR 突变与正电子发射型计算机断层显像(positron emission tomography,PET)/CT 中18F-FDG FDG 摄取值和血清CEA 水平之间是否存在相关性尚不清楚。因此,本研究对肺腺癌患者行PET/CT 中18F-FDG 摄取值联合CEA 水平检测,探讨两者预测肺腺癌EGFR 突变的价值,现报道如下。
1 对象和方法
1.1 对象 选取2016 年12 月至2020 年4 月在浙江省肿瘤医院治疗前接受血清CEA 水平、EGFR 突变检测并行PET/CT 检查的肺腺癌患者196 例,其中男104 例,女92 例;年龄29~89(62.0±11.4)岁。纳入标准:(1)经病理检查证实为肺腺癌;(2)术前或活检前1 个月内行18F-FDG PET/CT 检查;(3)PET/CT 检查前没有进行相关治疗;(4)未合并其他恶性肿瘤;(5)单个肺部病灶最大直径>1 cm,避免部分容积效应。排除标准:(1)糖尿病患者血糖水平未达标(>11.1 mmol/L);(2)严重肝肾功能不全;(3)不配合或检查前准备不足;(4)注射给药后检查时间超过60 min。本研究经本院医学伦理委员会审查通过[批准文号:IRB-2022-804号(科)],所有患者均知情同意。
1.2 资料收集 收集患者性别、年龄、吸烟史、肿瘤直径、TNM 分期、原发灶最大标准化摄取值(maximum standardized uptake value,SUVmax)、治疗前血清CEA 水平(正常范围0~5 ng/mL)和有无毛刺等资料。
1.3 检查方法 PET/CT 检查采用Discovery 710 型PET/CT 扫描仪(美国GE 公司),同机CT 为64 排螺旋CT,示踪剂18F-FDG 由上海原子科兴药业有限公司供药,放化纯度>95%。患者检查时禁食至少6 h,血糖水平低于11.1 mmol/L,1 周内未进行胃肠造影检查。静脉注射0.1~0.15 mCi/kg18F-FDG 1 h 后进行检查。患者取仰卧位,双手抱头,范围自头部至大腿上部1/3。CT 扫描参数:管电压120 kV,管电流170 mA,CT 重建层厚3.0 mm。PET 采集7~8 个床位,每个床位3 min。CT 衰减校正后的PET 图像采用有序子集期望值最大化的方法进行重建。
1.4 图像分析 所有PET/CT 数据均由两名主治及以上医师(均不知晓患者的EGFR状态)勾画。在横断位图像上将感兴趣区(region of interest,ROI)置于原发肿瘤部位,测量每个病灶的18F-FDG SUVmax。记录原发肿瘤的CT影像学特征,包括肿瘤的大小、位置和有无毛刺。
1.5 EGFR 突变分析 对手术切除或穿刺获得的组织标本行EGFR 突变分析。具体步骤按照EGFR 突变检测试剂盒(批号:20143402001,厦门艾德生物医药科技有限公司)说明书执行,检测EGFR 第18~21 外显子的突变情况。如果检测到EGFR 外显子18~21 的任何外显子突变,则该肿瘤被认为是EGFR 突变型;否则,将肿瘤归类为EGFR 野生型。
1.6 统计学处理 采用SPSS 17.0 统计软件。符合正态分布的计量资料以表示,组间比较采用两独立样本t检验;不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-WhitneyU检验;计数资料组间比较采用χ2检验。采用二元logistic 回归分析影响肺腺癌患者EGFR 突变的因素。ROC 曲线评估PET/CT 中18F-FDG SUVmax联合血清CEA 水平预测肺腺癌EGFR 突变的效能。P<0.05 为差异有统计学意义
2 结果
2.1 肺腺癌患者临床EGFR 突变状态分析 196 例肺腺癌患者中,EGFR 突变型109 例(55.6%),EGFR 突变亚型以外显子19 缺失和外显子21 的L858R 点突变为主;EGFR 野生型87 例(44.4%)。
2.2 影响肺腺癌患者EGFR突变的单因素分析 EGFR突变型患者女性比例、无吸烟史比例、血清CEA 水平≥5 ng/mL 比例、无毛刺比例均高于EGFR 野生型患者,而肿瘤直径、18F-FDG SUVmax均低于EGFR 野生型患者,差异均有统计学意义(均P<0.05);不同EGFR 突变组间年龄和TNM 分期比较差异均无统计学意义(均P>0.05),见表1。典型EGFR 突变型和野生型患者的18F-FDG PET/CT 表现见图1、2。
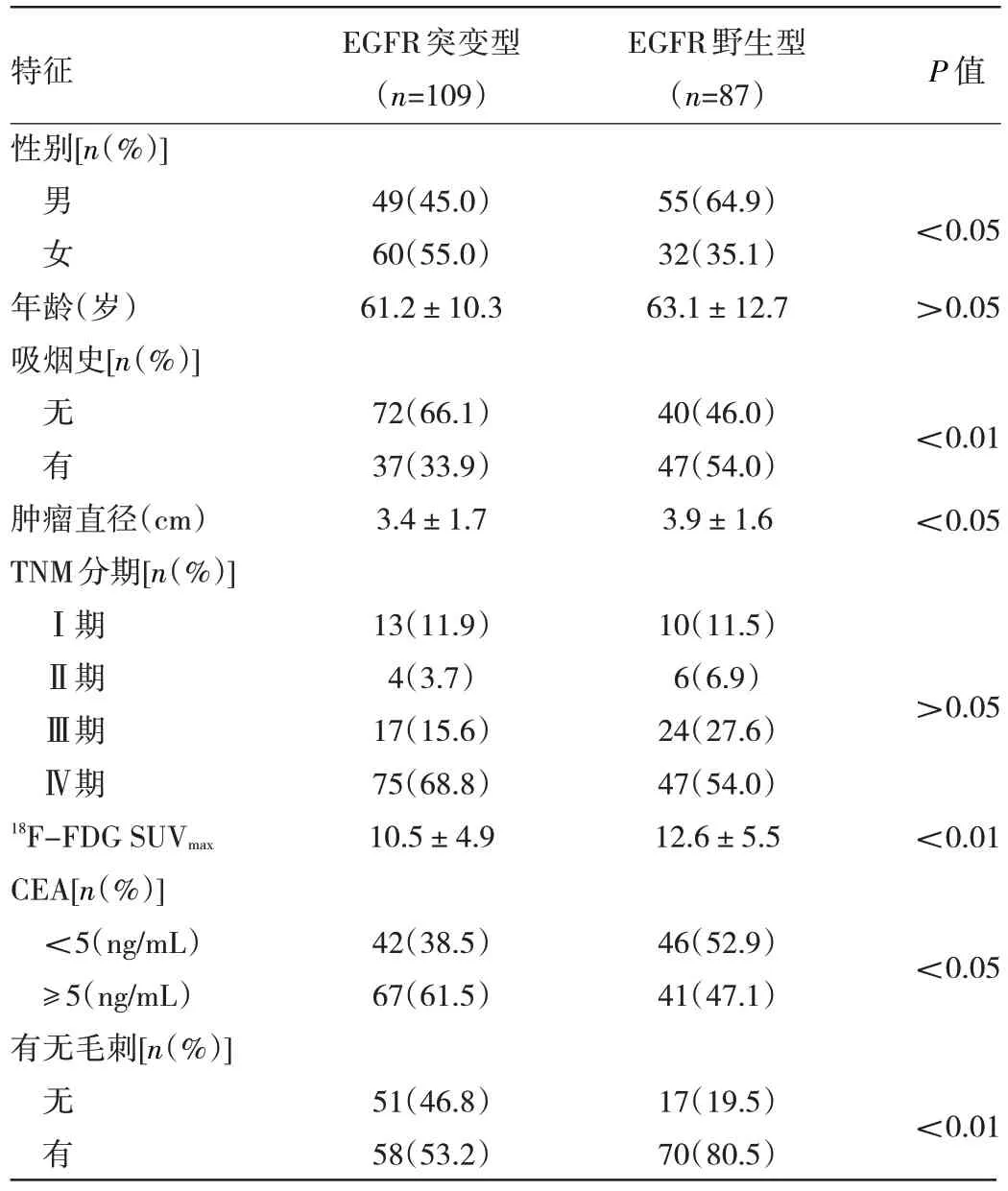
表1 影响肺腺癌患者EGFR 突变的单因素分析
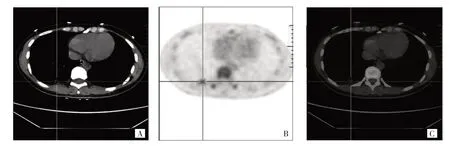
图1 患者,女,39 岁。表皮生长因子受体突变型,融合PET/CT 图像显示右肺下叶一直径约1.4 cm 结节,边缘无毛刺,放射性摄取增高(原发灶18F-FDG SUVmax=4.03),血清CEA 为87.09 ng/mL(A:CT 图像;B:PET 图像;C:PET/CT 图像)
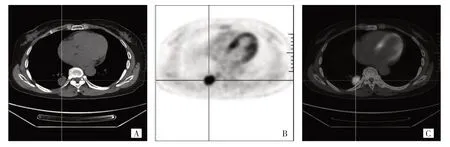
图2 患者,女,60 岁。表皮生长因子受体野生型,融合PET/CT 图像显示右肺下叶一直径约2.9 cm 结节,边缘有毛刺,放射性摄取异常增高(原发灶18F-FDG SUVmax=18.62),血清CEA 为2.52 ng/mL(A:CT 图像;B:PET 图像;C:PET/CT 图像)
2.3 影响肺腺癌患者EGFR 突变的多因素分析 将上述单因素分析有统计学意义的指标纳入二元logistic回归分析,结果显示18F-FDG SUVmax<12.8(ROC 曲线分析得出)、血清CEA 水平≥5 ng/mL、肿瘤直径较小、无毛刺是影响EGFR 突变的独立预测因素(均P<0.05),见表2。
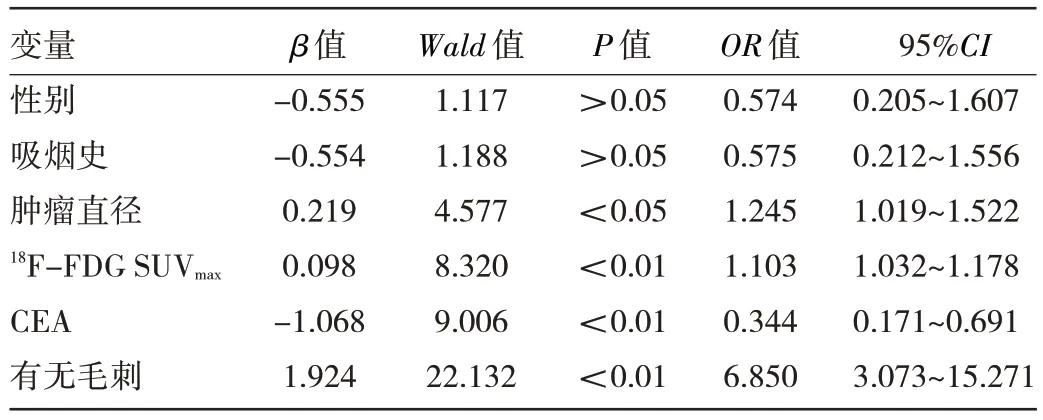
表2 影响肺腺癌患者EGFR 突变的多因素分析
2.4 PET/CT 中18F-FDG 摄取联合血清CEA 水平预测肺腺癌EGFR 突变的价值 ROC 曲线显示18F-FDG SUVmax临界 值为12.8,相应的AUC 为0.613(95%CI:0.534~0.692)。当SUVmax<12.8 时,其预测EGFR 突变的灵敏度为0.725,特异度为0.483,准确度为61.7%,阳性预测值为63.7%,阴性预测值为58.3%。当18F-FDG SUVmax联合血清CEA 水平、肿瘤直径、有无毛刺时,相应的AUC 为0.754(95%CI:0.686~0.823),见图3。

图3 18F-FDG SUVmax联合血清CEA 水平、肿瘤直径、有无毛刺预测肺腺癌患者EGFR 突变的ROC 曲线
3 讨论
肺腺癌是NSCLC 中最常见的病理亚型,近年来发病率有上升趋势。与整体NSCLC 患者相比,带有EGFR 激酶区域突变的NSCLC 患者更有可能是亚洲人或女性,有肺腺癌组织学亚型和非吸烟史[7]。本研究中,109 例(55.6%)患者检测到EGFR 突变,这与亚洲人群中之前的研究结果一致(49%~64%),但高于美国报道的患病率(10%~24%)[8]。这些差异可能反映了肺腺癌发生的不同机制,可归因于种族差异。此外,吸烟史和性别也是EGFR 突变状态的预测因素。不同EGFR 突变组患者年龄、TNM 分期比较差异均无统计学意义。
既往研究报道EGFR 突变预示着接受TKI 治疗的患者预后良好[9-10]。确定EGFR 突变状态对于选择可能受益于EGFR TKI 治疗的患者和预测临床患者预后至关重要。然而,肺腺癌EGFR 检测可能具有一定的局限性[11-12]。
PET 摄取18F-FDG 可能是潜在肿瘤基因型的无创性生物标志物。EGFR 基因的突变激活蛋白激酶B 信号通路,进一步促进癌细胞消耗葡萄糖,刺激其生长和存活[13]。以往与EGFR 基因分型相关的18F-FDG PET/CT 研究主要集中在基于肉眼或定量18F-FDG PET参数的主观传统特征分析来预测EGFR 突变状态。以往的研究报道了不同18F-FDG SUVmax阈值来预测肺癌EGFR 的突变状态[7,14-15]。Kim 等[16]发现EGFR 突变组的所有代谢参数和体积参数均显著低于EGFR 野生型肺腺癌。本研究中,EGFR 突变型组18F-FDG SUVmax低于EGFR 野生型组。尽管18F-FDG SUVmax具有显著的区分能力,但在之前的研究中,EGFR 突变型组和野生型组之间存在很大的重叠,导致了相互矛盾的结果。Lv等[7]发现在849 例NSCLC 患者中,18F-FDG SUVmax<7.0时是EGFR 突变的预测因子,AUC 值为0.557。Na 等[17]发现在100 例NSCLC 患者中,18F-FDG SUVmax截断值<9.2 是EGFR 突变的预测因子,其AUC 值为0.74。Mak等[8]发现在100 例NSCLC 患者中,18F-FDG SUVmax<5.0是EGFR 突变的预测因子,其AUC 值为0.62。Cho 等[18]发现在61 例NSCLC 患者中,18F-FDG SUVmax<9.6 是EGFR 突变的预测因子,其AUC 值为0.68。此外,Guan等[19]发现在316 例NSCLC 患者中,18F-FDG SUVmax<8.1是EGFR 突变的预测因子,其AUC 值为0.65。但有两组报道的结果相反,Ko 等[20]发现18F-FDG SUVmax≥6 是132 例肺腺癌患者EGFR 突变的预测因子,其AUC 值为0.63;Huang 等[21]发现,在77 例肺腺癌患者中,18FFDG SUVmax≥9.5 是EGFR 突变的预测因子。以往研究的不一致性和相对较低的区分能力可能是因为传统的SUV 测量未能捕捉到空间体素之间的SUV 特征。本研究中,虽然通过ROC 曲线分析确定18F-FDG SUVmax的临界值为12.8,但必须强调的是,18F-FDG SUVmax是一个半定量的指标,在不同的中心或PET 扫描仪之间会有所不同,这取决于禁食时间、血糖水平、成像时间、重建算法和ROI 参数。
目前,血清CEA 水平测定是肺癌常用的肿瘤标志物,因为有报道称35%~70%的NSCLC 患者CEA 水平升高,特别是在肺腺癌和晚期疾病患者[22]。Okamoto等[23]研究报道,与低CEA 水平相比,接受TKI 治疗的患者治疗前CEA 水平高与更长的生存期和更好的反应相关。Shoji 等[24]首次研究了EGFR 突变与CEA 水平的关系,并报道了血清CEA 水平>5 ng/mL 的患者的EGFR突变率显著高于CEA 水平<5 ng/mL 的患者。可能的潜在机制是突变的EGFR 途径的抗凋亡信号,它可能上调CEA 蛋白的表达水平。Ko 等[25]对132 例肺腺癌患者的研究发现,18F-FDG SUVmax≥6 和CEA 水平≥5 ng/mL的患者更有可能发生EGFR 突变(均P<0.05)。较大肿瘤(≥3 cm)和边缘无毛刺的肿瘤的CT 特征也与EGFR 突变相关(均P<0.05)。多因素分析显示,较高的18F-FDG SUVmax和CEA 水平、从不吸烟和肿瘤边缘无毛刺是EGFR 突变的最有意义的预测因素。联合使用这4 个指标,得出的AUC 较高,为0.82。本研究结果与Shoji 等[24]的结果一致,尽管预测EGFR 突变的灵敏度和特异度分别只有0.725 和0.483。肺腺癌患者的CT 表现和分子状态之间的相关性尚不清楚,只有少数研究解决了这一问题。本研究结果显示,肿瘤边缘无毛刺是EGFR 突变的预测因素。本研究结果与Ko等[25]的结果一致。早些时候的一项研究指出,在有淋巴结转移或血管侵犯的晚期肺腺癌中,肿瘤边缘常出现粗糙且有毛刺的情况[25]。Meniga 等[26]也报道称边缘有毛刺的NSCLC 患者预后更差。本研究发现与这些概念是一致的,因为在本研究EGFR 野生型组中,有毛刺的肿瘤(80.5%)倾向于观察到更晚期(Ⅲ~Ⅳ)的肿瘤。此外,众所周知,EGFR 野生型患者较EGFR 突变型患者预后更差。因此,本研究推测无毛刺的肿瘤边缘与EGFR 突变有关。
综上所述,本研究结果提示,在亚洲肺腺癌人群中,EGFR 突变与临床和影像学因素有关,包括FDG 摄取、血清CEA 水平、CT 影像上的有无毛刺和肿瘤直径。这4 个因素的联合评估可能有助于区分突变状态,特别是在采样不足或基因检测不可用的情况下。

