三阴性乳腺癌组织中HK3 表达及临床意义
唐玮 李建棣 陈易 黄素宁
乳腺癌是全球女性发病率最高的癌症,且其发病率和死亡率逐年升高[1]。近年来,我国乳腺癌的发病率和死亡率虽然低于全球平均水平,但自身对比,也呈逐年攀升的趋势,2022 年乳腺癌新发病例将近43万[2]。虽然我国乳腺癌患者总体的5 年生存率已达80%,但三阴性乳腺癌(triple-negative breast cancer,TNBC)是具有强侵袭性的乳腺癌亚型,不能从内分泌治疗和靶向治疗中获益,故这类患者预后较差。TNBC是指乳腺癌中雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人表皮生长因子受体2(human epidermal growth factor receptor 2,Her-2)均为阴性的亚群。TNBC 占乳腺癌群体的15%~20%。目前发现TNBC 乳腺癌易感基因1/2(breast cancer susceptibility gene 1/2,BRCA1/2)基因的胚系突变高频率为TNBC 最具代表性的分子病理事件[3]。但TNBC 在分子病理机制上的研究仍有诸多未明之处,故积极探究TNBC 的分子机制,寻找判断和治疗TNBC 的新靶点是当前急需突破的工作重点。己糖激酶3(hexokinase-3,HK3),也称HXK3 或者HKⅢ,其基因编号为3101,具有21 个外显子,位于5q35.2。HK3 可促进结肠癌和乳头状肾细胞癌等恶性肿瘤的生长[4-5]。目前HK3 与乳腺癌关系的研究仅见一篇报道,其发现在乳腺癌中HK3 与单羧酸转运体4(monocarboxylate transporter 4,MCT4)的表达有关,可能共同调节乳腺癌的肿瘤免疫微环境[6]。但HK3 在乳腺癌,特别是TNBC 中的临床意义及潜在机制未见报道。故本研究基于循证理念收集了符合纳入标准的TNBC 患者,进行HK3 临床价值及其分子机制的初步探讨,现报道如下。
1 材料和方法
1.1 HK3 在乳腺癌及TNBC 组织中的表达 乳腺癌基因芯片、RNA-seq 数据集下载自基因表达综合(gene expression omnibus,GEO)、癌症基因组图谱(the cancer genome atlas,TCGA)、序列读长档案(sequence read archive,SRA)、阵列表达(ArrayExpress)及国际乳腺癌协会的分子分类(molecular taxonomy of Breast Cancer International Consortium, METABRIC)数据库。纳入标准:(1)人原发性乳腺癌组织;(2)同一平台矩阵内乳腺癌、正常乳腺组织样本数各≥3(或TNBC、非TNBC组织样本数各≥3)。排除标准:(1)转移性乳腺癌;(2)复发性乳腺癌;(3)乳腺癌细胞系;(4)乳腺癌动物模型;(5)治疗后乳腺癌患者;(6)重复样本及数据集;(7)缺乏HK3 表达值。下载基因型组织表达的正常乳腺组织测序数据并将其与TCGA-BRCA 数据集合并,扩大对照组样本量。合并平台相同的表达矩阵,利用limma-voom、sva 移除批次效应。计算正常乳腺组织及乳腺癌组织HK3 表达例数、均值、标准差,在随机效应模型下绘制SMD森林图。计算真阳性率、假阳性率、假阴性率、真阴性率,绘制汇总受试者操作特征(summary receiver operating characteristic,SROC)曲线及灵敏度、特异度森林图。
1.2 HK3 在乳腺癌中的预后意义 在GEO、TCGA、SRA、ArrayExpress 及METABRIC 数据库搜集乳腺癌预后数据集,涵盖总生存期(overall survival,OS)、无复发生存期(relapse free survival,RFS)和无进展生存期(post progression-free survival,PPS)等预后数据。纳入标准:(1)乳腺癌转录组表达数据包含HK3 表达值;(2)预后随访数据完整(随访时间、生存状态)。以HK3 的中位表达值为界将TNBC 患者划分为HK3 低表达组和HK3 高表达组,绘制Kaplan-Meier 曲线,并执行Cox 回归分析,计算HR值。最后,对各预后数据集HR值进行合并,展示HK3 在全体乳腺癌及TNBC 中的预后价值。
1.3 乳腺癌及TNBC 组织中的差异基因表达分析 在去除批次效应后的矩阵中批量鉴定乳腺癌高表达基因(乳腺癌组织比正常乳腺组织、TNBC 组织比正常乳腺组织、TNBC 组织比非TNBC 组织),标准如下:SMD>0,P<0.05。
1.4 TBNC 中HK3 共表达基因分析 在批次后的矩阵中提取807 例TNBC 患者的表达矩阵,批量鉴定HK3共表达基因,标准如下:Pearson 相关r≥0.30,P<0.05。
1.5 HK3 相关通路富集分析 筛选至少在4 个数据集中与HK3 正相关的共表达基因,将其与乳腺癌高表达基因(乳腺癌组织比正常乳腺组织、TNBC 组织比正常乳腺组织、TNBC 组织比非TNBC 组织)交集,进行基因本体论(gene ontology,GO)、京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)及Reactome 富集分析。
1.6 乳腺癌组织中HK3 表达与免疫浸润分析 通过肿瘤免疫浸润网站工具(tumor immune estimation resource,TIMER)(https://cistrome.shinyapps.io/timer/),分析乳腺癌组织中HK3 的表达水平与免疫浸润程度之间的关系。
1.7 统计学处理 采用R 4.2 统计软件。全球范围内乳腺组织间(正常乳腺组织比TNBC 组织、TNBC 组织比非TNBC 组织)的HK3 表达差异采用Wilcoxon 符号秩和检验。若这两个结果I2>50%和P<0.05,则选用随机效应模型计算SMD。反之,选用固定效应模型。绘制SROC 曲线评估利用HK3 的表达差异鉴别TNBC组织的能力。P<0.05 为差异有统计学意义。
2 结果
2.1 HK3 在TNBC 组织中显著高表达 在全球范围内收集的乳腺组织数据中,无论是611 例TNBC 组织与711 例正常乳腺组织的HK3 表达水平相比(图1A),还是807 例TNBC 组织与4 010 例非TNBC 组织的HK3 表达水平相比(图1B),TNBC 组织中的HK3 均显著高表达。SROC 曲线提示HK3 的表达水平在正常乳腺组织比TNBC 组织(AUC=0.77,95%CI:0.73~0.81)和TNBC组织比非TNBC 组织(AUC=0.75,95%CI:0.71~0.79)中有较强的鉴别能力,见图2A 和图3A。而在灵敏度分析中,灵敏度分别达0.81(95%CI:0.54~0.94)和0.79(95%CI:0.62~0.89),见图2B和图3B。在特异度分析中,特异度分别达0.61(95%CI:0.34~0.82)和0.58(95%CI:0.39~0.75),见图2C 和图3C。这进一步证实HK3 表达水平具有较强鉴别TNBC 组织的能力。

图1 HK3 在全球TNBC 组织的SMD 森林图(A:HK3 在全球TNBC 组织的SMD 森林图,以正常乳腺组织作对照;B:HK3 在全球TNBC 组织的SMD 森林图,以非TNBC 组织作对照)

图2 HK3在全球TNBC 组织的SROC 曲线图、灵敏度及特异度的森林图(A:SROC 曲线图;B:灵敏度的森林图;C:特异度的森林图)

图3 HK3 在全球TNBC 组织的SROC 曲线图、灵敏度及特异度森林图(A:SROC 曲线图;B:灵敏度的森林图;C:特异度的森林图)
2.2 HK3 表达水平与乳腺癌患者预后的关系 HK3表达水平对乳腺癌患者的RFS 有显著影响(HR=1.76,95%CI:1.22~2.54,P<0.01),见图4。进一步评估HK3的表达水平发现,TNBC 组织中HK3 高表达组较HK3低表达组有更长的OS(HR=0.634,95%CI:0.43~0.94,P<0.05)和PPS(HR=0.55,95%CI:0.31~0.97,P<0.05),见图5。这提示HK3高表达的TNBC患者预后相对较好。
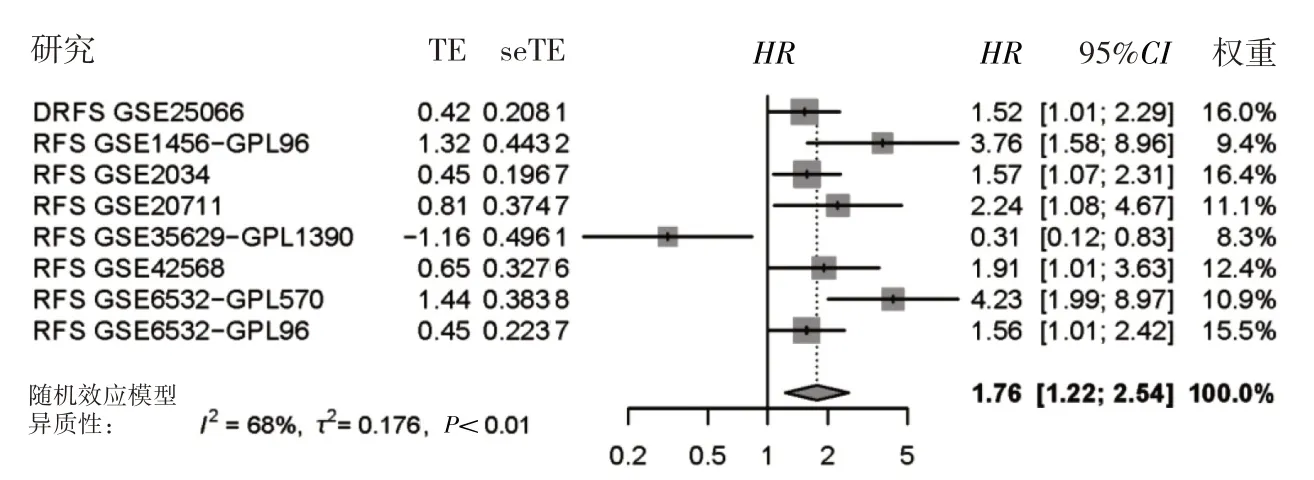
图4 全球乳腺癌患者的预后队列的RFS 的HR 整合分析森林图

图5 全球TNBC 患者预后队列Kaplan-Meier 整合分析的生存曲线图(A:HK3 高表达组和低表达组OS 比较的Kaplan-Meier曲线;B:HK3 高表达组和低表达组PPS 比较的Kaplan-Meier曲线)
2.3 HK3 差异、共表达分析及相关分子机制探索 通过筛选获得了与HK3 通路密切相关的165 个交集基因,见图6(插页)。GO 分析显示,交集基因显著富集于生物学过程的免疫系统过程的负调控等、细胞组分的分泌颗粒膜等和分子功能的免疫受体活性等与免疫系统调控相关的通路,见图7A(插页)。KEGG 分析显示,交集基因显著富集于NOD 样受体信号通路、趋化因子信号通路、Epstein-Barr 病毒(Epstein-Barr virus,EBV)感染和新型冠状病毒感染等与病毒感染和抗病毒免疫有关的通路,见图7B(插页)。交集基因的Reactome 富集主要集中在Toll 样受体4 级联、干扰素信号通路和淋巴细胞与非淋巴样细胞之间的免疫调节相互作用等与免疫机制相关的通路,见图7C(插页)。
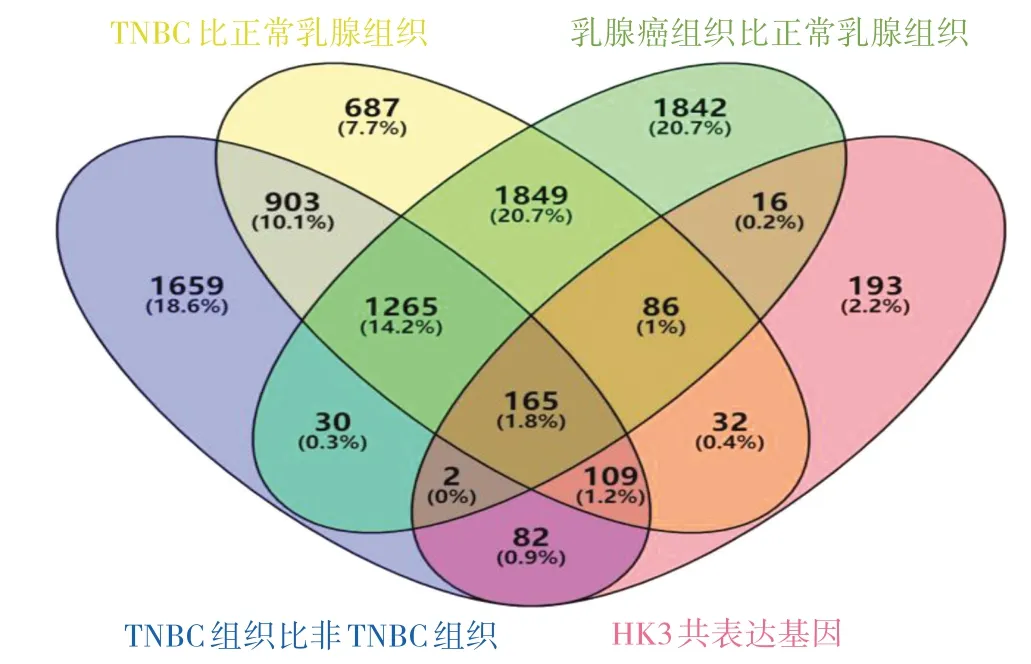
图6 交集基因的韦恩图

图7 HK3 与TNBC 分子机制图谱(A:GO 分析;B:KEGG 分析;C 交集基因Reactome,展示top 25 通路)
2.4 乳腺癌组织中HK3 表达与免疫细胞浸润程度的关系 HK3 的表达水平与多种类型的乳腺癌组织的肿瘤纯度均呈负相关(均P<0.05),而与多种免疫细胞浸润程度均呈正相关(均P<0.05),见图8。

图8 4 种类型的乳腺癌组织中HK3 表达与肿瘤纯度和免疫细胞浸润程度的关系
3 讨论
TNBC 的诊疗仍存在较大的困难,且预后不良,严重影响患者的生活质量。由于TNBC 相关分子机制尚未研究透彻[7-9],这致使目前尚未有针对TNBC 有效的治疗方案。癌症的发生涉及基因水平的改变[10]。HK3 已经被证实在多形性胶质母细胞瘤、急性髓系白血病、肺癌和结直肠癌等多种肿瘤中起到重要作用[11-14]。但HK3 在TNBC 中的作用研究鲜有报道,因此,本研究探讨了HK3在TNBC组织中的表达及临床意义。
本研究发现利用HK3 表达水平可以有效地鉴别TNBC 组织与正常乳腺组织、TNBC 组织与其他类型乳腺癌组织。因此,笔者推测或许可以利用HK3 表达水平对TNBC 患者进行诊断和乳腺癌患者进行病理分型等。尽管TNBC 组织中HK3 相对于正常乳腺组织和其他类型乳腺癌组织是高表达的,但是在TNBC 中HK3高表达组患者预后较好。这可能与异常表达的HK3通过异常的糖酵解途径参与肿瘤免疫逃逸有关[14]。这与先前报道的HK3 影响乳腺癌组织的糖酵解途径和肿瘤免疫微环境有相似之处[6]。这还可能与HK3 高表达乳腺癌组织中的肿瘤纯度较低,而免疫细胞浸润程度较高,进而增强局部抗肿瘤免疫有关。
先前的研究表明,HK3 在多种肿瘤的代谢重编程和抑制抗肿瘤免疫中起到重要作用[14-17]。这些研究结果与本研究富集分析中的免疫系统过程的负调控、免疫受体激活和Toll 样受体4 级联等类似。这表明HK3很有可能通过这些通路促进TNBC 的发生与进展。
有研究发现,HK3 的表达与免疫检查点(immune checkpoint,IC)分子的表达呈正相关[14]。另有研究发现,当HK3 在肿瘤细胞中高表达时,免疫细胞表面的IC 分子显著增多[18]。这些研究均证实了HK3 可以通过IC 对抗肿瘤免疫进行负调控。因此,目前针对TNBC 患者的免疫细胞IC 上调的现象,可以使用IC 抑制剂对TNBC 患者治疗[19-20]。然而,由于耐药性等原因,只有少数TNBC 患者可以从免疫治疗中获益[20]。还有研究发现,HK3 高表达时,肿瘤细胞的糖酵解活性增强,肿瘤细胞增加对葡萄糖等营养物质的摄取和乳酸等有害物质的排除,从而导致恶劣的代谢环境[18]。该环境可以通过抑制淋巴细胞产生细胞毒性物质和诱导调节性T 细胞的分化并增强其功能等途径进而产生免疫排斥和免疫抑制肿瘤微环境[21-24]。这也是IC 抑制剂治疗肿瘤失败的主要原因之一[21,23-24]。然而,这些类型肿瘤细胞大量产生的乳酸的代谢检查点也有望作为新的治疗靶点,基于此,很有可能会改善一些TNBC患者对IC 抑制剂等免疫疗法耐药的情况[21,23]。此外,HK3 还可以通过刺激单核/巨噬细胞在肿瘤组织的浸润进而调节T 细胞表面的IC 相关分子的表达和促进巨噬细胞的替代途径激活等方式介导免疫抑制肿瘤微环境的形成[15,25]。然而,HK3 也可以不依赖于糖酵解功能,而是可能通过在全反式维甲酸诱导的中性粒细胞分化过程中,与BH3-only 蛋白直接作用,进而促进白血病细胞的存活和分化[12]。
富集分析显示了许多病毒感染和抗病毒免疫相关的通路。有研究报道,HK3 在呼吸道病毒感染的机体中异常表达[26]。还有研究指出新型冠状病毒感染可以感染TNBC 细胞,但是对TNBC 患者的具体临床影响还尚未可知[27]。而EB 病毒已经被明确在TNBC 的发生中起到重要的作用[28]。然而,目前尚未见有病毒、HK3和TNBC 之间关系的成熟研究,未来有必要进一步探索病毒是如何影响HK3 进而影响TNBC 的相关机制。
综上所述,HK3 在TNBC 组织中显著高表达。然而,HK3 高表达的TNBC 患者有较好的预后。未来有望利用乳腺组织中HK3 的表达水平鉴别TNBC 患者、对乳腺癌患者分型和预测TNBC 患者的预后。HK3 可能主要通过调节TNBC 细胞的糖酵解途径,进而影响肿瘤免疫微环境等过程促进TNBC 的发生和进展。因此,IC 和乳酸代谢检查点等有望作为治疗TNBC 的新靶点。

