血液净化患儿中心静脉导管相关深静脉血栓风险预测模型的构建及验证
张 丹,关汭昕,孙海瑞,胡莉莉,吴函书,张葆荣,赵晓霜
吉林大学第一医院,吉林130021
随着血液净化治疗在儿童危重症疾病救治方面的不断发展,血液净化在儿童重症监护病房的应用不断增加。有研究显示,近10年来血液净化患儿数增长了370.6%,增加了398.3例次[1-3],已成为儿童重症监护病房内不可或缺的治疗手段。而中心静脉导管作为血液净化治疗的首选血管通路,在给病人带来益处的同时也有不可忽视的并发症及副作用,中心静脉导管相关深静脉血栓(central venous catheter-related deep venous thrombosis,CRT)就是其中之一。目前,报道的血液净化患儿CRT发生率不尽一致,最高可达80%[3-5],而多数为无症状血栓,易被忽视。值得注意的是,因深静脉血栓导致的有症状肺栓塞的发生率达10%~25%,经尸检发现的肺栓塞发生率高达50%[6-7]。因此,尽早评估和识别对预防血液净化患儿CRT尤为关键。但目前关于血液净化患儿CRT的评估模型研究较少,已构建的儿童静脉血栓栓塞相关预测模型主要集中在肿瘤、创伤和危重儿童等[8-13],不适合应用于血液净化患儿,且多数研究为国外研究,在儿童年龄限定方面与国内存在差异,其在国内的适用性有待于进一步探索。因此,本研究在前期研究[14]的基础上构建适合我国临床的血液净化患儿CRT风险预测模型并进行模型验证,探讨其危险因素,为血液净化患儿CRT的评估和早期预防提供参考。
1 对象与方法
1.1 研究对象
便利收集2018年1月—2022年3月吉林省某三级甲等医院儿童重症监护室住院行血液净化治疗的患儿作为研究对象,2018年1月—2021年6月行血液净化治疗患儿的临床资料作为建模集,2021年7月—2022年3月行血液净化治疗患儿的临床资料作为验证集。纳入标准:1)连续性血液净化治疗≥24 h;2)年龄>28 d,且≤18岁;3)有多普勒彩超诊断结果。排除标准:1)非本科室置入的中心静脉导管;2)有深静脉血栓既往史;3)病例资料缺失>20%;4)凝血功能严重异常或纤溶系统病变。CRT的诊断方法:超声科医生应用多普勒超声诊断是否发生CRT,其诊断标准遵循中华医学会外科学分会血管外科组编制的《深静脉血栓形成的诊断和治疗指南(第三版)》[15]。
1.2 研究工具
本研究基于对国内外文献的分析同时参考专家意见确定研究指标,尽可能选择客观指标以减少研究人员主观判断导致数据收集偏倚。研究指标包括一般资料、实验室指标、疾病治疗相关指标、中心静脉置管相关指标、血液净化治疗相关指标。一般资料包括患儿的年龄、性别、疾病诊断;实验室指标包括血液净化后48 h内血红蛋白、红细胞比容、血小板计数、凝血酶原时间、纤维蛋白原、活化部分凝血酶原时间;疾病治疗相关因素包括小儿危重症评分、是否机械通气、是否发生低体温、是否发生低血压、药物治疗(是否镇静镇痛、是否应用糖皮质激素、是否应用血管升压素、是否应用凝血药物)、是否输注血制品、是否制动、是否躁动;中心静脉置管相关因素包括导管型号、置管部位、导管留置时间;血液净化治疗相关因素:是否发生管路凝血、是否发生导管功能障碍、是否发生抗凝不达标。
1.3 资料收集方法
由2名经过培训的研究人员共同收集相关资料,当2人出现分歧时,由第3人再次核对确认方可收集;研究指标均通过查阅医院电子化病历浏览系统进行收集。
1.4 统计学方法
2 结果
2.1 一般资料
共收集了符合纳入、排除标准的356例患儿临床资料,其中建模集286例,CRT组124例,非CRT组162例;男152例(53.15%),女134例(46.85%)。验证集70例,CRT组31例,非CRT组39例;男40例(57.14%),女30例(42.86%)。
2.2 建模集CRT的单因素分析
根据是否发生CRT将建模集分为CRT组和非CRT组,两组在年龄、小儿危重症评分、血红蛋白、导管留置时间、管路凝血、导管功能障碍、抗凝不达标方面比较差异有统计学意义(P<0.05),见表1。
2.3 建模集CRT影响因素的多因素分析
将单因素分析中P<0.1的8个研究指标(年龄、小儿危重症评分、血红蛋白、导管留置时间、管路凝血、导管功能障碍、抗凝不达标、活化部分凝血酶原时间)进行多因素Logistic回归分析。自变量赋值见表2。采用向后似然比法,进入标准为0.05,剔除标准为0.10。结果显示,年龄、管路凝血、导管功能障碍、导管留置时间、抗凝不达标为血液净化患儿CRT的独立危险因素,小儿危重症评分≥80分是血液净化患儿CRT的保护因素。见表3。

表2 自变量赋值方式
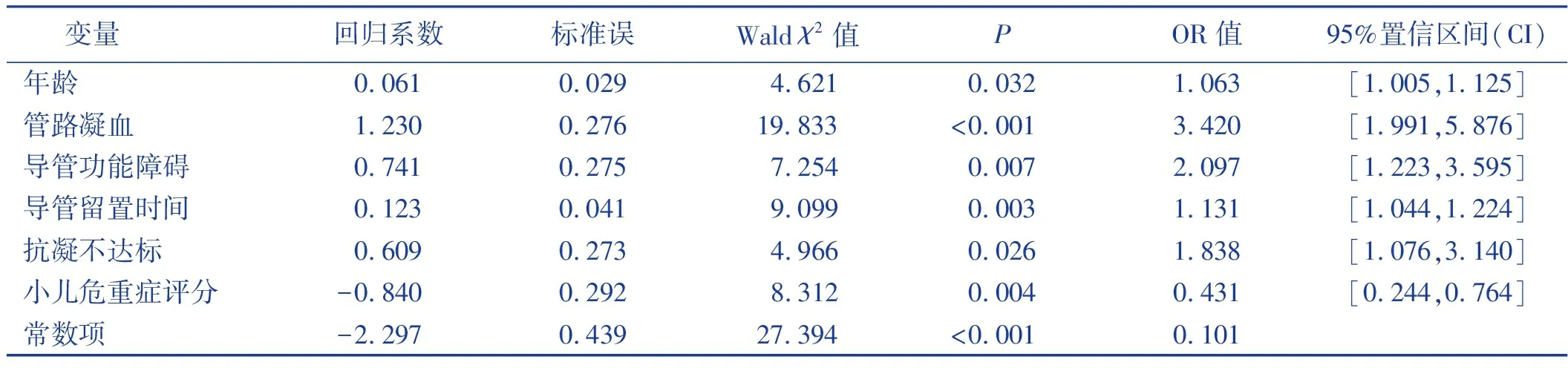
表3 血液净化患儿CRT的多因素分析
2.4 血液净化患儿CRT风险预测模型列线图的构建
依据多因素Logistic回归分析所得结果构建血液净化患儿CRT列线图模型,见图1。列线图由年龄、小儿危重症评分、导管留置时间、是否发生管路凝血、是否发生导管功能障碍、是否发生抗凝不达标和预测概率组成,每个危险因素都有相对应的分值,各项分值相加即得总分,由总分可以找到相应的血液净化患儿CRT发生率。

图1 血液净化患儿CRT列线图模型
2.5 血液净化患儿CRT列线图模型的效果分析
采用Hosmer-Lemeshow对模型进行拟合优度检验,χ2=11.354,P=0.182;采用ROC曲线检验预测模型的检验效能,以约登指数最大值判断模型的最佳临界值,建模集ROC曲线下面积(AUC)为0.765,95%CI(0.709,0.820),约登指数为0.477,最佳截断点为0.369,敏感度82.30%,特异度65.40%。见图2。
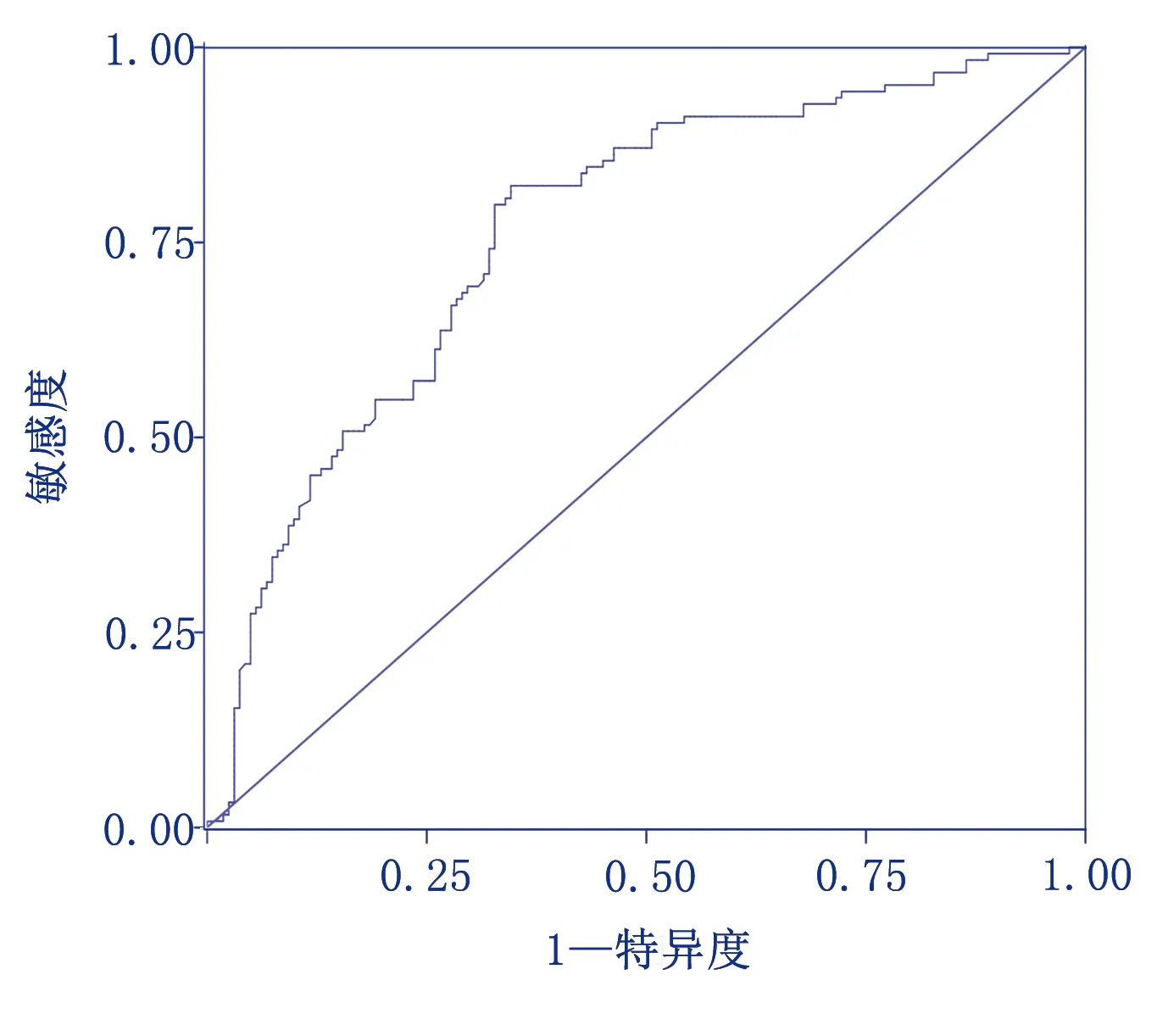
图2 建模集的ROC曲线
2.6 血液净化患儿CRT风险预测模型的验证
选取2021年7月—2022年3月吉林省某三级甲等医院儿童重症监护病房行血液净化治疗的70例患儿作为研究对象,进行模型外部验证。验证集AUC为0.745,95%CI(0.627,0.863),最佳截断点0.578,灵敏度为64.50%,特异度为76.90%,见图3。根据建模集和验证集数据绘制模型的校正曲线和临床决策曲线,以便更好地确定模型的拟合效果(见图4、图5)及其临床获益(见图6、图7)。

图3 验证集的ROC曲线

图4 建模集的校准曲线
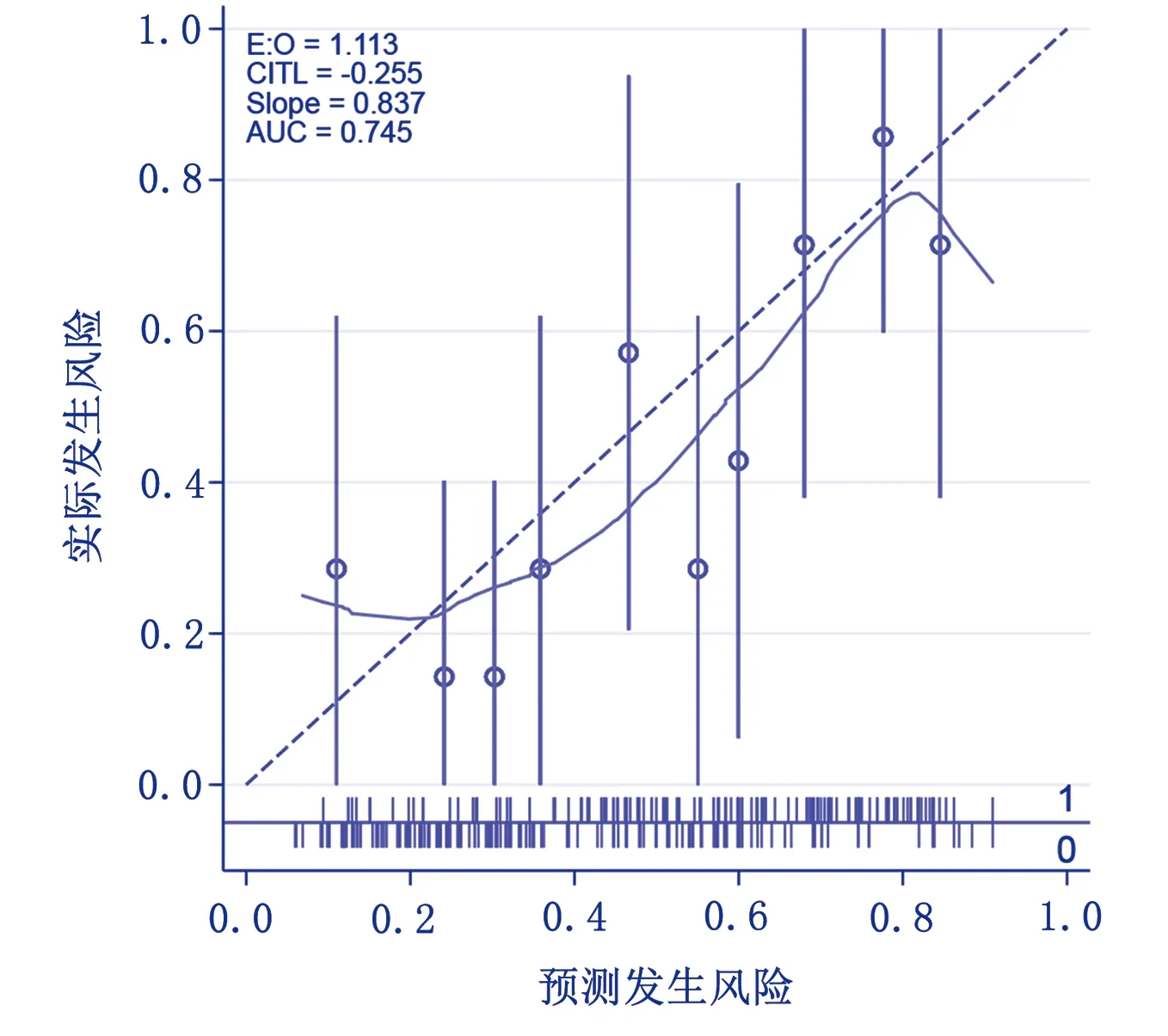
图5 验证集的校准曲线

图6 建模集的临床决策曲线

图7 验证集的临床决策曲线
3 讨论
3.1 构建的血液净化患儿CRT风险预测模型具有实用性和科学性
本研究构建了一个便于计算的血液净化患儿CRT风险预测模型,并对模型进行了内部和外部验证。ROC曲线可以反映诊断试验的灵敏度和特异度,AUC用以评价诊断试验的优劣,AUC为0.5~0.7,说明模型预测效力较低;在0.7~0.9之间,预测效力中等;高于0.9则预测效力高[16]。本研究构建的风险预测模型预测效力中等[建模集AUC=0.765,95%CI(0.709,0.820),验证集AUC=0.745,95%CI(0.627,0.863)]。取约登指数最大时对应的预测概率作为最佳临界值进行真实性评价,此时约登指数为0.477,最佳截断点为0.369,敏感度82.30%,特异度65.40%。在临床工作中,通过列线图可计算血液净化患儿CRT的发生率。
3.2 血液净化患儿CRT的危险因素
3.2.1 年龄是血液净化患儿CRT的危险因素
本研究表明,年龄是血液净化患儿CRT的危险因素。随着年龄增加,CRT发生风险也随之增加。尽管年龄对儿童CRT影响的研究结果不尽一致,Revel-Vilk等[17]认为年龄与儿童CRT无相关性;Faustino等[18-19]认为婴儿期和青春期的CRT的发病率增高呈双峰。本研究仍部分验证了上述研究结果,即年龄超过1.5岁的患儿CRT发生风险更高。考虑到将1.5岁作为分界时,高于1.5岁的患儿年龄跨度较大。因此,本研究并未将年龄进行分层研究,且既往研究[17,20]受样本量等因素影响亦未根据年龄分组比较患儿CRT的发生风险。因此,后续研究可继续探讨不同年龄分组对患儿CRT发生的影响。
3.2.2 发生管路凝血是血液净化患儿CRT的危险因素
本研究表明,管路凝血是血液净化患儿CRT的独立危险因素,这与2项相关研究结果[21-22]一致。由于儿童血液净化引血时是从较小速度开始逐渐达到目标血流量,导致引血时间相对延长,同时由于滤器和血液净化管路对血液来说属于异物,接触后导致外源性凝血途径被激活,导致血小板和纤维蛋白聚集,易导致管路凝血发生。此外,引血不畅等原因会导致机器频繁报警,血泵停转,使得血液在管路内滞留,增加血液与管路的接触时间从而易导致管路凝血发生;同时,为保证引血顺畅,常需要通过牵拉或转动导管来调整导管位置,增加血管内皮损伤,从而增加患儿CRT风险。
3.2.3 抗凝不达标是血液净化患儿CRT的危险因素
本研究结果表明,血液净化中抗凝不达标是血液净化患儿CRT的独立危险因素,这与既往研究[23-25]结果一致。血液净化过程中,抗凝不达标可能会导致管路凝血、导管堵塞、深静脉血栓形成、治疗中断等情况发生。目前常用的抗凝方式是枸橼酸抗凝和肝素抗凝[26]。当枸橼酸抗凝时管路中钙离子>0.1 mmol/L或肝素抗凝时活化凝血时间<160 s为抗凝不足,此时血液易在滤器、动静脉壶及管路各连接处凝集,导致管路发生凝血或纤维蛋白聚集而增加患儿CRT的发生风险。
3.2.4 导管功能障碍是血液净化患儿CRT的危险因素
本研究结果表明,导管功能障碍是血液净化患儿CRT的独立危险因素。这与Little等[27-28]的研究结果一致,其研究表明,存在导管功能障碍发生CRT的风险比无导管功能障碍者增加1.44倍[OR=2.44,95%CI(1.59,3.76)][28]。本研究中导管留置的中位时间均为6 d。因此,血液净化过程中发生的导管功能障碍主要为早期导管功能不良。早期导管功能不良的发生多与机械因素相关,如导管开口紧贴血管壁或纤维蛋白鞘形成、导管打折弯曲等,这些异常可通过调整导管位置、重新固定等方法解决,但当患儿活动或导管位置改变时,可能会重复出现,在调整位置时不断牵拉导管触发血管内皮细胞的炎症反应,血小板和纤维蛋白在导管周围聚集形成纤维蛋白鞘,增加导管周围血栓形成的风险[3]。除此之外,在治疗间歇期,导管封管液抗凝剂不足也会增加血栓形成的风险[28]。
3.2.5 导管留置时间是血液净化患儿CRT的危险因素
本研究结果表明,导管留置时间是血液净化患儿CRT的危险因素,留置时间越长CRT的发生概率越高。国外也有研究认为,留置导管时间可能会增加患儿CRT的风险[29]。本研究中导管留置的中位时间是6 d,与曾晓艳[30]的研究结果一致。因此,在临床中,应每天评估导管留置的必要性,如无必要应尽早拔管,以减少患儿CRT的发生。
3.2.6 小儿危重症评分≥80分是血液净化患儿CRT的保护因素
本研究表明,入院时小儿危重症评分≥80分是血液净化患儿CRT的保护因素。小儿危重症评分满分100分,80分及以上代表患儿病情非危重,70~<80分代表病情危重,70分以下代表极危重。既往研究也表明,病情危重可引起血液流动减缓、血液成分变化甚至伴随严重感染或需要机械通气,增加了患儿CRT的发生风险[31];患儿小儿危重症评分高于80分时,病情稳定,其内环境和血液系统也较危重患儿平稳,其CRT的发生概率远小于危重患儿。
3.3 本研究的局限性
本研究仅收集了单中心的血液净化患儿临床数据资料,未进行多中心的数据收集和研究,模型的推广和使用可能会受到一定程度的限制。此外本研究为回顾性研究,虽然已进行严格的质量控制,但仍有不可避免的偏倚发生,其他影响深静脉血栓形成的研究指标也可能因资料不全等原因被排除在外,后续将进行持续性研究,不断完善预测模型,以便于得到预测效果最佳的血液净化患儿CRT的风险预测模型。
4 小结
本研究中构建的血液净化患儿CRT风险预测模型预测因子主要是临床变量,CRT相关的生物标记物能否优化预测模型仍需进一步研究。本研究构建的预测模型具有中等水平预测效力,且进行了外部验证,更具有临床指导意义和严谨性,可结合临床实际,应用该模型进行血液净化患儿CRT的筛查和预测。下一步可在多中心、大样本的研究基础上对预测模型进行持续验证和优化,为构建高效、实用和智能的血液净化患儿CRT风险预测模型奠定基础。

