基于SPRi 技术和分子对接探析人参皂苷与MAPK 信号通路的相互作用
张骆琪,李 森,崔如意,杜 霞,5,陈 鸿,王 猛,许海玉*
(1.中国中医科学院中药研究所,北京 100700;2.中国科学院遗传与发育生物学研究所,北京 100101;3.吉林农业大学中药材学院,吉林 长春 130118;4.中国中医科学院医学实验中心,北京 100700;5.陕西省中医药研究院,陕西 西安 710003)
癌症是由基因突变引起不受调节的细胞过度增殖的疾病,是全球第二大死亡原因。2012 年全球新发癌症病例为1 410 万例,预计在2030 年癌症发病高达2 170 万例[1]。抑制癌症发展,减少高发病率的重要策略之一是靶向癌症的药物。癌症的发生、发展与细胞增殖、凋亡等途径密切相关。因此,细胞周期调控因子和凋亡刺激因子是开发潜在抗癌药物的重要靶点。
MAPK 通路(RAS-RAF-MEK-ERK) 是关键的细胞内信号通路,参与调节细胞增殖、细胞周期、细胞存活、血管生成、细胞迁移等过程[2-3]。通过抑制MAPK 通路的异常激活,会减少癌细胞增殖、侵袭能力及生长,促进癌细胞凋亡[4-5]。目前临床上针对作用于MAPK 通路针对癌症的抑制剂基本上是化学合成药物,例如vemurafenib、dabrafenib、trametinib 等[6]。价格昂贵、不良反应大、且容易产生耐药性。
人参皂苷是一种固醇类天然产物,是人参、西洋参、三七等人参属药材的主要活性成分[7-8]。研究表明,人参等药材在抗癌作用显著,且减轻化疗、放疗的不良反应,提高患者的生活质量[8-9]。对其活性成分人参皂苷的作用机制进行研究迫在眉睫。
人参皂苷种类繁多,作用靶点广,实验验证药效周期长,消耗经费巨大。通过分子对接技术预测活性成分-蛋白相互作用,分析构效关系[10]。结合SPRi 技术高通量筛选,分析分子相互作用[11]。能够快速筛选出最有希望的小分子进行实验。
因此本研究运用分子对接技术研究人参皂苷与MAPK通路相互作用的潜在机制,构建“成分-靶点蛋白” 网络模型,利用SPRi 技术筛选与核心靶点ERK1 结合的人参皂苷类成分,并进一步通过分子对接技术确定其结合位点。
1 材料
1.1 仪器 PCR 扩增仪 (北京东胜科技有限公司);Superdex 200 increase 分子筛(美国GE Healthcare 公司);Kx5 Sinstrument SPRi 仪(美国Plexera 公司)。
1.2 试剂 ginsenoside Rb1、ginsenoside Rb2、ginsenoside Rg1、ginsenoside Rg3、ginsenoside Rc、ginsenoside Re、ginsenoside Rd 等27 个小分子(成都曼思特生物科技有限公司);限制性核酸内切酶AscI、NotI、T4 DNA Ligase (美国NEB 公司);Trans-T1 感受态细胞、BL21 (DE3) 感受态细胞、pET-24-2-his 质粒(北京全式金生物技术有限公司)。引物合成及测序由北京擎科生物科技股份有限公司完成。
2 方法
2.1 分子对接
2.1.1 小分子准备 小分子结构来源于PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/) 和ECTM 数据库(http://www.tcmip.cn/ETCM/index.php/Home/Index/),使用Chem3D 19.0 软件构建小分子3D 结构的MOL2 格式文件,并将MOL2 格式文件转化为AutoDock Vina 分子对接(http://vina.scripps.edu/) 可识别的PDBQT 格式文件。
2.1.2 靶点蛋白准备 通过KEGG 数据库及相关文献收集ERK 通路的相关蛋白[12],从RCSB PDB 数据库 (www.rcsb.org) 获得ERK 通路中关键蛋白的晶体结构。AutoDock 软件对蛋白结构进行优化,添加缺失氢原子,减去多余水分子。
2.1.3 确定活性口袋及分子对接步骤 根据文献报道以及PyMOL 1.8.6 软件插件GetBox Plugin 确定蛋白分子的活性口袋(表1)。AutoDock Vina 和Python 脚本进行高通量分子对接。以结合能作为评价函数,分析小分子与蛋白的最佳结合方式。PyMOL 可视化小分子和蛋白结合模式,并分析关键结合位点。

表1 靶点蛋白活性口袋
2.1.4 人参皂苷与蛋白作用网络的构建 采用Cytoscape 3.7.2 软件构建人参皂苷与靶点蛋白互作的网络模型。
2.2 制备ERK1 蛋白
从表1可以看出,广西金融术语的翻译过于放在字面的翻译,而忽略了实际的意义体现。但是,纵观后期的金融翻译,广西金融翻译也出现了采用香港金融翻译的现象。[4]
2.2.1 构建原核表达载体 根据NCBI 收录的人ERK1 基因的CDS 序列和原核表达质粒(pET-24-2-his) 酶切位点设计引物,利用高保真DNA 聚合酶进行PCR 扩增,获得带有酶切位点的ERK1 基因CDS 序列,用AscI、NotI 限制性内切酶对PCR 产物和质粒在37 ℃、90 min 条件下进行酶切,酶切产物进行琼脂糖凝胶电泳,并纯化回收;纯化回收的ERK1 片段和质粒片段在16 ℃下通过T4 DNA 连接酶连接120 min;连接产物通过热激法转入Trans-T1 感受态细胞内,37 ℃培养12~16 h,挑选单菌落,并进行菌液PCR 筛选阳性克隆,测序验证。选取序列完全正确的菌液进行质粒提取,提取后的质粒通过热激法转入原核表达细菌BL21(DE3) 中,选取阳性克隆进行后续蛋白表达。
2.2.2 重组蛋白诱导表达 重组质粒转化菌在含Kan 抗性的LB 培养液中进行培养,当菌液OD600nm为0.6~0.8 时,调整温度为17 ℃,加入IPTG 终浓度为0.4 mmol/L,诱导蛋白表达16 h。在4 ℃下4 500 r/min 离心10 min,收集菌体。每1 g 菌体中加入5 mL 破菌buffer (50 μL 蛋白酶抑制剂、50 μL 10 mg/mL 溶菌酶、25 μL DNaseI),混匀,冰浴30 min。使用高压细胞破碎仪,在4 ℃下破碎4 次。在4 ℃下12 000 r/min 离心40 min,收集上清与沉淀。
2.2.3 蛋白纯化 用镍柱粗纯化,将提取的粗蛋白上清与平衡好的beads,4 ℃结合60 min。15 mmol/L 咪唑洗脱,待洗脱液与G250 考马斯亮蓝溶液反应不发生颜色变化时,则停止用该梯度咪唑溶液洗脱。通过相同步骤,依次用50、100、150、250 mmol/L 咪唑洗脱,收集洗脱液。
利用superdex 200 increase 分子筛柱纯化蛋白。吸取样品进入进样环;pump path 改为inject,洗脱2 mL 时,将pump path 改为load,25 mL 洗脱。体积流量0.4 mL/min;压力2 MPa。根据蛋白峰图,收集样品。通过SDS-PAGE 法鉴定纯化的蛋白为单一条带,见图1。
2.3 SPRi 分析小分子与ERK1 蛋白的相互作用 参照Plexera 相关标准流程,通过SPRi 分析仪分析ERK1 和人参皂苷的相互作用。人参皂苷均用DMSO 配制浓度为20 mmol/L 的母液,ERK1 蛋白母液用含有150 mmol/L NaCl 的50 mmol/L Tris-HCl (pH=8.0) 缓冲溶液分别稀释为0.5、1.0、5.0 μmol/L。选择3D UVC 芯片,将5 mg/mL 人参皂苷种植于芯片表面,点样湿度<45%,温度20 ℃,真空干燥,进行光交联反应。
3 结果
3.1 分子对接 通过AutoDock Vina 进行分子对接,分析27 种人参皂苷与靶点蛋白的相互作用,以Binding Energy 作为考察小分子配体与蛋白受体结合的指标,结合能小于-1.2 kcal/mol或者小于-5 kJ/mol,则认为小分子与蛋白可以结合。选择结合能最低、小分子结构最舒展的结合构象作为分子对接的结果,人参皂苷与靶点蛋白结合能汇总见表2。
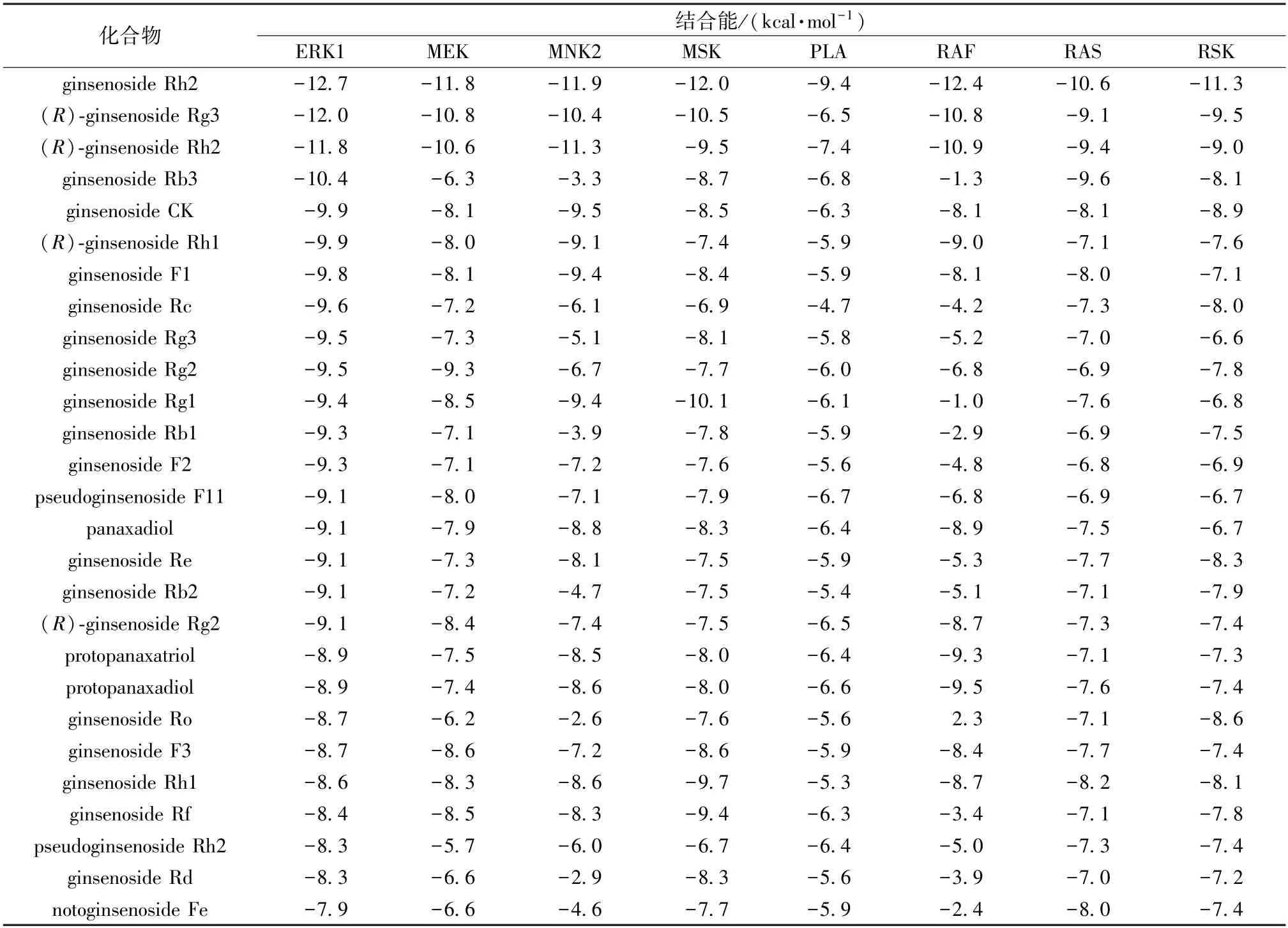
表2 人参皂苷与靶点蛋白对接的结合能
筛选结合能小于-1.2 kcal/mol 的小分子-靶点蛋白绘制人参皂苷-靶点蛋白网络,见图2。由此可知,人参皂苷与MAPK 信号通路的相互作用存在1 个化合物作用于多靶点,也有多个化合物调控1 个靶点的情况,这体现了中药多成分、多靶点协同调控的特点。
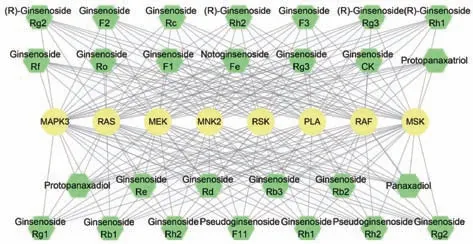
图2 人参皂苷-MAPK 通路蛋白靶点网络
通过结合能高低分析这27 种人参皂苷成分与MAPK 信号通路上靶点蛋白的结合,发现27 种人参皂苷中,有21种人参皂苷成分与ERK1 的结合能低,例如ginsenoside Rh2、ginsenoside Rb3、ginsenoside CK 等。因此,选择通过SPRi 实验对这21 种人参皂苷与ERK1 靶点蛋白的结合作用进行研究。
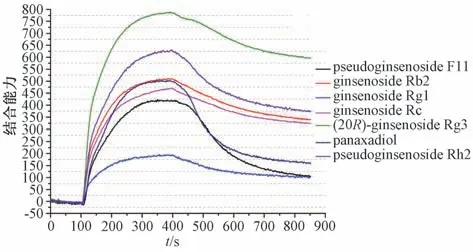
图3 SPRi 检测ERK1 蛋白与7 种人参皂苷的结合能力
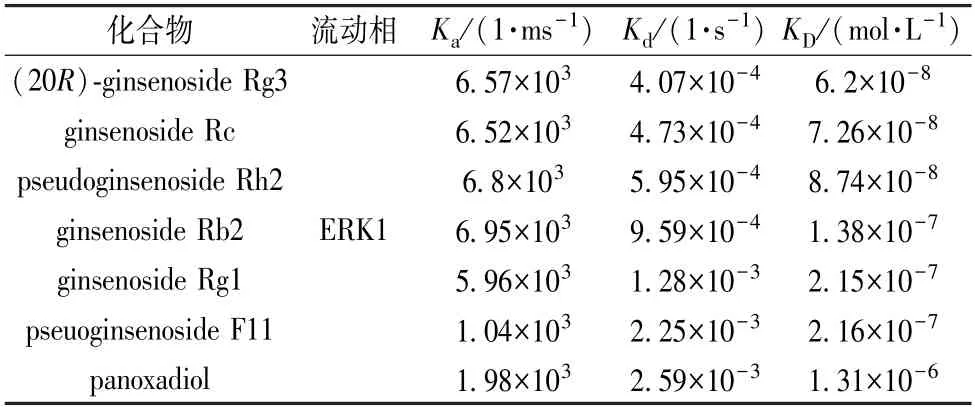
表3 ERK1 蛋白与7 种人参皂苷结合的动力学、亲和力参数
3.3 人参皂苷人参皂苷与ERK1 蛋白结合可视化 基于SPRi 结合结果,通过PyMOL 软件对 (20R)-ginsenoside Rg3、ginsenoside Rc、pseudoginsenoside Rh2 等7 种人参皂苷与ERK1 蛋白的分子对接进行可视化,见图4,并对人参皂苷与蛋白的结合作用进一步分析,发现人参皂苷与ERK1结合的主要位点是Lys71、Glu88、Asp184。人参皂苷与ERK1 蛋白分子对接能和结合位点汇总结果见表4。
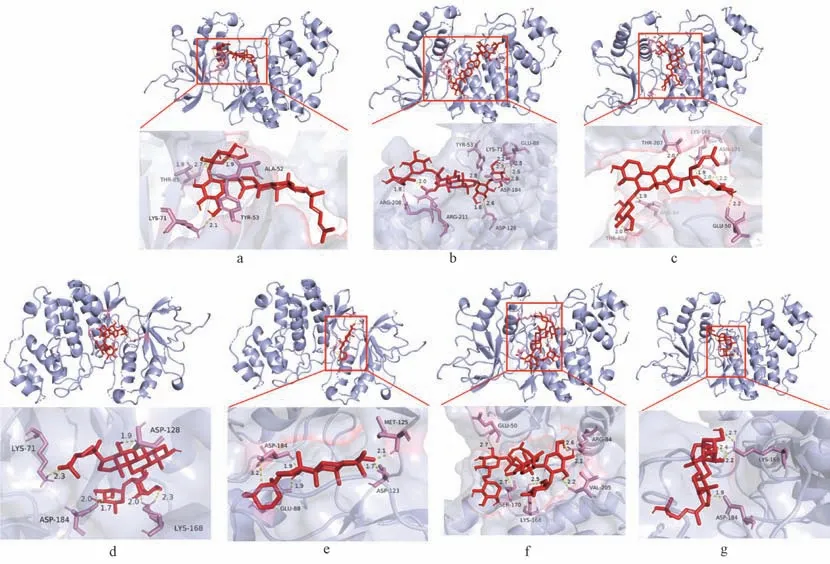
图4 人参皂苷与ERK1 蛋白分子对接图

表4 人参皂苷与ERK1 蛋白分子对接能和结合位点
4 讨论
随着科技的进步,癌症的治疗手段多种多样,包括化疗、手术、放疗等等,但癌症愈后差、复发概率高、死亡率高,靶向抑制剂为癌症的治疗提供了更多的选择。已经有多项研究表明MAPK 通路在各种癌症中的作用,针对MAPK 通路筛选靶向抑制剂的开发已经取得了令人鼓舞的成果。但这些抑制剂主要作用于是RAF (vemurafenib、dabrafenib、encorafenib) 和MEK (trametinib、binimetinib、cobimetinib),关于ERK 的抑制剂很少[13]。
ERK1 在MAPK 通路上处于独特位置,其上游分子RAF 除了MEK 外几乎没有其他效应子,而MEK 除了ERK没有其他底物;下游通路中,ERK 是唯一能够刺激多种下游底物的激活剂[14-16]。抑制ERK1 活性能够逆转上游突变引起的MAPK 通路的异常激活,靶向ERK1 抑制剂在MAPK 信号通路异常导致的癌症治疗中起重要作用。目前关于ERK1 的抑制剂处于不同的临床试验阶段,ulixertinib(BVD-523)、GDC-0994、ASN007 等,然而这些抑制剂的缺点也是显而易见的,它们的作用有限,抑制剂仅对少数特定的癌症类型有效,因此,筛选新型的ERK 抑制剂是很有价值的研发方向。
人参皂苷具有广泛的生物活性。本研究利用分子对接和SPRi 技术,挖掘分析人参皂苷调节MAPK 信号通路的关键成分和作用靶点。共筛选得到(20R)-ginsenoside Rg3、ginsenoside Rc、ginsenoside Rg1、pseudoginsenoside F11、panaxadiol、ginsenoside Rb2、pseudoginsenoside Rh2 等7 种成分,调节关键靶点ERK1。研究发现,人参能够缓解非小细胞肺癌患者的呕吐、腹泻等症状,提高白细胞、血小板数量等,增强化疗的效果、减少不良反应、提高免疫力等[17]。人参根总提取物能够在体内和体外抑制MAPK 信号通路激活自噬、减轻炎症[18]。Ginsenoside Rg1 能够抑制6-OHDA 诱导的ERK1/2 磷酸化[19];ginsenoside Rb2 通过作用于Ras-ERK1/2 信号通路来保护骨髓间充质干细胞免受地塞米松诱导的细胞凋亡[20]。结合本实验结果,推测(20R)-ginsenoside Rg3、ginsenoside Rc、ginsenoside Rg1 等可能是人参等药材抗癌的重要活性成分之一,能够作用于ERK 蛋白靶点。
综上所述,本研究基于分子对接和SPRi 技术分析了人参皂苷与ERK 信号通路的相互作用,为人参皂苷机制研究及ERK1 蛋白抑制剂研究提供方向,也为中药体外筛选提供新思路。同时,体外和体内存在一定差异,需要分子实验、细胞实验和动物实验等进行分析验证。

