银杏酮酯激活ATP 敏感的钾通道对心肌缺血再灌注损伤大鼠的预防作用
王星禹,朱国琴,宁 可,江美芳,包怡敏,高 崎*,刘爱华*
(1.上海中医药大学中西医结合学院,上海 201203;2.上海上药杏灵科技药业股份有限公司,上海 201703)
缺血性心脏病或突发性心脏病是全世界范围内最常见的致死和致残单一因素[1],而急性心肌梗塞溶栓治疗、经皮冠状动脉腔内成形术、冠脉旁路血管移植术、体外循环等血运重建治疗都面临心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)。心脏循环的重建伴随着细胞损伤和死亡、再灌注性心律失常、心肌抑顿和血管无复流现象[2]。若能防治再灌注损伤,缺血心肌将能从再灌注疗法中获得更佳疗效。ATP 敏感的钾通道 (ATPsensitive potassium channel,KATP) 于1983 年由Noma 首先在豚鼠的心肌细胞上发现[3],其特征是通道活性随胞内ATP 浓度升高而被抑制。缺血时KATP激活可以保护心肌,在MIRI 时起重要保护作用[4]。
缺血预适应(IPC) 对MIRI 具有强大的保护作用,表现出双时相效应,早期效应(数分钟出现,持续2 h 左右)和延迟效应(24 h 后重新出现)[5]。据报道银杏叶标准提取物EGb761 对缺血再灌注诱导大鼠心肌损伤具有延迟性保护作用,可能与增加NO 合成和开放胞膜KATP通道(sarcKATP) 有关[5]。但银杏叶提取物是否还通过调节MIRI 时KATP发挥早期心脏保护作用,国内外未见相关报道。我国自主研发出具有独立知识产权的新型银杏制剂——银杏酮酯(Ginkgobilobaextract 50,GBE50),银杏总黄酮含量达44%以上,银杏内酯达6%以上,毒性成分银杏酸含量控制在5 μg/g 以下[6]。以银杏酮酯为原料的杏灵颗粒,已通过临床试验,用于治疗冠心病、心绞痛和脑动脉硬化、眩晕[7]。本研究拟从KATP调节入手,对银杏酮酯如何激活心肌内源性保护机制而发挥早期心脏保护作用,进而防治MIRI 作探讨性研究。
1 材料
1.1 动物 雄性成年Sprague-Dawley 大鼠,体质量(225±25) g,购自上海斯莱克实验动物有限责任公司[实验动物生产许可证号SCXK (沪) 2017-0005],饲养于上海中医药大学动物房[SYXK (沪) 2020-0009],实验经上海中医药大学实验动物福利与伦理委员会审查批准 (伦理号PZSHUTCM190614008),实验符合实验动物福利及伦理相关规范。
1.2 药物与试剂 银杏酮酯(批号111002,上海上药杏灵科技药业股份有限公司)。BCA 蛋白测定试剂盒、RIPA裂解液、Hoechst 33258 染色液、抗荧光淬灭封片液(货号P0010、P0013B、C1018、P0126,上海碧云天生物技术有限公司);0.45 μm 硝酸纤维素膜(NC 膜)、TEMED、胎牛血清 (FBS)、30% 丙烯酰胺 (货号66485、DH338-1、CC-0011、MMR007,上海鼎国生物技术有限公司);ECL发光试剂 (货号34095,美国Thermo Fisher Scientific 公司);小鼠内向整流钾通道 (inwardly-rectifying potassium channel,Kir) Kir6.2 单克隆抗体、兔磺酰脲类受体(sultfonylurea receptor,SUR) SUR2 多克隆抗体(货号sc-390104、sc-25684,美国Santa Cruz 公司);小鼠GAPDH 单克隆抗体(货号60004-1,美国Proteintech 公司);Ⅱ型胶原酶 (Type 2 Collagenase,货号 LS004176,美国Worthington 公司);蛋白酶、2,3-丁二酮一肟(BDM)、D-2-脱氧葡萄糖 (2-Deoxy-D-glucose)、连二亚硫酸钠(Na2S2O4)、格列本脲(Glibenclamide)(货号P8340、31550、D8375、157953、58H0570,美国Sigma 公司)。
1.3 仪器 LGF-1B Langendorff 心脏灌流装置(成都仪器厂);GNP-9050 隔水恒温箱、DK-S24 电热恒温水浴锅(上海精宏实验设备有限公司);ML785 PowerLab/8sp 数据采集分析系统[埃德仪器国际贸易(上海) 有限公司];IX 71 倒置荧光显微镜(日本Olympus 公司);PowerPac HC 垂直电泳仪(美国Bio-Rad 公司);Tanon-2500R 全自动数码凝胶图像分析系统(上海天能科技有限公司);Centrifuge 5424R 低温离心机(德国Eppendorf 公司);TS-8 垂直转移脱色摇床、TS-2 水平脱色摇床(海门市其林贝尔仪器制造有限公司);Synergy 2 酶标仪 (美国BioTek 公司);MultiClamp 700B 膜片钳放大器、Digidata 1332 数模转换器[美谷分子仪器(上海) 有限公司];P-97 微电极拉制仪(美国Sutter 公司);PB-10 PH 计(德国赛多利斯公司)。
1.4 溶液配制 Krebs-Henseleit (K-H) 改良液(mmol/L):NaCl 118.0,KCl 4.7,CaCl21.25,KH2PO41.2,MgSO41.2,NaHCO325.0,Glucose 11.0。
无钙缓冲液 (mmol/L):NaCl 120,KCl 5.4,NaH2PO41.2,NaHCO320,MgSO41.2,Glucose 5.6,BDM 10,Taurine 5,用稀盐酸将pH 调至7.4。
停止酶解液:在无钙缓冲液中加入10% FBS 和12.5 mmol/L CaCl2,即得。
缺血液 (mmol/L):NaCl 118.0,KCl 4.7,CaCl21.25,MgSO41.2,KH2PO41.2,NaHCO325.0,2-Deoxy-Dglucose 10,Na2S2O410,充分溶解后分装,于-20 ℃保存。
KB 液(mmol/L):K glutamate 100,KCl 25,MgSO42,KH2PO42,Taurine 20,Creatine base 5,EGTA 0.5,HEPES 5,Glucose 20,加KOH 校正pH 值至7.4,即得,分装后于-20 ℃保存。
记录IKATP电极内液(mmol/L):Potassium L-aspartate(C4H5K2NO4) 120,KCl 20,MgCl20.5,HEPES 10,EGTA 10,K2ATP 10,用KOH 将pH 值调至7.2,即得。
记录IKATP细胞外液(mmol/L):NaCl 137,KCl 5.4,MgCl21,HEPES 10,Glucose 10,TEACl 20,Nifedipine 0.001,用NaOH 将pH 值调至7.4,即得。
银杏酮酯母液配制:1.25 g 银杏酮酯加入10 mL 丙二醇,加热溶解,然后加超纯水至500 mL 搅拌溶解,经0.22 μm 混合纤维素脂膜过滤,于4 ℃冷藏室保存待用。
2 方法
2.1 离体心脏缺血再灌注(I/R) 模型建立 大鼠麻醉后分离心脏,利用Langendorff 灌流系统建立大鼠离体心脏I/R模型。随机分为5 组,对照组(6 只) 以K-H 液持续灌流75 min;缺血再灌注模型组(7 只) 以K-H 液灌流15 min,停止灌流30 min 缺血,再灌注30 min;银杏酮酯组(7 只)以含银杏酮酯(25 mg/L[6]) 的K-H 液灌流15 min,停止灌流30 min 缺血,含银杏酮酯(25 mg/L) 的K-H 液再灌注30 min;银杏酮酯预处理组(6 只) 以含银杏酮酯(25 mg/L) 的K-H 液灌流15 min,停止灌流30 min 缺血,然后用K-H 液再灌注30 min;格列本脲+银杏酮酯预处理组(7只) 以含银杏酮酯(25 mg/L) 和格列本脲(10 μmol/L[8])的K-H 液灌流15 min,停止灌流30 min 缺血,然后用K-H液再灌注30 min。
2.2 心功能检测 测量心率、左心室收缩峰压均值(mLVSP)、左心室舒张压均值(mLVDP)、左心室收缩压最大上升速率(+dP/dtmax)、左心室舒张压最大下降速率(-dP/dtmax) 等指标,并计算出左心室发展压(DP,DP=mLVSP-mLVDP)。记录完毕后取心脏,将部分组织切块在10%中性甲醛中固定备用;部分左心室肌组织称重标记,装入冻存管中置于-70 ℃冰柜中保存,供蛋白表达检测。
2.3 HE 染色观察心肌组织病理变化 取心尖组织,修剪后放入包埋框,自来水冲洗2 h 以上,置于全自动组织脱水机内,依次经各级乙醇脱水、二甲苯透明、石蜡包埋,切片展平贴在载玻片上,45 ℃烘箱烘干,然后脱蜡至水,行苏木精-伊红(HE) 染色,脱水封片,于光学显微镜下观察并拍摄。
2.4 Hoechst 33258 染色观察心肌细胞凋亡情况 将心脏组织切片脱蜡至水后,加入少量Hoechst 33258 染色液染色5 min,弃染色液,用生理盐水洗涤2 次,滴加抗荧光淬灭封片液封片后,于荧光显微镜下观察。每组取4 个样本,每个样本选6~8 张照片,分析阳性染色细胞数。凋亡率以Hoechst 33258 染色阳性核蛋白数与细胞总数的比值表示。
2.5 Western blot 法检测心肌组织Kir6.2 和SUR2 蛋白表达 提取心肌组织总蛋白,用BCA 蛋白测定试剂盒测定蛋白浓度。蛋白样品经SDS-PAGE 凝胶电泳,转至NC 膜,于5%脱脂奶粉溶液中封闭,孵育KATP通道蛋白Kir6.2 一抗(1 ∶1 000) 和SUR2 一抗(1 ∶500),TBST 洗膜后孵育二抗,加入ECL 发光试剂显色,使用Image J 分析系统对条带的灰度进行量化,并以GAPDH 为内参。
2.6 大鼠心室肌细胞急性分离 取10 只大鼠,麻醉后,迅速取出心脏,悬挂在Langendorff 灌注装置上,使用主动脉插管逆向进行灌注。灌注溶液用95% O2和5% CO2的混合气体饱和后,恒温37 ℃以5 mL/min 体积流量灌流。心脏先用无钙细胞分离缓冲液灌注10 min,换用含有25 mgⅡ型胶原酶、5 mg 蛋白酶、50 mol/L CaCl2和0.1% BSA 的低钙细胞分离缓冲液酶解15 min。然后将心室在低钙细胞分离缓冲液中剪成小块以获得心室肌细胞。分离成功的肌细胞呈棒状,边缘清晰,有收缩带,表面光滑,可用于膜片钳实验。
2.7 全细胞膜片钳记录心室肌细胞KATP电流 心室肌细胞随机分为4 组,对照组用KATP细胞外液灌流16 min;缺血再灌模型组先用KATP细胞外液灌流10 min,再用缺血液灌流3 min,最后以细胞外液灌流3 min;格列本脲组先用含格列本脲(10 μmol/L) 的KATP细胞外液灌流10 min,再用含格列本脲的缺血液灌流3 min,最后以含格列本脲的细胞外液灌流3 min;银杏酮酯组先用含银杏酮酯(25 mg/L)的KATP细胞外液灌流10 min,再用含银杏酮酯的缺血液灌流3 min,最后以含银杏酮酯的细胞外液灌流3 min。KATP电流(IKATP) 的记录采用电压钳制模式、斜坡电压剌激方案,即钳制电压-40 mV,以20 mV/s 的速率,从-100 mV去极化至+80 mV,剌激间隔为9 s。对0 mV 钳制电压下的电流密度进行数据分析,比较缺血前后电流变化,并用KATP通道阻断剂格列本脲证实是否IKATP。
2.8 统计学分析 通过IBM SPSS Statistics 22、OriginPro 2016、Graphpad 8.0 等软件进行处理,数据以(±s) 表示,多组间比较采用单因素方差分析,两组间比较采用t检验。P<0.05 为差异有统计学意义。
3 结果
3.1 银杏酮酯对缺血再灌注损伤大鼠心功能的影响 如图1 所示,与对照组比较,模型组mLVSP、DP、+dP/dtmax降低(P<0.01),mLVDP、-dP/dtmax升高(P<0.01)。与模型组比较,银杏酮酯组可改善mLVDP 的降低(P<0.01),促使DP、+dP/dtmax升高(P<0.05,P<0.01) 和-dP/dtmax降低;银杏酮酯预处理组同样可促使mLVSP、DP、+dP/dtmax升高(P<0.01),-dP/dtmax降低(P<0.05);格列本脲可消除银杏酮酯对心功能的改善效应。
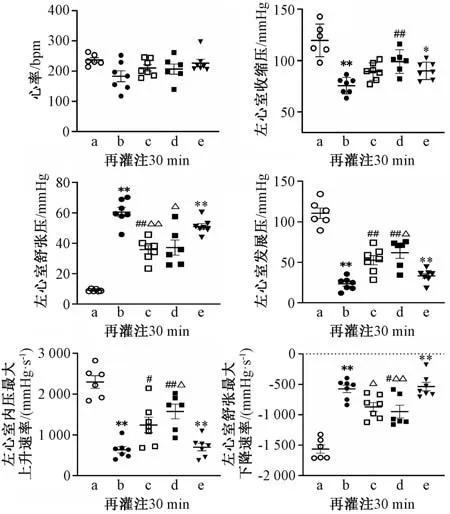
图1 银杏酮酯对缺血再灌注损伤大鼠心功能的影响(±s,n=6~7,1 mmHg=0.133 kPa)
3.2 银杏酮酯对缺血再灌注损伤大鼠心肌组织病理变化的影响 如图2 所示,对照组心肌纤维排列整齐,心肌细胞完整无破损,细胞核均匀分布,心肌结构清晰有序;模型组和格列本脲+银杏酮酯预处理组大鼠心肌纤维排列紊乱,心肌细胞间质有大片炎性细胞浸润,多数心肌细胞破裂并出现核消融现象,心肌结构模糊不清;银杏酮酯组部分心肌纤维排列紊乱,部分组织有炎性浸润,少数心肌细胞破裂,少有细胞核消融,心肌结构基本清晰。
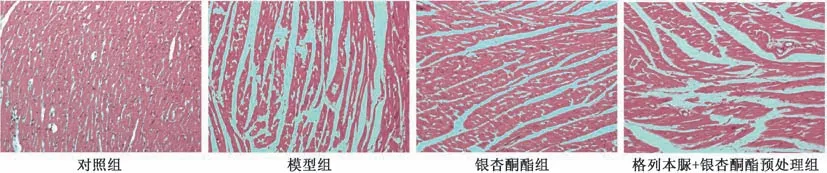
图2 银杏酮酯对缺血再灌注损伤大鼠心肌组织病理变化的影响(HE,×200)
3.3 银杏酮酯对缺血再灌注损伤大鼠心肌细胞凋亡的影响 Hoechst 33258 染色后,在荧光显微镜下观察,正常心肌细胞核呈弥散均匀的淡蓝色荧光,而凋亡细胞的细胞核呈致密浓染亮蓝色荧光。如图3 所示,对照组心肌存在少量凋亡细胞;与对照组比较,模型组可见大量凋亡细胞,细胞凋亡率升高(P<0.01);与模型组比较,银杏酮酯组心肌细胞凋亡率降低(P<0.01);与银杏酮酯组比较,格列本脲+银杏酮酯预处理组心肌细胞凋亡率升高 (P<0.05)。
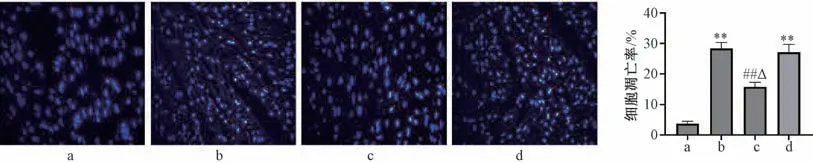
图3 银杏酮酯对缺血再灌注损伤大鼠心肌细胞凋亡的影响(×400,±s,n=4)
3.4 银杏酮酯对缺血再灌注损伤大鼠心肌组织KATP通道蛋白Kir6.2 和SUR2 亚基表达的影响 如图4 所示,各组间心肌KATP通道蛋白Kir6.2 表达比较无明显差异(P>0.05)。与对照组比较,模型组心肌组织SUR2 蛋白表达升高(P<0.05);与模型组比较,银杏酮酯组心肌组织SUR2 蛋白表达升高(P<0.05);与银杏酮酯组比较,格列本脲+银杏酮酯预处理组心肌SUR2 蛋白表达降低,恢复至对照组水平(P<0.01)。
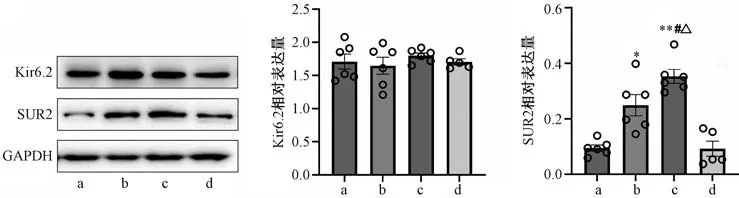
图4 银杏酮酯对缺血再灌注损伤心肌组织Kir6.2 和SUR2 蛋白表达的影响(±s,n=5~6)
3.5 银杏酮酯对缺血再灌注损伤心室肌细胞IKATP的影响 如图5 所示,使用正常细胞外液灌流,并未记录到具有KATP通道特征的膜电流活动,0 mV 电压下的电流密度基本为0;模型组KATP通道开放,0 mV 电压下的电流密度由对照组的(0.01±0.07) pA/pF 上升到(1.37±0.24) pA/pF;加入格列本脲后,该电流基本被抑制,故证实记录到的外向电流就是IKATP[8];而使用银杏酮酯灌流则进一步促进KATP通道的开放,其电流密度比缺血再灌注模型组提升140% (P<0.05)。

图5 银杏酮酯对缺血再灌注损伤心室肌细胞IKATP的影响(±s,n=7~10)
4 讨论
MIRI 早期左心室收缩/舒张功能变化,可通过离体大鼠心脏Langendorff 灌流模型血流动力学和心肌力学指标体现[9]。I/R 模型组的大鼠心脏在再灌后血流动力学指标mLVSP、DP 与平衡灌流时相比降低,mLVDP 与平衡灌流时相比抬高;心肌力学指标+dP/dtmax、-dP/dtmax与平衡灌流时相比降低,表明I/R 损伤可抑制心肌收缩和舒张的功能。银杏酮酯组全程灌流改善mLVDP,DP 和-dP/dtmax,而缺血前银杏酮酯灌流(即预处理) 可改善mLVSP,DP和±dP/dtmax,说明前者仅对舒张功能有益,而后者有助于改善收缩和舒张功能,这可能与银杏酮酯的负性肌力有关[10]。而格列本脲+银杏酮酯预处理组可取消后者改善舒张功能的作用,对收缩功能(mLVSP) 无影响,因此后续的实验不设置银杏酮酯预处理组。而非特异性KATP阻断剂格列本脲能消除银杏酮酯对舒张功能的保护作用,提示银杏酮酯对I/R 损伤过程中心脏的保护作用在缺血时发生,且与KATP通道开放有关。
心肌组织病理结果是最直接反映缺血再灌注对心肌组织损伤的证据,银杏酮酯可以改善缺血再灌注造成的心肌细胞破裂、心肌纤维紊乱及炎性细胞浸润。心肌缺血再灌可以诱导心肌细胞的凋亡,而银杏酮酯已被发现可减少冠状动脉左前降支结扎导致的大鼠I/R 心肌细胞凋亡(TUNEL 染色)[11]。本研究进一步通过Hoechst 33258 染色检验凋亡信号,证实银杏酮酯可减轻离体心脏I/R 心肌细胞凋亡。格列本脲可逆转银杏酮酯对缺血再灌注心肌组织和细胞凋亡的改善作用,说明银杏酮酯抑制I/R 心肌损伤可能通过激活ATP 敏感的钾通道产生保护心肌的效应。
研究已经证明在缺氧或缺血条件下KATP通道的药理学活化可以导致心肌保护作用[12-13]。在哺乳动物心肌中,KATP通道分别在细胞膜(sarcKATP) 和线粒体(mitoKATP)中表达。mitoKATP通道的激活被认为通过调节线粒体体积,钙处理和线粒体的膜电位来改善线粒体功能[14]。有更多的证据表明,sarcKATP通道的激活也具有心脏保护性。如sarcKATP通道缺陷(KO) 小鼠心脏不能表现出预处理对I/R损伤的保护作用;在野生型小鼠心脏中,这种“受损” 的状态可通过选择性sarcKATP通道抑制剂HMR1098 所模拟[15]。sarcKATP通道的激活可以减少缺氧诱导大鼠心室肌细胞的钙超载[16],并且在保护心室肌细胞免受缺氧/复氧损伤中起重要作用[17]。此外,Suzuki 等[18]研究表明,二氮嗪(长期以来被认为是选择性mitoKATP开放剂) 的心脏保护作用事实上主要由sarcKATP通道的激活所介导。因此本研究进一步聚焦研究sarcKATP激活是否参与银杏酮酯的心肌保护作用。
分子生物学研究表明,KATP通道是内向整流钾通道(Kir) 和ATP 结合蛋白超家族成员磺酰脲类受体(SUR)两种亚基构成的复合体。Kir6 亚基(Kir6.1 和Kir6.2) 形成通道的孔相结构,而 SUR 亚基 (SUR1、SUR2A、SUR2B) 负责调节通道的功能活性[19]和ATP 对通道的敏感性。在小鼠心脏中SUR2A 和Kir6.2 是构成心室肌细胞KATP通道的主要成分[20]。在Kir6.2-/-基因敲除小鼠心脏缺血再灌注后严重挛缩开始时间变短[21]。Kir6.2-/-小鼠心肌细胞接受异丙肾上腺素刺激后,舒张期钙超载,心肌损伤,死亡率增加[22]。而Jovanovi'c 等[23-24]发现SUR2A 表达的适度增加可保护心脏免受缺血/再灌注和缺氧的代谢应激,且SUR2A 表达的增加足以增加胞膜KATP通道的数目。过表达SUR2A 的小鼠胞膜KATP通道的数量相应增加,对MIRI 抵抗力也随之增加[25]。由此可见,KATP激活是心肌缺血时重要的适应性保护机制,其作用有赖于Kir6.2 亚基的存在和SUR2A 的表达增加。本研究发现I/R 过程中大鼠心肌Kir6.2 亚基表达并未见变化,这与有研究报道心肌梗死后心肌细胞中Kir6.2 蛋白表达未改变一致[26]。而I/R 使SUR2 表达增高,银杏酮酯则进一步促进SUR2 的表达,提示银杏酮酯可通过促进I/R 心肌SUR2 表达增加胞膜KATP通道的数目。
为了直观观察心肌细胞膜KATP通道的情况,本课题组使用全细胞膜片钳记录IKATP。结果发现模型组KATP通道开放,0 mV 电压下的电流密度增大,说明原本关闭的心脏胞膜KATP通道在代谢应激的状态下开放[5,27];而使用银杏酮酯灌流则进一步促进KATP通道的开放,由此可以推测银杏酮酯对I/R 心肌损伤的保护作用可能与激活KATP通道有关。缺血时胞膜KATP激活开放后,心肌细胞复极化时K+外流增加,导致动作电位时程缩短,Ca2+内流减少,从而减轻细胞内钙超载[28];同时心肌收缩力减弱,减少ATP 消耗,降低能量消耗[29],减轻心肌损伤,改善心脏功能。有研究表明,由sarcKATP通道活化引起的静息膜电位的超极化足以导致心室肌细胞中更有效的Ca2+扩散,导致复氧诱导的钙超载水平的降低[17]。之前的研究发现银杏酮酯抑制缺血心室肌细胞钙超载[30],可降低右心房自律性,降低心房收缩力[10],具有负性肌力作用。因此,银杏酮酯缺血预处理对心脏的保护可能通过激活sarcKATP通道,减轻细胞钙超载,维持心肌细胞的钙稳态,同时负性肌力作用限制能量消耗而产生。格列本脲能消除银杏酮酯的保护作用,需要进一步实验证实银杏酮酯缺血预处理的保护作用是否还通过mitoKATP发生。
综上所述,银杏酮酯通过增加KATP通道SUR2 亚基的表达,使I/R 期间KATP通道数量增加,激活并促进sarcKATP通道的开放,减轻钙超载,抑制心肌细胞凋亡和心肌损伤。本研究对临床运用银杏酮酯防治MIRI 有一定的指导意义,今后仍需对银杏酮酯激活KATP通道防治MIRI 的具体机制做进一步的研究。

