骨质疏松程度对甲型血友病性关节炎全膝置换术失血量的影响
王彭禾 吴佳燕 朱广平 沈佳怡 陈佳丽 金红婷 童培建
血友病(hemophilia)是一种X染色体隐性遗传性出血性疾病,临床上主要分为甲型[凝血因子Ⅷ(FⅧ)缺乏]和乙型[凝血因子Ⅸ(FⅨ)缺乏],以关节、肌肉、皮肤黏膜反复出血为特点[1]。血友病性关节炎(Haemophilic arthropathy,HA)正是由于关节、肌肉反复出血,最终导致关节结构性损伤改变,主要累及髋、膝、踝和肘关节[2]。对于晚期的HA患者,全膝关节置换术(total knee arthroplasty,TKA)是首选的治疗方式。近些年来,对影响TKA术后失血量因素的研究众多[3-4],但大多集中在性别、年龄、手术方式等,而对基础疾病如骨质疏松症(osteoporosis,OP)与TKA术后失血量关系的研究较少。有研究显示[5],约70%的HA患者会出现骨密度下降,其中43%表现为骨质减少,27%表现为骨质疏松。故为更好地反映骨质疏松程度对TKA术后失血的影响,本文围绕不同程度的骨质疏松是否影响甲型HA患者TKA术后的失血量展开回顾性研究,现报道如下。
1 资料与方法
1.1 一般资料 收集于2019年1月至2021年6月在浙江中医药大学附属第一医院骨伤中心接受初次单次TKA治疗的47例甲型HA患者,均为男性。(1)纳入标准 :①活化的部分凝血活酶时间(activated partial thromboplastin time,APTT)明显延长,能被正常血浆及新鲜吸附血浆纠正;②血小板计数、凝血酶原时间(prothrombin time,PT)正常;③内源性凝血因子活性检测见凝血因子Ⅷ活性(FⅧ:C)<60%;④血管性血友病因子抗原(von Willebrand factor Ag,VWF Ag)正常,FⅧ活性(factor Ⅷ activity,FⅧ:C)与血管性血友病因子抗原(von Willebrand factor antigen,VWF Ag)比值(FⅧ:C/VWF Ag)明显降低;⑤有反复膝关节出血史、畸形及活动障碍;⑥Arnold分期Ⅳ~Ⅴ期[6];⑦行初次单侧TKA。(2)排除标准:①长期服用激素;②患有恶性肿瘤、糖尿病、冠心病等重大内科疾病;③严重脏器功能障碍;④有严重出血倾向;⑤骨密度被测部位存在严重病变或有金属植入物;⑥病史记录不详、数据缺失。
1.2 分组方法 采用美国GE双能X线骨密度仪检测L1~L4椎体和左侧股骨颈。记录测量区域骨密度(BMD,g/cm2)。国际临床密度测定学会建议[7],>50岁的男性应取骨密度检测获得的T值,根据WHO推荐骨质疏松诊断标准[8],骨密度T值<1.0为正常,1.0~2.5为骨量减少,>2.5为骨质疏松;对于<50岁的男性,应使用根据人种及年龄调整后的Z值代替T值。Z值>2.0为正常,Z值≤2.0提示骨密度降低。再将所有患者根据骨质疏松程度分为骨量正常组(n=14)、骨量减少组(n=21)、骨质疏松组(n=12)。国内外研究[9-10]认为影响TKA术后失血量的因素众多,为更准确地表现骨质疏松程度与HA患者术后失血量的关系,本研究纳入的一般资料、手术资料、术前相关化验指标等比较均无明显差异(P>0.05),见表1-3。所有患者的病历资料均获得浙江中医药大学附属第一医院伦理委员会审核批准(2021-KL-007-02),患者签署知情同意书。

表1 三组一般资料比较

表2 三组手术资料比较
表3 三组术前指标比较()
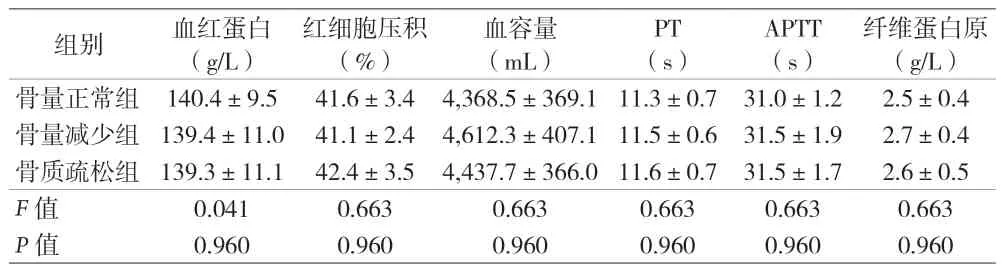
表3 三组术前指标比较()
红细胞压积(%)组别血红蛋白(g/L)血容量(mL)PT(s)APTT(s)纤维蛋白原(g/L)骨量正常组140.4±9.541.6±3.44,368.5±369.111.3±0.731.0±1.22.5±0.4骨量减少组139.4±11.041.1±2.44,612.3±407.111.5±0.631.5±1.92.7±0.4骨质疏松组139.3±11.142.4±3.54,437.7±366.011.6±0.731.5±1.72.6±0.5 F值0.0410.6630.6630.6630.6630.663 P值0.9600.9600.9600.9600.9600.960
1.3 凝血因子替代方案 围手术期采用重组FⅧ制剂(百因止)替代治疗。替代方案:补充凝血因子量=(需要达到的FⅧ浓度-检测的FⅧ浓度)×体质量(kg)×0.07×(1-红细胞压积)。手术当日,凝血因子的浓度保持在80%~100%,术后前3 d保持60%~80%,4~6 d保持40%~60%,7~14 d保持40%~40%,以后逐步降低至20%~30%。根据患者的血常规、凝血功能、凝血因子等指标进行补充[11]。
1.4 手术方案 TKA手术均由同一高年资主任医师主刀完成。取膝正中纵行切口长约15 cm,经髌旁内侧入路,切除半月板、交叉韧带,行胫骨、股骨髁截骨,矫正下肢力线,安装合适的胫骨、股骨假体及关节垫片,检查膝关节活动可。放置引流管1根。
1.5 术后处理 引流管于术后夹闭6 h后开放,只予物理抗凝如弹性绷带、局部冰敷、气压治疗等,不予药物抗凝;术后1~3 d床上行下肢功能锻炼,3~5 d后指导患者下床扶助行器行走。
1.6 观察指标 (1)术前血容量:根据Nadler方法[12]计算,术前血容量=0.3669×H3+0.03219×W+0.6041,其中H为身高(m),W为体质量(kg)。(2)总失血量:根据Gross方程计算[13]。总失血量=术前血容量×(术前红细胞压积术后住院期间最低红细胞压积)/(术前及术后住院期间最低红细胞压积之和)/2+输血量。(3)显性失血量:显性失血量=术中失血量+术后引流量。术中失血量由抽吸瓶中、纱布和敷料中回收的血量来估计。术后伤口的引流量根据引流瓶、纱布和敷料中回收的血液量来估计。(4)隐性失血量:隐性失血量=总失血量显性失血量,隐性失血量是因组织出血和溶血造成的失血量。(5)最大血红蛋白丢失量:最大血红蛋白丢失量=术前血红蛋白浓度-出院前最低血红蛋白浓度。(6)输血率:输血率=输血人数/组内总人数。(7)术后住院天数:手术日期至出院日期的天数。
1.7 统计学方法 采用SPSS 25.0 软件进行统计分析。计数资料以n或%表示,组间比较采用χ2检验;计量资料以()表示,组间比较采用单因素方差分析,两两比较采用LSD比较。P<0.05为差异有统计学意义。
2 结果
2.1 三组术后早期失血量的比较 三组患者组间比较,术后总失血量、显性失血量、隐性失血量、最大血红蛋白丢失量差异有统计学意义(P<0.05);术中失血量、输血率、术后住院天数比较无明显差异(P>0.05),见表4。
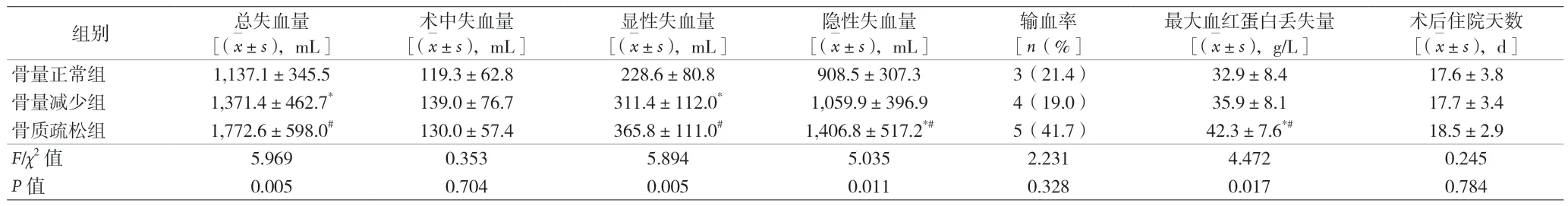
表4 三组术后指标比较
2.2 术后早期并发症 三组患者住院期间均未出现血肿、感染、下肢深静脉血栓形成及假体松动等并发症。
3 讨论
3.1 OP对TKA术后失血量的影响 TKA是目前公认的减轻疼痛、矫正畸形、改善关节功能最有效的方法[14-15]。近年来有学者[16-17]发现OP对TKA术后的失血量有较大影响。如韩尧的研究中[17],根据BMD值将70例行TKA的晚期KOA患者分为骨量正常组、骨量减少组、骨质疏松组,发现骨质疏松组的总失血量和隐性失血量显著高于其他两组(P<0.05)。结果提示OP是TKA术后失血量增多的重要危险因素。
3.2 OP引起TKA术后失血增多的机制 尽管随着凝血因子替代疗法的普及,血友病患者围手术期的出血量比以往大幅降低,然而隐性失血量及总失血量仍明显高于非血友病患者[18-19]。本研究结果显示,骨质疏松组术后的总失血量、显性失血量、隐性失血量、最大血红蛋白丢失量明显多于骨量减少组和骨量正常组(P<0.05),骨量减少组显性失血量大于骨量正常组(P<0.05)。
综合考虑,作者认为主要有以下几方面原因:第一,合并骨质疏松症的患者骨小梁变薄、变细甚至断裂,髓腔间隙变大,骨细胞逐渐减少,部分骨细胞核固缩,空骨陷窝数量逐渐增加,哈佛系统以外的空骨陷窝可达到75%,常出现微孔和松质骨化[20]。骨皮质变薄,骨膜孔、皮质孔、骨内膜孔变大,血液积聚在增大的骨髓腔内,经皮质孔流向周围组织,骨床渗血,导致周围组织间隙大面积积血。第二,晚期HA患者常合并有严重的骨赘、关节内翻畸形,由于骨密度降低,骨间隙变大,术中对股骨远端和胫骨近端松质骨截骨易造成局部微骨折,大量干髓端微小血管破裂出血,截骨面的渗血量明显大于骨量正常的患者[21]。第三,骨质疏松患者体内氧自由基含量水平高于非骨质疏松患者,研究认为骨质疏松的发生与氧化应激密切相关[22],过多的氧自由基会与红细胞磷脂膜发生过氧化反应,引起溶血反应,促进血红蛋白的丢失,造成隐性失血[23]。
3.3 不足之处 本研究尚存在一些不足之处。因条件限制未进行术后随访,未能良好地评估该类患者中远期疗效。除此之外本研究作为回顾性研究,资料有限,证据等级较低,易产生选择偏倚,接下来还需要进一步大样本、多中心的研究。

