LncRNA LOC344887在非小细胞肺癌组织中的表达及对非小细胞肺癌细胞生长的影响
岳静 陈雪琴 程卓安
据最新癌症统计数据,肺癌仍是全球癌症死亡的主要原因[1]。肺癌中80%~85%的分型为非小细胞肺癌(Non-small cell lung cancer,NSCLC),而肺腺癌和肺鳞状细胞癌(简称肺鳞癌)是NSCLC中的两种主要组织学亚型。长非编码RNA(long non- coding RNA,lncRNA)是一类长度>200个核苷酸的非编码RNA(non- coding RNA,ncRNA),其表达具有细胞和组织特异性[2],并且参与调控多种癌症增殖、凋亡、转移等过程[3],在NSCLC发生、发展中也起着关键作用[4],然而,只有少数lncRNA被鉴定出来,大多数lncRNA在癌症中的作用尚不清楚,lncRNA与NSCLC的相关性有待进一步研究。本课题组前期通过基因芯片筛选出了一个在NSCLC组织中异常表达的lncRNA LOC344887,又名NMRAL2P(NmrA like redox sensor 2),长度共1813bp,其在肿瘤中尤其是NSCLC中的表达和作用尚未阐明。本研究通过分析LOC344887在NSCLC组织中的表达及其与NSCLC预后的关系,并通过构建敲低LOC344887的NSCLC细胞模型,探讨LOC344887调节NSCLC细胞生长的分子机制。
1 材料与方法
1.1 实验材料及设备 (1)细胞系:人肺鳞癌细胞系NCI-H2170购自美国ATCC细胞保藏中心。(2)主要试剂与设备:Trizol(15596026CN)和LipofectamineTM 3000转染试剂(L3000015)购自美国Invitrogen公司;PrimeScriptTM RT Master Mix RNA逆转录试剂盒(RR036A)与TB Green(RR420A)购自日本宝日医生物技术(北京)有限公司;RPMI1640培养基(11875093)、FBS(10099-141)均购自美国Gibco公司;引物由上海生工生物工程有限公司合成;小干扰RNA(small interfering RNA,siRNA)及阴性对照siRNA均购自上海吉玛制药技术有限公司;4%多聚甲醛溶液(P0099)、结晶紫染色液(C0121)购自上海碧云天生物技术有限公司;CCK-8试剂盒(CK04)购自日本Dojindo公司;PI/RNase细胞周期染色液(550825)购自美国BD Bioscience公司。实时荧光定量PCR(ABI7500)仪购自美国ABI公司;酶标仪(SpectraMax i3)购自美国Molecular Devices公司;流式细胞仪(CytoFLEX S)购自美国Beckman公司。
1.2 实验方法 (1)生物信息学分析:检索ENCORI数据库中LOC344887相关数据,共纳入526例肺腺癌样本及对应的59例正常样本,501例肺鳞癌样本及对应的49例正常样本,分别比较LOC344887在NSCLC样本与正常样本中表达水平的差异。收集公开的癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库中NSCLC相关的基因芯片数据,根据LOC344887表达水平的中位数进行分组,高于中位数者为LOC344887高表达组,低于中位数者为LOC344887低表达组,采用Kaplan-Meier绘制生存率曲线,分析LOC344887表达水平与NSCLC患者总生存率的关系。(2)细胞培养:人肺鳞癌细胞系NCI-H2170培养于添加10% FBS、1%青链霉素的RPMI1640完全培养基中,并置于37℃、5% CO2、饱和湿度的培养箱中进行培养。(3)siRNA转染:按照2×105个细胞/孔的浓度接种NCI-H2170细胞至6孔板中,待细胞贴壁后,根据转染试剂操作说明分别转染靶向敲低LOC344887的siRNA(si-LOC344887)及对照组siRNA(si-Control)至细胞中。si-LOC344887序列如下,正义链:5’-GCAGUACGGGAAGGAGAUUTT-3’,反义链:5’-AAUCUCCUUCCCGUACUGCTT-3’。(4)实时荧光定量PCR:使用Trizol试剂提取LOC344887敲低组及对照组的细胞总RNA,根据RNA逆转录试剂盒操作说明将RNA逆转录为cDNA,然后采用TB Green进行实时荧光定量PCR检测LOC344887的mRNA水平,以β-actin为内参标准化LOC344887的表达。相关引物序列如下,LOC344887上游引物:5’-CGTGAAAGCCTCTGATGGAGA-3’;LOC344887下游引物:5’-AGACGGCTGCTCCAATATCA-3’;β-actin上游引物:5’-AGTTGCGTTACACCCTTTCTTG-3’;β-actin下游引物:5’-GCTGTCACCTTCACCGTTCC-3’。实时荧光定量PCR反应程序如下:95℃预变性30 s;95℃5 s,60℃ 30 s;共40个循环;95 ℃ 15 s,60 ℃ 1 min。实验结束采用2-ΔΔCt法计算mRNA相对表达量。(5)克隆形成实验:收集LOC344887敲低组及对照组的细胞各500个接种于6孔板中,于培养箱中连续培养10 d后,弃去培养液,加入2 mL PBS清洗细胞两次,之后加入1 mL 4%多聚甲醛溶液室温固定细胞15 min,再加入结晶紫溶液室温染色细胞15 min,最后弃去结晶紫染色液,并用清水洗去多余的染色液,待孔中无液体残留时拍照记录数据。(6)CCK8法绘制细胞生长曲线:按照1×103个/孔的浓度分别接种LOC344887敲低组及对照组细胞于96孔板中,每组设5个复孔,并分别于接种后第1、2、3、4天根据试剂盒说明加入CCK8工作液(工作液配制方法:用RPMI1640完全培养液将CCK8储存液稀释10倍),于培养箱中继续孵育2 h后采用酶标仪读取细胞培养板中的吸光度值,记录数据并绘制细胞生长曲线。(7)细胞周期检测:收集LOC344887敲低组及对照组的细胞各1×105个,加入5 mL PBS清洗细胞2次,之后用预冷的70%乙醇溶液在-20℃冰箱固定细胞过夜。次日设转速1,500 rpm离心5 min收集细胞沉淀,再加入5 mL PBS清洗细胞2次,之后按照PI/RNase染色液操作说明各组分别加入500μL染色液对细胞进行标记,室温避光孵育30 min后采用流式细胞仪测定DNA含量,最后运用Modfit软件拟合数据图像并分析细胞周期分布。
1.3 统计学方法 采用Prism 8.0统计软件。计量资料以()表示,组间比较采用方差分析,两两比较采用非配对的t检验。NSCLC组织与癌旁组织比较采用配对t检验。采用Kaplan-Meier绘制生存率曲线,生存曲线比较采用Log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 NSCLC组织中LOC344887的表达水平 分析ENCORI数据库中相关资料发现LOC344887在NSCLC样本中的表达存在整体上调趋势,尤其是在肺鳞癌样本中的表达相较正常样本显著上调了155.7倍,差异具有统计学意义(P<0.001),见图1。以上结果提示LOC344887可能与肺鳞癌发生、发展的相关性更高,于是本研究后续着重研究LOC344887对肺鳞癌细胞的影响。
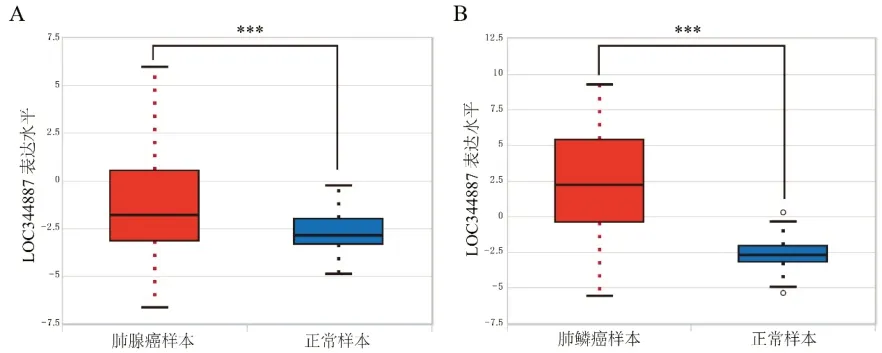
图1 NSCLC样本与非配对的正常样本中LOC344887的表达水平比较(A.肺腺癌样本与正常样本中LOC344887的表达水平比较;B. 肺鳞癌样本与正常样本中LOC344887的表达水平比较。与正常样本比较,***P<0.01)
2.2 LOC344887敲低组和对照组细胞LOC344887表达水平比较 通过转染siRNA的方法敲低肺鳞癌细胞NCI-H2170中LOC344887的表达,结果显示,较对照组,LOC344887敲低组的LOC344887表达下调了约3.2倍,差异具有统计学意义(P<0.01),见图2。
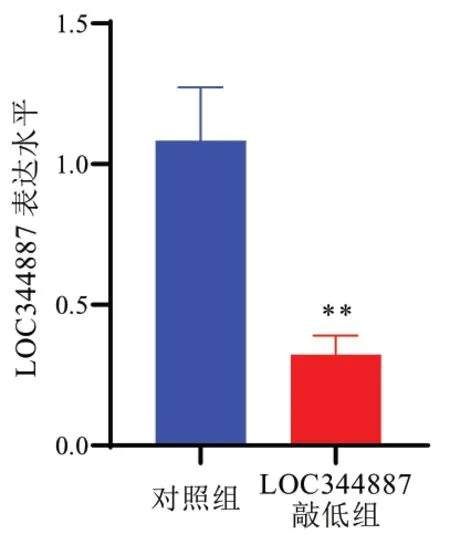
图2 LOC344887敲低组和对照组细胞LOC344887表达水平比较(与对照组比较,**P<0.01)
2.3 敲低LOC344887对NCI-H2170增殖能力的影响 通过克隆形成实验和细胞生长曲线实验检测LOC344887对NCI-H2170细胞增殖的影响,结果显示敲低LOC344887后,NCI-H2170细胞克隆繁殖能力明显减弱,生长速率降低(P<0.05),见图3。

图3 敲低LOC344887对NCI-H2170增殖能力的影响(A.克隆形成实验;B.细胞生长曲线。与对照组比较,***P<0.001)
2.4 敲低LOC344887对NCI-H2170细胞周期的影响 流式细胞术检测细胞周期实验结果显示,敲低LOC344887后,NCI-H2170细胞处于S期及G2/M期的细胞比例明显降低(P<0.05),处于G1期细胞比例明显上升,细胞阻滞于G1期,见图4。
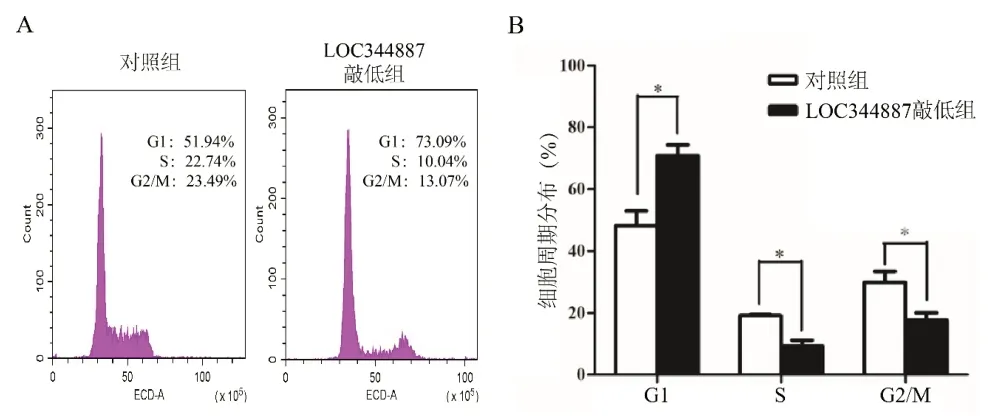
图4 敲低LOC344887对NCI-H2170细胞周期的影响(A.流式细胞术分析细胞周期分布峰形图;B.对A图中各细胞周期分布的统计。与对照组比较,*P<0.05)
2.5 不同LOC344887表达水平的NSCLC患者总生存期的比较 通过分析TCGA数据库相关数据绘制的NSCLC患者生存曲线发现,LOC344887表达水平与NSCLC患者的总生存期显著相关,LOC344887表达越高,患者总生存率越差,提示LOC344887可作为肺鳞癌的潜在治疗靶标和预后标志物,见图5。

图5 不同LOC344887表达水平的NSCLC患者总生存期的比较
3 讨论
近年,大量研究表明lncRNA的异常表达参与调控多种癌症增殖、凋亡、转移等过程[5],lncRNA已逐渐成为了癌症靶向诊断、治疗领域的重要研究对象。在NSCLC中也有相关研究,如lncRNA HOXC-AS3在NSCLC组织及细胞中高表达,其下调可抑制NSCLC细胞的增殖、侵袭、迁移[6],而lncRNA PCAT1则可通过抑制cGAS/STING信号介导T细胞活化,从而促进NSCLC发生和免疫抑制[7]。因此,探究NSCLC中lncRNA的临床意义、生物学功能及作用机制,有助于推动NSCLC的诊断和靶向治疗。
前期WU等[8]首次发现LOC344887在NSCLC组织中高表达,但该研究并未分析其在不同类型NSCLC组织中的状态及相关性,也尚未进一步研究其功能及作用机制。本研究首先通过数据库挖掘发现LOC344887在NSCLC样本中高表达,进一步分析发现其在肺鳞癌样本中的异常表达较肺腺癌样本中的更明显,推测LOC344887可能与肺鳞癌发生发展的相关性更高。本研究还发现LOC344887在NSCLC组织中表达越高,患者预后越差,提示LOC344887可作为肺鳞癌的潜在治疗靶标和预后标志物。
目前有关LOC344887在肿瘤发生、发展中作用机制的研究报道较少。本研究显示敲低肺鳞癌细胞中LOC344887的表达降低了细胞增殖速率,并阻滞细胞于G1期,提示LOC344887与肺鳞癌细胞的生长密切相关,综合以上信息作者也初步推测LOC344887表达水平具有组织差异性,在不同肿瘤中呈现不同状态,作用机制也不同。
另外,有研究提示LOC344887可能受核因子-E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)调控,介导抗癌药物对结肠癌、食管癌细胞的抗肿瘤作用[9],调控肺纤维化发生[10]。还有研究表明LOC344887可能通过调控下游靶基因的甲基化介导胃癌进展[11],说明LOC344887在DNA表观遗传调控方面也发挥着重要作用。这为我们后续挖掘LOC344878在NSCLC中的分子机制提供了方向,之后课题组将深入探究LOC344887在不同类型NSCLC中的作用机制,为NSCLC的发生、发展的机制研究提供新见解。
综上所述,本研究证实了LOC344887影响LUSC细胞NCI-2170的生长,LOC344887在NSCLC组织中高表达且与预后相关。LOC344887可能为肺鳞癌的潜在治疗靶点和预后标志物。

