抗抑郁药对他莫昔芬及其代谢物在大鼠体内外代谢的影响
王鹏 刘晶 陈舒
乳腺癌是女性中发病率最高的恶性肿瘤,占女性全部恶性肿瘤发病构成的首位。乳腺癌患者在治疗过程中遭受身心各方面的应激源,会出现焦虑、抑郁等应激相关障碍[1-2],再加上乳腺癌患者在长期服用他莫昔芬(TAM)的过程中也会发生热潮红、抑郁等显著不良反应[3],所以乳腺癌合并抑郁的患者在临床中普遍存在。他莫昔芬(TAM)作为选择性雌激素受体拮抗剂,在临床中广泛用于预防和治疗雌激素受体或孕激素受体阳性乳腺癌患者肿瘤复发。然而,临床研究表明抗抑郁药的使用会干扰TAM的临床疗效,进而增加乳腺癌复发的风险[4]。美国FDA对TAM联用抗抑郁药也进行相关警告提醒[5]。表明TAM与抗抑郁药联用过程中可能存在药物相互作用,使得TAM的疗效减弱,乳腺癌复发风险增加。TAM是前体药物,主要通过细胞色素P450 2D6酶(CYP2D6)代谢成具有生物活性的4-羟基-N-去甲基他莫昔芬(Endoxifen)。常用抗抑郁药物帕罗西汀、度洛西汀、氟伏沙明等对CYP2D6均有不同程度抑制作用[6-7]。此类药物可能通过抑制CYP2D6活性来减弱TAM的代谢,从而影响抗肿瘤疗效。本研究依据前期研究建立UPLC-MS/MS测定血药浓度的方法[8],通过探究抗抑郁药对TAM在体内外代谢的影响,来阐明药物相互作用的可能机制,为临床合理联用抗抑郁药物和TAM提供实验基础。
1 材料与方法
1.1 仪器 ACQUITY超高效液相色谱仪、Xevo TQD质谱仪(沃特世科技有限公司);WA10005电子分析天平(上海方瑞仪器有限公司);XW-80A型涡旋混合器(其林贝尔实验室仪器有限公司);TGL-16G型高速冷冻离心机(上海安亭科学仪器厂);SHZ-88型往复式水浴恒温振荡器(其林贝尔仪器制造有限公司)。
1.2 药品和试剂 帕罗西汀标准品(批号:ATU717,含量97%),盐酸度洛西汀标准品(批号:RNA552,含量98%),马来酸氟伏沙明标准品(批号:ARC681,含量99%),TAM标准品(批号:C10388213,含量99%)均购自上海创赛科技有限公司;N-去甲基他莫昔芬(NDT)标准品(批号:6-SKS-119-2,含量98%)购于加拿大多伦多研究化学品公司;地西泮标准品(1.0 mg/mL,纯度95%~105%)购于西格玛奥德里奇上海贸易有限公司;磷酸盐缓冲液(PBS)购于北京索莱宝科技有限公司;甲醇、乙腈和甲酸为色谱纯;盐酸为分析纯;实验用水为超纯水。
1.3 实验动物 雌性SD大鼠,SPF级,8周龄,体质量为240~320 g,购于温州医科大学实验动物中心,许可证号为SCXK(浙)2020-0001。所有大鼠适应性喂养2周,自由进食饮水,实验前禁食不禁水12 h。
1.4 方法 (1)液质联用分析方法[8]。依据前期研究结果设定色谱和质谱条件:色谱柱ACQUITY UPLC BEH C18(2.1 mm×50 mm,1.7μm);柱温40 ℃;流动相为乙腈和0.1%甲酸,设置梯度洗脱:初始0~0.5 min乙腈为30%,0.5~1.0 min内升至95%,1.0~2.0 min维持95%,2.0~2.5 min降至30%;流速0.4 mL/min;分析时间3 min。电喷雾电离(ESI),采用多离子监测模式,扫描正离子。毛细管电压为2 kV,离子源温度150 ℃,脱溶剂气温度为500 ℃,锥孔气流量50 L/Hr,脱溶剂气流量为1,000 L/Hr。TAM m/z 372.27→72.00,NDT 358.26→58.00和地西泮285.101→93.10。(2)样本处理方法。将保存于-80 ℃冰箱的样品取出至室温下溶解。取50 μL样品至干净的1.5 mL离心管中,加入150 μL乙腈沉淀蛋白,加入30 μL 500 ng/mL的地西泮溶液。充分涡旋2 min,设置转速13,000 r/min,快速离心5 min,并取上清液2 μL进样分析检测。(3)体内实验方法。取雌性SD大鼠20只,随机分为4组,每组各5只,其中A组对照组,B组为帕罗西汀组(6.25 mg/kg)、C组为度洛西汀组(12.5 mg/kg)、D组为氟伏沙明组(12.5 mg/kg)。通过灌胃给予相应量抗抑郁药物,对照组给予等体积0.9%氯化钠溶液。给药30 min后再灌胃给予10 mg/kg TAM。于TAM给药前及给药后0.083、0.25、0.5、1、2、3、4、6、8、12、24 h采集尾静脉血液样本0.3 mL至肝素离心管。低温13,000 r/min离心10 min获得血浆样本,并于-80 ℃冰箱储存备用。(4)体外实验方法。以抗抑郁药物为抑制剂,TAM为底物,建立体外肝微粒体孵育体系。体系包括2 mg/mL的TAM 3.72μL(体系中终浓度为100μmol/L),大鼠肝微粒体10μL(微粒体浓度为3.42 mg/mL),PBS缓冲液174.68 μL,抗抑郁药物1.6 μL(帕罗西汀、度洛西汀、氟伏沙明药物浓度为12.5 mmol/L,体系终浓度为100 μmol/L),分别混合后在37 ℃水浴恒温震荡器中预孵育5 min,加入10μL浓度为20 mmol/L的NADPH(体系中终浓度为1 mmol/L)至终体系为200μL,并启动反应孵育30 min。反应结束后立即冷却至-80 ℃终止反应。每个孵育体系都在独立的EP管中进行,一式三份,以实验组代谢产生的NDT浓度均值与对照组代谢产物浓度均值的比值作为抑制率。
1.5 统计学方法 采用Origin 8软件绘制TAM和NDT的药物时间曲线;采用DAS 2.0软件非房室模型分析药物药动学特征并求算药物动力学参数;应用SPSS 24.0软件进行统计学分析,计量资料以()表示,组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 抗抑郁药物对TAM和NDT在体外大鼠肝微粒体代谢的影响 在大鼠肝微粒体体外孵育体系中,当帕罗西汀、度洛西汀、氟伏沙明抗抑郁药物浓度为100μmol/L时,帕罗西汀对NDT体外抑制率为62.00%(P<0.01),度洛西汀抑制率为69.67%(P<0.05),氟伏沙明抑制率为79.00%(P<0.05),结果显示三种抗抑郁药物在大鼠肝微粒体体外对NDT均有明显的抑制作用。见图1。
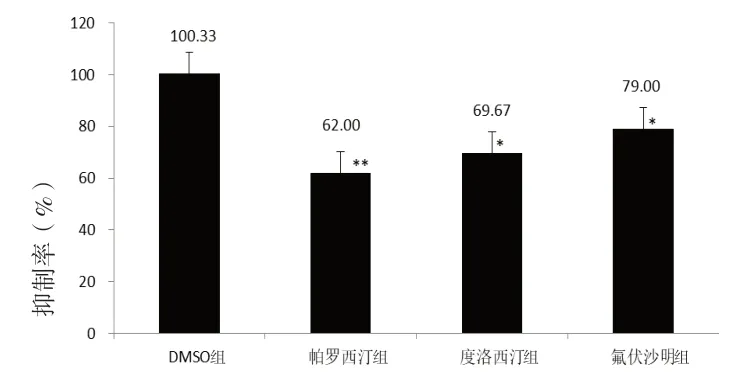
图1 抗抑郁药对NDT体外代谢产生的影响(n=3)。
2.2 抗抑郁药物在大鼠体内对TAM及其代谢物的影响 实验结果绘制的TAM和NDT的药物浓度-时间曲线如图2、3所示,药代动力学参数如表1、2所示。与空白对照组相比,帕罗西汀显著增加TAM的AUC(P<0.01),降低Vz/F(P<0.05)。并显著增加NDT的AUC(0-t)(P<0.01)和Cmax(P<0.05),降低CLz/F(P<0.05)。与对照组相比,度洛西汀能明显降低TAM的Vz/F(P<0.05)。度洛西汀能明显升高NDT的AUC和Cmax,降低CLz/F,但无显著差异。氟伏沙明对TAM和NDT的药动学参数均无明显影响。
表1 4组大鼠血浆中TAM的主要药动学参数()

表1 4组大鼠血浆中TAM的主要药动学参数()
注:与A组比较,*P<0.05,**P<0.01
参数A组B 组C组D组AUC(0-t)[(μg·h)/L]1,022.917±280.7911,882.725±275.744**2,316.229±987.0111,365.281±584.502 AUC(0-∞)[(μg·h)/L]1,043.344±282.1951,949.169±282.807**2,404.262±1,021.8601,456.44±678.471 MRT(0-t)(h)7.868±1.2408.156±0.9128.039±0.5027.518±0.525 MRT(0-∞)(h)8.311±1.2228.900±1.0248.981±0.4437.882±0.541 t1/2z(h)3.789±0.8404.126±0.3974.195±0.5874.879±1.783 Tmax(h)4.800±2.2805.612±1.6735.412±1.3423.611±1.517 CLz/F(L/kg)0.010±0.0030.005±0.0010.005±0.0030.008±0.003 Vz/F,[L/(h·kg)]0.058±0.0280.031±0.005*0.0376±0.016*0.052±0.021 Cmax(μg/L)122.362±21.020222.534±79.404276.425±104.872145.232±50.503
表2 4组大鼠血浆中NDT的药动学参数()

表2 4组大鼠血浆中NDT的药动学参数()
注:与A组比较,*P<0.05,**P<0.01
参数A组B组C组D组AUC(0-t)[(μg·h)/L]193.173±23.122280.657±17.285**319.554±125.193215.687±42.205 AUC(0-∞)[(μg·h)/L]211.054±13.131341.081±74.971590.136±544.038237.609±52.414 MRT(0-t)(h)10.062±1.1879.607±1.7399.86±0.8849.835±1.131 MRT(0-∞)(h)12.209±4.05214.058±6.3538.795±4.11612.380±2.255 t1/2z(h)5.231±3.8577.855±5.0383.595±1.2486.619±2.766 Tmax(h)7.401±4.3366.421±3.5786.432±3.5786.811±3.347 CLz/F(L/kg)0.048±0.0030.030±0.007*0.027±0.0160.044±0.01 Vz/F,[L/(h·kg)]0.354±0.2520.311±0.1380.135±0.0720.403±0.182 Cmax(μg/L)17.044±3.32332.224±7.531*30.464±11.65920.757±5.995

图2 4组大鼠中TAM的药时曲线(n=5)

图3 4组大鼠中NDT的药时曲线(n=5)
3 讨论
实验体内研究结果显示帕罗西汀能显著增加NDT血药浓度,降低其在体内的清除速度。表明帕罗西汀对NDT体内代谢有明显的抑制作用。而NDT在体内主要通过CYP2D6酶代谢。所以该代谢过程的抑制作用很可能与帕罗西汀抑制CYP2D6酶有关。另外,NDT代谢过程的抑制又会直接影响主要活性代谢产物endoxifen的血药浓度[9],从而降低抗肿瘤疗效发挥[10-11]。相对而言,帕罗西汀对TAM的体内代谢的抑制作用较弱,这是由于TAM在体内参与的代谢酶较复杂,除CYP2D6外还有其他代谢酶通道,所以帕罗西汀单纯抑制CYP2D6并不能显著影响TAM体内清除速率。度洛西汀组与空白对照比较,显示度洛西汀能增加TAM和NDT的血药浓度,降低两者的体内代谢清除率,但是无显著性差异。提示度洛西汀对TAM和NDT的体内代谢过程有一定程度的抑制作用,但是抑制作用弱于帕罗西汀。氟伏沙明对TAM的体内代谢无明显影响。体外研究与体内研究结果相一致,其显示帕罗西汀、度洛西汀和氟伏沙明对NDT体外代谢抑制作用逐级降低。
所以本研究中帕罗西汀和度洛西汀均能不同程度的抑制TAM及NDT体内外代谢的过程,而此代谢过程很可能通过抑制CYP2D6代谢酶来实现。其中帕罗西汀可能对CYP2D6酶具有更强的抑制作用,对TAM的体内外代谢的影响更为显著。IRARRAZAVAL等[12]的研究结论与本研究相符,其研究结果显示帕罗西汀对CYP2D6酶具有强抑制作用,度洛西汀具有中等抑制作用,在接受TAM治疗的乳腺癌患者中需谨慎使用。因此,建议接受TAM治疗的乳腺癌患者,合并使用抗抑郁药物时,谨慎选用帕罗西汀和度洛西汀等CYP2D6抑制作用的药物作为抗抑郁治疗。

