MIF/HIF-1α互为影响调控微血管周细胞分化对兔系统性硬化症肺动脉高压的作用研究*
李建斌,赵俊,贺超,吴锐
(1.南昌大学第一附属医院 风湿免疫科,江西 南昌 330006;2.萍乡市人民医院,江西 萍乡 337099)
系统性硬化症(systemic sclerosis,SSc)是一种原因不明的弥漫性自身免疫性疾病[1],其主要特点为广泛的小血管病变,以及致细胞外胶原沉积增加的成纤维细胞功能障碍[2]。肺动脉高压(pulmonary arterial hypertension,PAH)是SSc常见的死亡原因之一[3],与其他结缔组织病相比,SSc-PAH发病率更高。流行病学调查显示,SSc-PAH发病率为8%~12%[4]。PAH一直是SSc治疗的难点,其预后差,致死率极高,5年生存率仅20%,即使使用昂贵的新型靶向药物也只能提高5年存活率至60%[5-6]。SSc-PAH属于第一类的肺动脉高压,主要病理改变为肺血管增殖重塑,但具体病理机制尚不明确。周细胞是沿着毛细血管壁存在的细胞,与内皮细胞共同维持血管形态及功能的稳定[7]。研究发现,周细胞在SSc血管重塑、肺动脉高压过程中发挥重要的病理作用[8]。
巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)是重要的促炎因子。有研究表明,SSc患者微血管内皮细胞和成纤维细胞产生的MIF较健康人明显增多[9],提示MIF可能与SSc的炎症血管病变有关[10]。缺氧诱导因子1α(hypoxia inducible factor 1,HIF-1α)是目前已知唯一一种对缺氧生理相关水平有独特表达的哺乳动物转录因子[11]。研究显示,缺氧环境下HIF-1α可持续表达,并参与SSc患者肺血管收缩和肺血管重塑的病理改变[12]。并且有研究提示,MIF是HIF-1α的直接靶基因,HIF-1α可以上调或者抑制MIF的表达[13-14],MIF可以反向调节地塞米松介导的对HIF-1α的抑制[15]。更有文献进一步证明MIF和HIF-1α在功能上存在相互依存的关系,HIF-1α的高表达在一定程度上需要依赖于MIF[16]。基于此,笔者推测MIF与HIF-1α可互为影响从而参与SSc-PAH病理过程。本研究采用博来霉素联合野百合碱复制SSc-PAH兔模型,拟探讨SSc-PAH兔模型肺微血管周细胞MIF与HIF-1α之间的相互作用及其调控微血管周细胞分化在SSc-PAH中的病理作用。
1 材料与方法
1.1 主要仪器与试剂
电子天平购自上海舜宇恒平科学仪器有限公司,显微摄像系统和正置生物显微镜购自日本尼康株式会社,倒置相差显微镜购自日本Nikon公司。98%野百合碱(上海阿拉丁生化科技有限公司),博来霉素(北京索莱宝科技有限公司),α-SMA、HIF-1α和MIF抗体(美国Abcam公司),Col1A1抗体(北京生物科技有限公司),GAPHD抗体(上海赛默飞科技有限公司),2-甲氧基雌二醇(2-ME2)(上海阿拉丁生化科技有限公司),异丙肌苷(Isoprinosine,ISO)(北京索莱宝科技有限公司)。
1.2 实验动物与分组
40只SPF级健康雄性家兔,15周龄左右,体重1.2~1.8 kg,购自江西中医药大学动物实验中心。实验动物生产许可证号:SCXK(湘)2019-0015;实验动物使用许可证号:SYXK(赣)2017-004。饲养环境适应本实验要求,通风性好,光照交替,温度(22±2)℃,相对湿度55%,每天更换水和食物,每天清洗笼具。将兔按随机数字表法分为模型组、对照组、MIF抑制剂组及HIF-1α抑制剂组,每组10只。模型组:按40 mg/kg体重经腹腔注射98%野百合碱1次,之后每只经皮下注射0.1 mL的博来霉素(取浓度为125 mg/1.25 mL的博来霉素溶液溶解于相应0.9% NaCl溶液中配成浓度为1 mg/mL博来霉素溶液),连续注射21次,每次间隔24 h。MIF抑制剂组:在模型组基础上第2天经腹腔注射0.66 mg/kg的ISO,连续注射20次,每次间隔24 h。HIF-1α抑制剂组:在模型组基础上第2天经腹腔注射1 mg/mL的2-甲氧基雌二醇(2-methoxyestradiol,2-ME2),连续注射20次,每次间隔24 h。对照组:在正常兔相同部位注射等剂量的磷酸盐缓冲液(phosphatebuffered saline,PBS)。
1.3 实验方法
1.3.1 兔右心导管测压 模型复制21 d后,用30 mg/kg戊巴比妥钠麻醉兔。待兔麻醉后将PE50微导管连接压力传感器,再连接心电监护仪,用肝素钠盐水冲管(12 500 u肝素配500 mL 0.9% NaCl)。把兔放在手术桌上,取仰卧位备皮、消毒,依次切开表皮、真皮层及结缔组织层,切开气管,肉眼可视血管,将微导管慢慢插入,直至能可视肺动脉压力波,记录数据,退回导管。
1.3.2 解剖与取材 取兔称重,用30 mg/kg戊巴比妥钠腹膜腔注射麻醉后固定于解剖台,分离皮下组织,充分暴露胸腔,将灌注针(7#)插入左心室并送至升主动脉内,同时剪开右心耳,用蠕动泵依次灌注生理盐水和4%多聚甲醛,前1/3的量采用快速灌注(70 r/min),后2/3的量缓慢灌注(50 r/min)。灌注结束后取出心脏、双侧肺脏及肺动脉干,生理盐水清洗干净,把肺组织和肺动脉干分别用浓度为4%的甲醛固定,皮肤病变周围剪干净毛发,酒精消毒,剪下皮肤组织和皮肤血管周围结缔组织,用生理盐水冲洗干净皮肤组织,放入同样的甲醛中固定,剩下的所有标本于-80 ℃冰箱冷冻保存。
1.3.3 右心室肥厚指数(right ventricular hypertrophy index,RVHI)测定 兔麻醉处死后解剖,取下心脏,剪下左右心房,清理干净周围的血管及其他组织,沿室间隔(interventricular septum,IVS)边缘剪下右心室(right ventricle,RV)游离壁,分离出左心室(left ventricle,LV)、RV与IVS,用生理盐水清洗去除残留的血块及杂质,再用滤纸吸干水分,在恒温烘干机中烘干,分别称重。RVHI=RV/(LV+IVS)。
1.3.4 模型复制成功评价指标 模型复制成功21 d后,检测模型兔平均肺动脉压(mean pulmonary artery pressure,mPAP)和RVHI。家兔皮肤皮层增厚、毛囊过度角化、真皮纤维组织增生、皮肤附属器减少则表明模型复制成功[17-18]。
1.3.5 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测HIF-1α、MIF含量 4组家兔分别取静脉血5 mL,置入-80 ℃冰箱冷冻保存,兔血清HIF-1α、MIF检测严格按照ELISA试剂盒和酶标仪说明书步骤进行操作。根据标准品吸光度值用SPSS 22.0 软件绘制标准曲线,通过标本吸光度值计算出浓度。
1.3.6 皮肤和肺组织苏木精-伊红(hematoxylineosin,HE)染色 多聚甲醛固定好皮肤和肺组织,经梯度酒精脱水、二甲苯透明,石蜡包埋并切片(4~5 μm)。HE染色后封片。
1.3.7 免疫组织化学检测MIF和HIF-1α表达 将HE染色的切片脱蜡、冷却后用PBS(pH=9.0)洗3 min×3次,血清封闭,倒掉血清后分别加入一抗HIF-1α抗体(1∶1 000 Abcam,兔单克隆抗体)和MIF抗体(1∶1 000 Abcam,兔单克隆抗体)37 ℃孵育2 h,倒掉一抗后用PBS洗3次,每次5 min,加二抗[兔抗鼠IgG(H+L)1∶10 000 Proteintech],37 ℃孵育20 min,再用PBS洗3 min×3次,加入DAB显色液,依次复染、脱水、透明及封片:用苏木精复染,梯度乙醇脱水及二甲苯透明然后封片。每张切片选取直径<300 μm的肺小动脉进行测量,通过显微镜及电脑采集染色面积的百分比评价MIF和HIF-1α的表达水平[19]。
1.3.8 周细胞提取 胶原酶混合物消化组织。经100 μm不锈钢滤网过滤进一步选择微血管。滤液在10%的Percoll分离液中以1 000 r/min离心。将微血管团块在4 mL上清液中重悬,与链霉素蛋白酶组织一起消化15 min,然后使用Percoll不连续梯度(60%、10%、0%)去除单个细胞和组织碎片。1 000 r/min离心30 min后,用PBS对这些碎片进行重悬。离心后用无血清的DMEM洗3次,再加入50 mL无血清DMEM重悬,4 ℃静置30 min后丢弃上清液,重复2次。冲洗后,用含10% FBS的20 mL DMEM对微血管碎片进行重悬,将重悬的微血管片段移入到35 mm的细胞培养皿中,放置在37 ℃、5%二氧化碳、湿度95%的细胞培养箱中培养。72 h观察细胞的生长情况,更换培养液,后每隔3 d换液1次,原代培养8~10 d后细胞基本爬满瓶底80%~90%。加入PBS洗涤2次,加入胰蛋白酶和EDTA充分消化,镜下观察,细胞壁出现皱缩,细胞变圆,加入等体积的DMEM培养液终止其消化。离心5 min,弃上清液,加入2 mL含15%胎牛血清(fetal bovine serum,FBS)培养基重悬,接种后放进细胞培养箱中,周细胞的培养使用含5% FBS的PM培养基,置于37 ℃、5%二氧化碳培养箱中培养,7 d传代1次,传代比例为1∶4,传代次数不超过10代。使用时,将细胞刮下,加入培养基重悬,计数后加入培养板各孔中。取第5代原代细胞用于细胞鉴定。
1.3.9 Western blotting检测周细胞α-SMA和Col1A1蛋白表达 将培养皿中处理好的周细胞加入RIPA裂解缓冲液(1%SDS和0.5%去氧胆酸钠)1 mL,静置30 min,于4 ℃,12 000 r/min,离心10 min。取上清液并采用BCA法测定总蛋白含量。上清液与蛋白质上样缓冲液混匀煮沸冷却,取总量为30 μg的蛋白质点样至浓缩胶上样孔中,经电泳、转膜等步骤,获得含有蛋白质条带的PVDF膜,经5%脱脂奶粉封闭2 h、加入一抗稀释液稀释,α-SMA按(1∶1 000 Abcam,兔单克隆抗体),Col1A1(1∶1 000 Santa Cruz,兔单克隆抗体),GAPHD(1∶1 000美国赛默飞公司,兔单克隆抗体),4 ℃孵育过夜、TBST洗3×10 min、二抗予封闭液稀释(山羊抗兔IgG HRP 1∶10 000 Proteintech),室温孵育1h、再次TBST洗 3×10 min,采用ECL发光液显影,并对Western blotting结果进行分析:使用Image J软件得出曝光后各蛋白条带的Integrated density值,计算各目的蛋白与其内参蛋白的积分光密度(integrated optical density,IOD)比值。
1.4 统计学方法
数据分析采用SPSS 22.0统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步两两比较采用SNK-q检验,相关分析用Pearson法。P<0.05为差异有统计学意义。
2 结果
2.1 野百合碱联合博来霉素对兔肺动脉压力的影响
各组兔mPAP与RVHI比较,经方差分析,差异均有统计学意义(P<0.05)。与对照组比较,模型组、MIF抑制剂组及HIF-1α抑制剂组mPAP与RVHI均升高(P<0.05);与模型组比较,MIF抑制剂组和HIF-1α抑制剂组mPAP与RVHI降低(P<0.05)。见表1。
表1 各组兔肺动脉压力的比较 (n=10,±s)
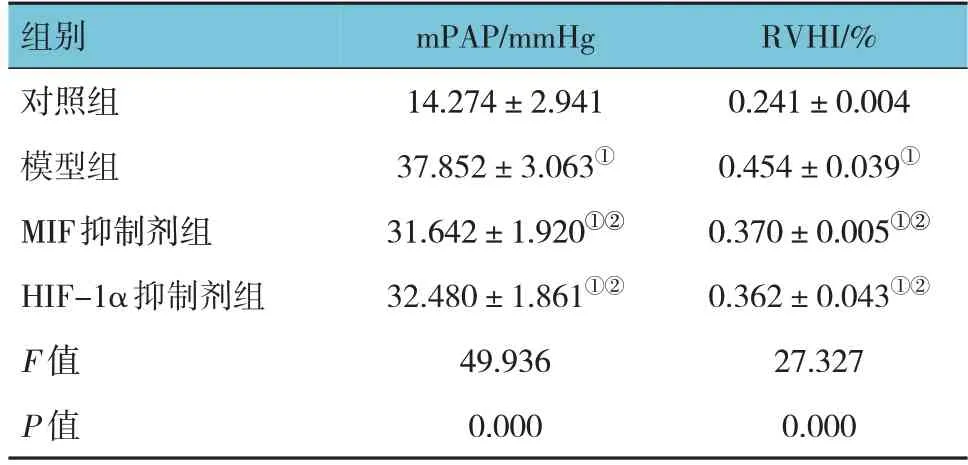
表1 各组兔肺动脉压力的比较 (n=10,±s)
注:①与对照组比较,P <0.05;②与模型组比较,P <0.05。
组别对照组模型组MIF抑制剂组HIF-1α抑制剂组F 值P 值RVHI/%0.241±0.004 0.454±0.039①0.370±0.005①②0.362±0.043①②27.327 0.000 mPAP/mmHg 14.274±2.941 37.852±3.063①31.642±1.920①②32.480±1.861①②49.936 0.000
2.2 MIF与HIF-1α抑制剂对兔血清MIF与HIF-1α含量的影响
ELISA检测结果显示,各组兔血清MIF和HIF-1α含量比较,经方差分析,差异均有统计学意义(P<0.05)。与对照组比较,模型组、MIF抑制剂组及HIF-1α抑制剂组的MIF、HIF-1α的表达均升高(P<0.05);与模型组比较,MIF抑制剂组和HIF-1α抑制剂组MIF、HIF-1α的表达均降低(P<0.05)。见表2。
表2 各组兔血清MIF和HIF-1α含量比较(n=10,pg/mL,±s)
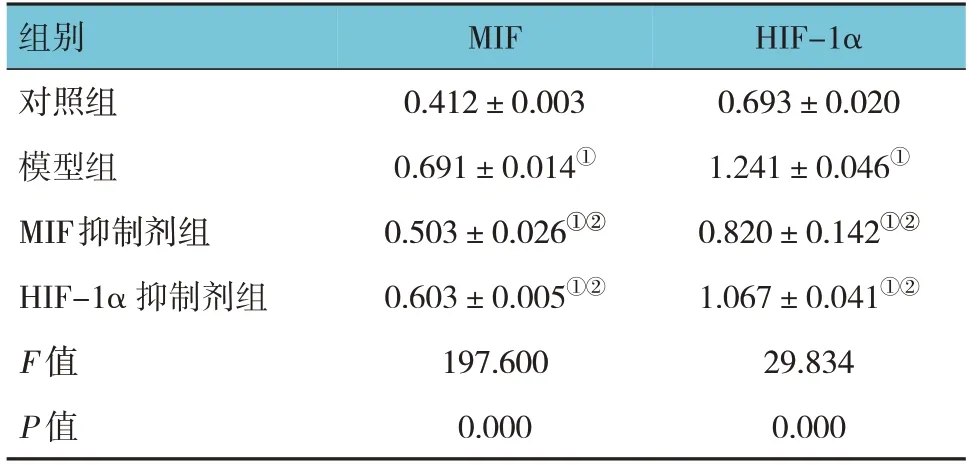
表2 各组兔血清MIF和HIF-1α含量比较(n=10,pg/mL,±s)
注:①与对照组比较,P <0.05;②与模型组比较,P <0.05。
组别对照组模型组MIF抑制剂组HIF-1α 抑制剂组F 值P 值HIF-1α 0.693±0.020 1.241±0.046①0.820±0.142①②1.067±0.041①②29.834 0.000 MIF 0.412±0.003 0.691±0.014①0.503±0.026①②0.603±0.005①②197.600 0.000
2.3 HIF-1α与MIF的相关性分析
MIF抑制剂组和HIF-1α抑制剂组中HIF-1α与MIF呈正相关(r=0.853,P=0.026)。见图1。
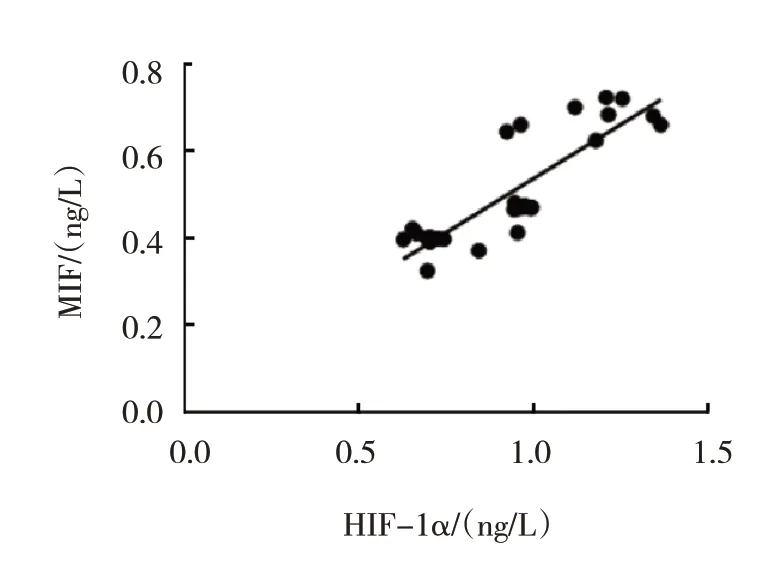
图1 兔血清中HIF-1α与MIF的相关性分析
2.4 HE染色结果
皮肤组织HE染色结果显示,对照组皮肤表皮,真皮层呈正常状态,皮肤附属器存在;模型组表皮层增厚,毛囊过度角化,真皮纤维组织增生,血管壁增厚,皮肤附属器减少;HIF-1α抑制剂和MIF抑制剂组皮肤表皮、真皮层及血管壁较对照组增厚,皮肤附属器减少。肺组织HE染色结果显示,对照组肺组织的肺小动脉结构正常,血管壁及血管周围组织正常,管壁无狭窄,未见炎症细胞浸润;模型组可见肺小动脉管壁显著增生,管腔明显狭窄,肺微血管有血管重构,血管壁和血管周围被大量的炎症细胞浸润,肺泡壁增厚,肺间质增生;MIF抑制剂组和HIF-1α抑制剂组肺小动脉增生,部分管腔狭窄,血管壁和血管周围有炎症细胞浸润,肺泡壁增厚。见图2。
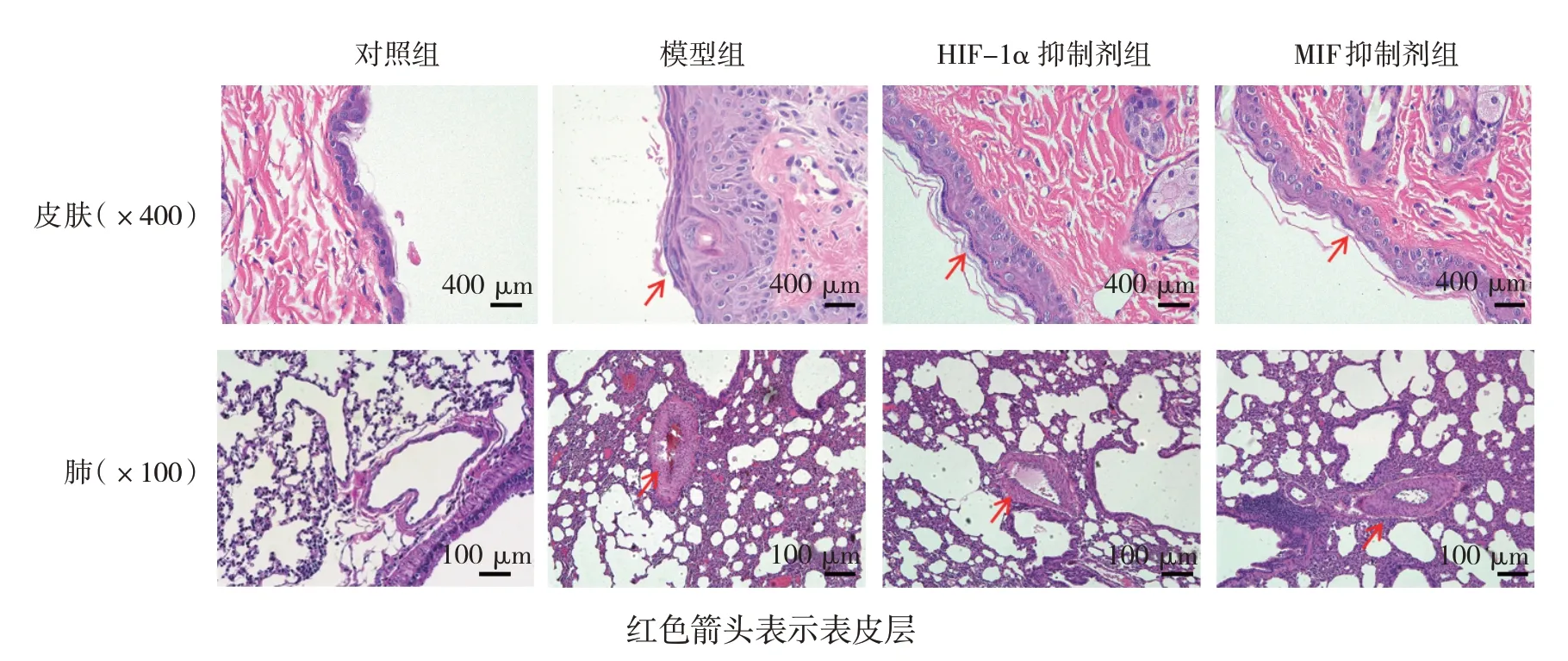
图2 各组兔皮肤和肺组织病理改变 (HE染色)
2.5 免疫组织化学染色结果
各组兔肺组织免疫组织化学染色结果显示,MIF抑制剂组和HIF-1α抑制剂组与对照组比较,MIF和HIF-1α表达较高;与模型组比较,MIF和HIF-1α表达较低,模型组兔肺组织中肺动脉壁内皮细胞的细胞浆及细胞核中MIF和HIF-1α呈高表达。见图3。
2.6 HIF-1α与MIF抑制剂对周细胞中α-SMA和col1A1的蛋白表达的影响
Western blotting结果显示,对照组、模型组、HIF-1α抑制剂组周细胞中α-SMA和Col1A蛋白相对表达量比较,经方差分析,差异均有统计学意义(P<0.05)。与对照组比较,HIF-1α抑制剂组周细胞中α-SMA和Col1A的表达均升高(P<0.05);与模型组比较,HIF-1α抑制剂组周细胞中α-SMA和Col1A的表达均降低(P<0.05)。见表3和图4。
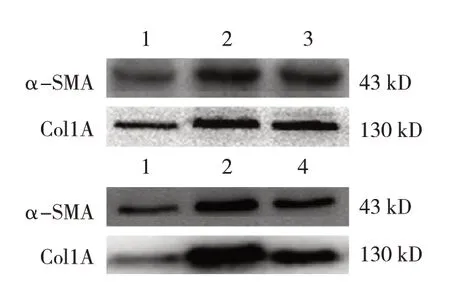
图4 各组α-SMA和Col1A凝胶电泳图
表3 对照组、模型组及HIF-1α抑制剂组周细胞中α-SMA和Col1A蛋白相对表达量比较 (n=10,±s)
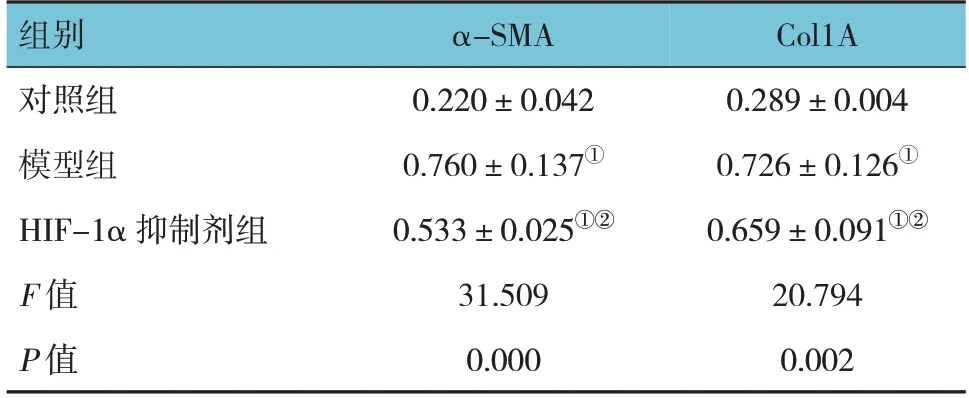
表3 对照组、模型组及HIF-1α抑制剂组周细胞中α-SMA和Col1A蛋白相对表达量比较 (n=10,±s)
注:①与对照组比较,P <0.05;②与模型组比较,P <0.05。
组别对照组模型组HIF-1α 抑制剂组F 值P 值Col1A 0.289±0.004 0.726±0.126①0.659±0.091①②20.794 0.002 α-SMA 0.220±0.042 0.760±0.137①0.533±0.025①②31.509 0.000
Western blotting结果显示,对照组、模型组、MIF抑制剂组周细胞中α-SMA和Col1A蛋白相对表达量比较,经方差分析,差异均有统计学意义(P<0.05)。与对照组比较,MIF抑制剂组周细胞中α-SMA和Col1A的表达均升高(P<0.05);与模型组比较,MIF抑制剂组周细胞中α-SMA和Col1A的表达均降低(P<0.05)。见表4和图4。
表4 对照组、模型组及MIF抑制剂组周细胞中α-SMA和Col1A蛋白相对表达量比较 (n=10,±s)
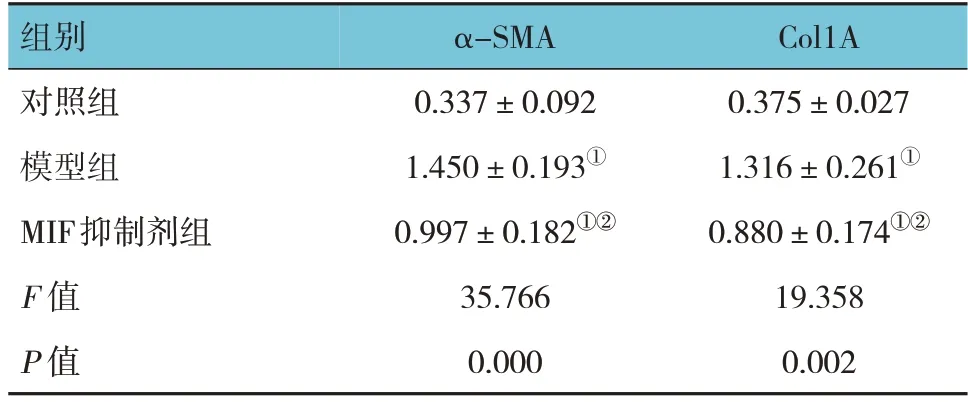
表4 对照组、模型组及MIF抑制剂组周细胞中α-SMA和Col1A蛋白相对表达量比较 (n=10,±s)
注:①与对照组比较,P <0.05;②与模型组比较,P <0.05。
组别对照组模型组MIF抑制剂组F 值P 值Col1A 0.375±0.027 1.316±0.261①0.880±0.174①②19.358 0.002 α-SMA 0.337±0.092 1.450±0.193①0.997±0.182①②35.766 0.000
3 讨论
前期研究显示,博来霉素与野百合碱可成功复制家兔SSc-PAH动物模型[20]。本研究结果显示,模型组mPAP较对照组和HIF-1α、MIF抑制剂组均升高;对动物麻醉处死解剖后,分别计算出各组的RVHI,结果显示,模型组RVHI均高于对照组和HIF-1α、MIF抑制剂组。模型复制21 d后发现,兔模型组精神较差,呼吸频率增快,活动次数减少,食欲下降,注射部位皮肤增厚变硬,弹性差,毛发脱落。皮肤HE染色结果显示表皮层增厚,毛囊过度角化,真皮纤维组织增生,血管壁增厚,皮肤附属器减少;肺组织HE染色结果显示血管壁增厚、血管壁和血管周围被大量的炎症细胞浸润,肺泡壁增厚,肺间质增生。证明博来霉素联合野百合碱能成功复制SSc-PAH兔模型。
内皮细胞在SSc中的功能和作用已被广泛研究[21],但对周细胞的功能知之甚少。周细胞与内皮细胞共同构成微血管结构,相比内皮细胞,周细胞对血管的发生及形态稳定有更为重要的生理作用。研究发现血管周细胞与内皮细胞相互作用,相互影响促进血管的成熟与稳定[22],内皮细胞分泌大量细胞因子促进周细胞增殖活化,并向肌成纤维细胞表型分化,过度表达α-SMA、COl1A,促进胶原的合成及纤维化;周细胞可分化为肌成纤维细胞,并参与SSc血管重塑及纤维化的病理过程[23-24]。另有研究发现,野百合碱诱导的肺高压血管重塑过程中,位于腺泡内的肺微动脉管壁的血管周细胞过度增殖并向平滑肌细胞转化;也有证据表明在肺动脉高压患者的肺组织中肺血管周细胞数量是健康对照2倍以上[25]。以上研究均提示周细胞向肌成纤维细胞转化后参与了SSc-PAH的病理过程,与本研究相符。
本研究显示,与对照组相比,模型组肺周细胞的MIF、HIF-1α、α-SMA表达均上调,而经MIF抑制剂(ISO)、HIF-1α抑制剂(2-ME2)处理后的周细胞MIF、HIF-1α、α-SMA表达均低于模型组,相关性分析示HIF-1α与MIF呈正相关。经HIF-1α抑制剂与MIF抑制剂处理后的兔肺血管病理改变较模型组有改善。以上结果证实MIF、HIF-1α在SSc-PAH中发挥一定病理作用,且MIF的抑制会同样导致周细胞HIF-1α下调,而HIF-1α抑制也会影响周细胞MIF的表达,提示MIF、HIF-1α可能互为影响参与SSc-PAH周细胞的病理改变。模型组周细胞α-SMA表达显著上调提示SSc-PAH周细胞向肌成纤维细胞转化,而MIF、HIF-1α的抑制可显著抑制周细胞α-SMA的表达,提示MIF、HIF-1α可通过调控周细胞向成纤维细胞的分化参与SSc-PAH的发生、发展。
综上所述,采用博来霉素联合野百合碱可成功复制SSc-PAH模型,MIF与HIF-1α可能互为影响并参与SSc-PAH病理过程,且可能通过调控周细胞向肌成纤维细胞转化参与SSc-PAH的发病,本研究结果提示,在对SSc-PAH的干预上可以考虑从阻断周细胞向成纤维细胞的分化入手,为临床治疗SSc-PAH提供一些思路。

