MCC950下调NLRP3炎症小体对慢性阻塞性肺疾病模型大鼠气管重塑及嗜酸性粒细胞水平的影响*
陈培,陈小菊,杜竺蔓,汪操会
(1.成都大学附属医院 呼吸与危重症医学科,四川 成都 610081;2.成都市金牛区营门口社区卫生服务中心 全科医学科,四川 成都 610031)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以持续存在的气流受限为特征的常见、多发呼吸道疾病,因其气流受限不完全可逆,病情常呈现逐年缓慢进展合并急性加重的临床特点[1]。急性加重性炎症的反复发作及氧化应激导致的呼吸道组织细胞损伤是COPD患者死亡的主要原因[2]。目前临床仍缺乏有效治疗COPD的手段[3],因此探索新的COPD治疗策略具有重要意义。长期暴露于香烟环境是诱发COPD的关键危险因素之一[4]。以往研究表明,连续暴露于香烟环境6个月以上可复制稳定的COPD动物模型[5]。近年来,应用香烟烟雾联合脂多糖导致COPD炎症和黏液分泌过多的COPD动物模型得到了广泛应用。研究指出香烟烟雾联合脂多糖可以诱导促炎症细胞因子的释放,如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和干扰素-γ(Interferon-γ,INF-γ)等炎症因子,从而更有效地模拟COPD病程发展及特征性呼吸道病理学改变[6-7]。
NOD样受体热蛋白结构域相关蛋白3(NODlike receptor family pyrin domain containing 3,NLRP3)的炎症体研究最广泛,其能感知一系列致病、环境和宿主衍生的因素[8]。既往研究指出NLRP3参与COPD的发生、发展[9-12]。NLRP3激活后结合并激活凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a caspase-recruitment domain,ASC),促进半胱氨酸蛋白酶-1(cysteinyl aspartate specific proteinase 1,Caspase-1)形成炎症体复合物,启动Caspase-1的自催化裂解并促进白细胞介素-1β(Interleukin-1β,IL-1β)和白细胞介素-18(Interleukin-18,IL-18)的分泌,最终引起呼吸道组织细胞破坏,引发COPD[13-14]。因此,针对NLRP3这一潜在治疗靶点改善或逆转COPD的发生、发展具有很高的研究价值。本研究通过复制COPD大鼠模型,探讨NLRP3抑制剂MCC950对COPD的潜在治疗效果。
1 材料与方法
1.1 主要材料和仪器
NLRP3抑制剂MCC950(上海陶术生物科技有限公司),脂多糖(北京金克隆生物技术),NLRP3抗体(深圳欣博盛生物科技),裂解的半胱氨酸蛋白酶-1(cleaved cysteinyl aspartate specific proteinase 1,Cleaved caspase-1)抗体(武汉菲恩生物科技有限公司),ASC抗体、β-肌动蛋白(β-actin)抗体(美国Santa Cruz公司),Goat Anti-Rabbit IgG(H+L)HRP(普健生物武汉科技有限公司),Mouse ELISA试剂盒(杭州联科生物技术股份有限公司),苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒(上海歌凡生物科技有限公司),RIPA(Radio Immunoprecipitation Assay)裂解液(上海康朗生物科技有限公司),磷酸盐缓冲液(phosphate-buffered saline,PBS)(上海碧云天生物技术有限公司),戊巴比妥钠(北京索莱宝科技有限公司)。石蜡切片机、低温高速离心机(美国Thermo Fisher Scientific公司),荧光显微镜(上海光密仪器有限公司),凝胶成像系统(上海嘉鹏科技有限公司),酶标仪(美国BioTek公司),蛋白免疫印迹实验全套设备(德国Protec公司)。
1.2 动物模型复制和分组
雄性SD大鼠(6~8周龄)60只购自南京集萃药康公司(实验动物生产许可证号:SCXK苏2021-0013;实验动物使用许可证号:SYXK苏2021-00162023-06-05),饲养在(23±1) ℃、12/12 h昼夜交替环境中,正常给予饲料和纯净水。小鼠随机分为对照组、COPD组和MCC950组,每组20只。COPD组和MCC950组大鼠参考文献[10]的方法使用脂多糖和香烟烟雾联合诱导30 d复制COPD大鼠模型,对照组不做任何处理。模型复制前24 h MCC950组大鼠腹腔注射60 mg/kg MCC950,对照组与COPD组大鼠注射等量PBS。第31天使用戊巴比妥钠(200 mg/kg)安乐死所有大鼠,并收集实验标本。本实验得到医院动物伦理委员会批准。
1.3 HE染色分析大鼠肺组织病理变化
通过戊巴比妥钠安乐死大鼠后,立即使用PBS灌注肺部,4 ℃条件下4%多聚甲醛中固定过夜,次日酒精梯度脱水,石蜡包埋肺组织,切片(厚度5 μm)。苏木精和伊红依次染色。炎症程度评估标准采用0~4分的5点法进行评估:0分,无炎症表现;1分,轻度炎症;2分,中度炎症;3分,重度炎症;4分,非常重度炎症。使用Image J图像分析软件测量各组大鼠细支气管壁厚度,并计算管壁面积和管壁面积/腔周长。
1.4 酶联免疫吸附试验测定大鼠气管重塑相关因子水平
大鼠安乐死后,用软管通过气管插管后,用5 μL预冷PBS进行灌洗,重复3次,收集其支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)。采用酶联免疫吸附试验测定BALF中的基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)、基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)、基质金属蛋白酶组织抑制剂-1(tissue inhibitor of metalloproteinases-1,TIMP-1)、基质金属蛋白酶组织抑制剂-2(tissue inhibitor of metalloproteinases-2,TIMP-2)、TNF-α、白细胞介素-6(Interleukin 6,IL-6)水平,操作过程严格按照试剂盒说明书进行。
1.5 Western blotting检测NLRP3、Cleaved caspase-1和ASC蛋白表达
大鼠肺组织经PBS清洗后,用RIPA缓冲液匀浆,并在100 ℃下煮沸10 min。总蛋白在4%~12%的SDS-PAGE上分离并转移到PVDF膜上。室温下用TBST(50 nmol Tris-HCl,150 mmol NaCl,0.05% Tween 20,pH 7.5)中的5%脱脂牛奶阻断1 h后,4 ℃条件下用一级特异性抗体(NLRP3、Cleaved caspase-1、ASC和GAPDH)孵育过夜,随后在室温下用二级HRP结合的抗体孵育4 h。使用增强型化学发光检测试剂盒对蛋白显影。GAPDH为内参蛋白,使用Quantity One软件分析各组蛋白灰度值。
1.6 大鼠嗜酸性粒细胞及趋化因子水平检测
模型复制第30天时,使用戊巴比妥钠(30 mg/kg)麻醉大鼠,抽取各组大鼠静脉血2 mL,采用美国贝克曼库尔特公司dXh 800型全自动血液分析仪测定嗜酸性粒细胞水平;采用酶联免疫吸附试验测定血清嗜酸性粒细胞趋化因子水平。
1.7 统计学方法
数据分析采用SPSS 25.0统计软件。计量资料用均数±标准差(±s)表示,比较用方差分析,两两比较用LSD-t检验;P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肺组织病理结构变化
HE染色结果显示,对照组大鼠的肺组织形态正常,而COPD组表现出严重的病理损伤和炎症细胞大量聚集。与COPD组比较,MCC950组大鼠的肺组织损伤得到改善,炎症细胞数量减少。见图1。
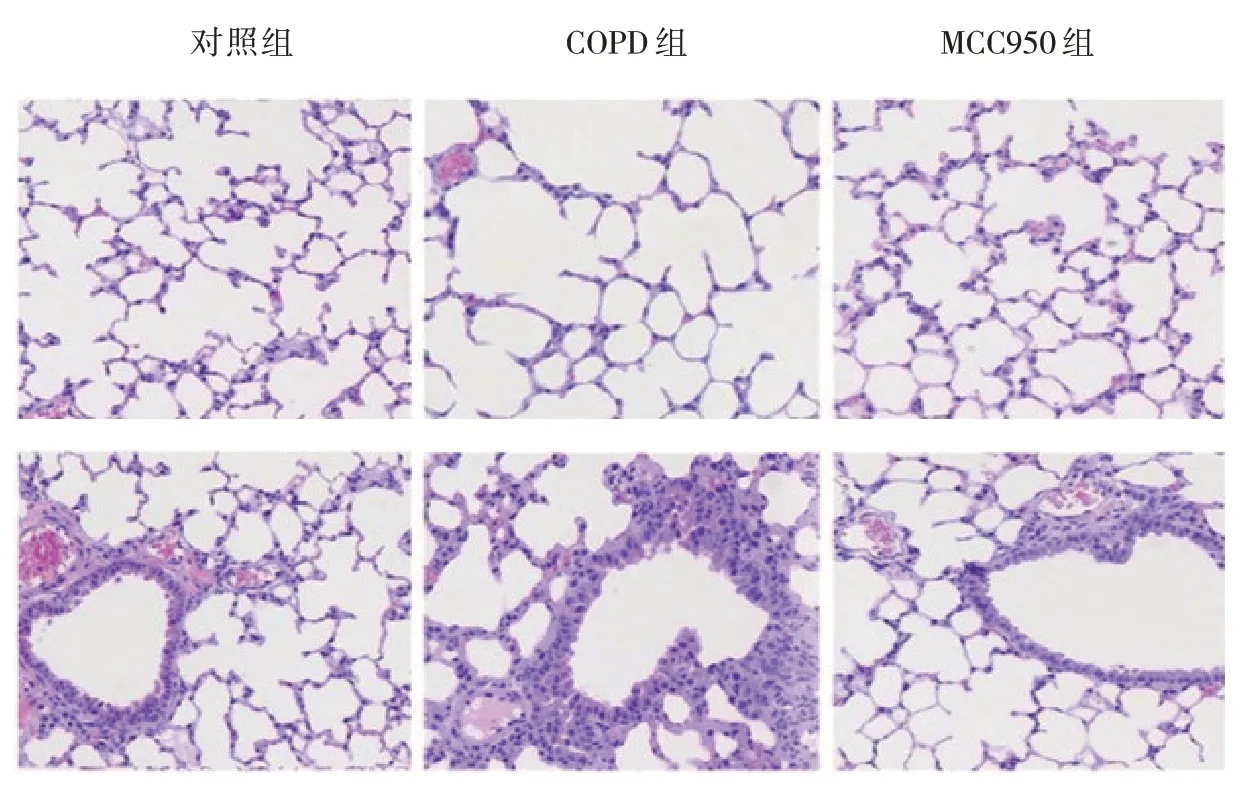
图1 各组大鼠肺组织病理变化 (HE染色×400)
对照组、COPD组和MCC950组炎症程度评分分别为(0.52±0.01)、(3.76±0.05)、(1.34±0.02)分,3组比较,经方差分析,差异有统计学意义(F=14.673,P=0.000);与对照组比较,COPD组炎症程度评分增加(P<0.05);与COPD组比较,MCC950组炎症程度评分降低(P<0.05)。
2.2 各组大鼠细支气管壁厚度、管壁面积、管壁面积/腔周长比较
对照组、COPD组和MCC950组大鼠细支气管壁厚度、管壁面积和管壁面积/腔周长比较,经方差分析,差异均有统计学意义(P<0.05)。与对照组比较,COPD组大鼠细支气管壁厚度、管壁面积和管壁面积/腔周长均升高(P<0.05);与COPD组比较,MCC950组大鼠细支气管壁厚度、管壁面积和管壁面积/腔周长均降低(P<0.05)。见表1。
表1 各组大鼠细支气管壁厚度、管壁面积和管壁面积/腔周长比较 (n=20,±s)
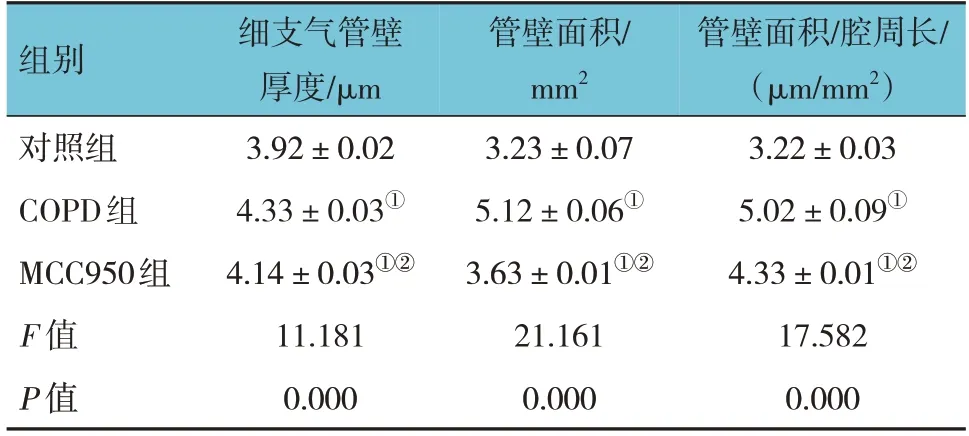
表1 各组大鼠细支气管壁厚度、管壁面积和管壁面积/腔周长比较 (n=20,±s)
注:①与对照组比较,P <0.05;②与COPD组比较,P <0.05。
组别对照组COPD组MCC950组F 值P 值管壁面积/腔周长/(μm/mm2)3.22±0.03 5.02±0.09①4.33±0.01①②17.582 0.000细支气管壁厚度/μm 3.92±0.02 4.33±0.03①4.14±0.03①②11.181 0.000管壁面积/mm2 3.23±0.07 5.12±0.06①3.63±0.01①②21.161 0.000
2.3 各组大鼠MMP-2、MMP-9、TNF-α、TIMP-1、TIMP-2和IL-6水平比较
酶联免疫吸附试验结果显示,对照组、COPD组和MCC950组的MMP-2、MMP-9、TNF-α、TIMP-1、TIMP-2和IL-6水平比较,经方差分析,差异均有统计学意义(P<0.05)。与对照组相比,COPD组大鼠血清MMP-2、MMP-9、TNF-α和IL-6水平均增加,TIMP-1和TIMP-2水平均降低(P<0.05);与COPD组相比,MCC950组大鼠血清MMP-2、MMP-9、TNF-α和IL-6水平均降低,TIMP-1和TIMP-2水平均增加(P<0.05)。见表2。
表2 各组大鼠的气管重塑相关因子水平比较 (n=20,±s)
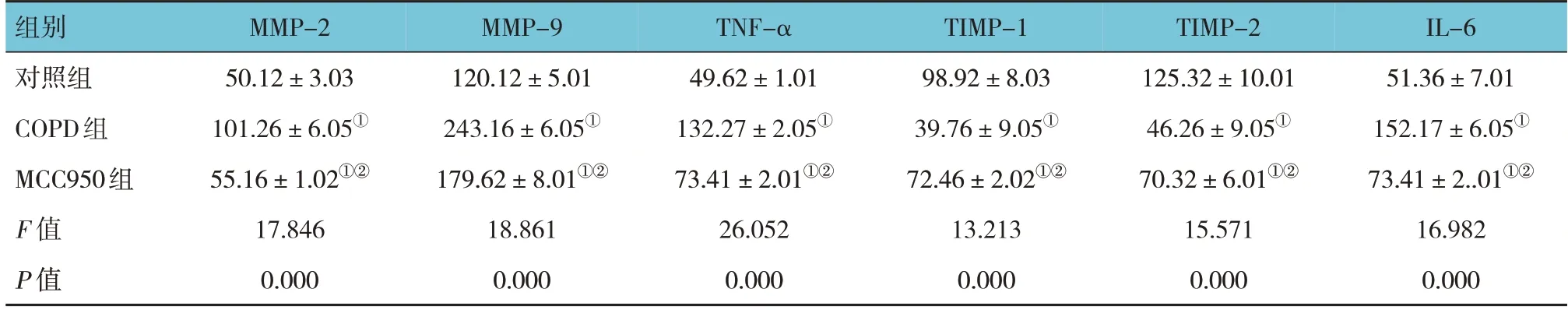
表2 各组大鼠的气管重塑相关因子水平比较 (n=20,±s)
注:①与对照组比较,P <0.05;②与COPD组比较,P <0.05。
组别对照组COPD组MCC950组F 值P 值IL-6 51.36±7.01 152.17±6.05①73.41±2..01①②16.982 0.000 MMP-2 50.12±3.03 101.26±6.05①55.16±1.02①②17.846 0.000 MMP-9 120.12±5.01 243.16±6.05①179.62±8.01①②18.861 0.000 TNF-α 49.62±1.01 132.27±2.05①73.41±2.01①②26.052 0.000 TIMP-1 98.92±8.03 39.76±9.05①72.46±2.02①②13.213 0.000 TIMP-2 125.32±10.01 46.26±9.05①70.32±6.01①②15.571 0.000
2.4 各组大鼠NLRP3、Cleaved caspase-1和ASC蛋白相对表达量比较
对照组、COPD组、MCC950组大鼠的NLRP3、Cleaved caspase-1和ASC蛋白相对表达量比较,经方差分析,差异均有统计学意义(P<0.05);与对照组比较,COPD组NLRP3、Cleaved caspase-1和ASC蛋白相对表达量均升高(P<0.05),与COPD组比较,MCC950组NLRP3、Cleaved caspase-1和ASC蛋白相对表达量均降低(P<0.05)。见图2和表3。
表3 各组的NLRP3、Cleaved caspase-1和ASC蛋白相对表达量的比较 (n=20,±s)

表3 各组的NLRP3、Cleaved caspase-1和ASC蛋白相对表达量的比较 (n=20,±s)
注:①与对照组比较,P <0.05;②与COPD组比较,P <0.05。
组别对照组COPD组MCC950组F 值P 值ASC 0.32±0.01 0.77±0.05①0.41±0.01①②16.002 0.000 NLRP3 0.22±0.03 0.96±0.05①0.44±0.02①②12.002 0.000 Cleaved caspase-1 0.12±0.01 0.59±0.05①0.32±0.01①②16.301 0.000
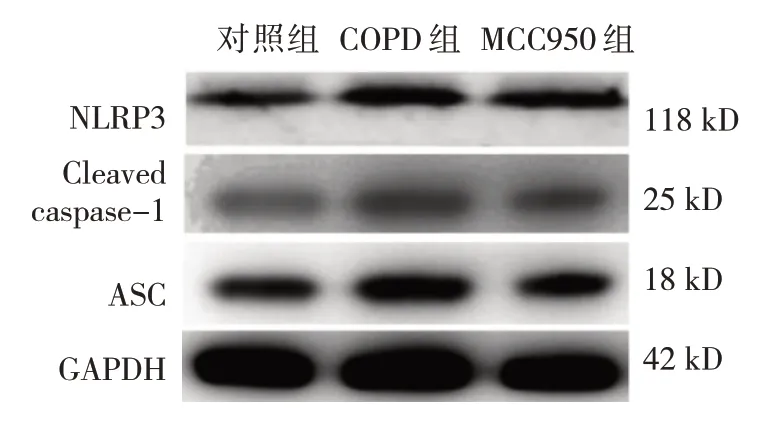
图2 各组大鼠NLRP3相关蛋白表达
2.5 各组大鼠嗜酸性粒细胞及趋化因子水平比较
对照组、COPD组和MCC950组大鼠静脉血嗜酸性粒细胞和嗜酸性粒细胞趋化因子水平比较,经方差分析,差异均有统计学意义(P<0.05)。与对照组比较,COPD组大鼠静脉血嗜酸性粒细胞和嗜酸性粒细胞趋化因子水平均增加(P<0.05);与COPD组比较,MCC950组大鼠静脉血嗜酸性粒细胞和嗜酸性粒细胞趋化因子水平均降低(P<0.05)。见表4。
表4 各组大鼠嗜酸性粒细胞和嗜酸性粒细胞趋化因子水平比较 (n=20,±s)
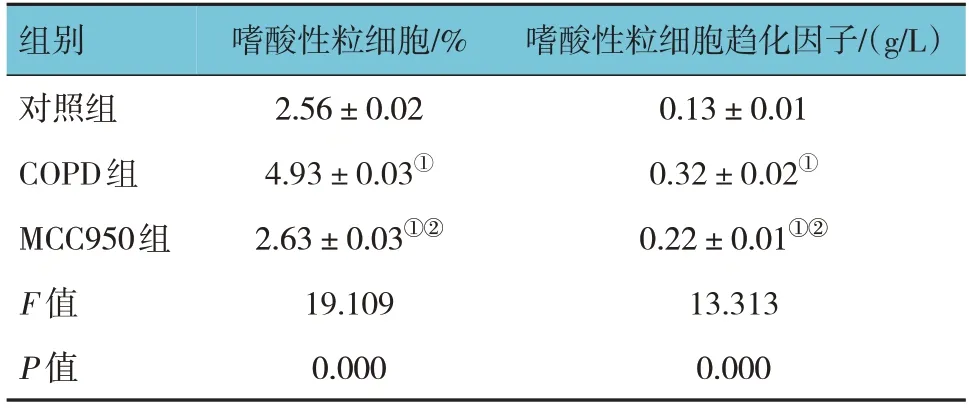
表4 各组大鼠嗜酸性粒细胞和嗜酸性粒细胞趋化因子水平比较 (n=20,±s)
注:①与对照组比较,P <0.05;②与COPD组比较,P <0.05。
组别对照组COPD组MCC950组F 值P 值嗜酸性粒细胞趋化因子/(g/L)0.13±0.01 0.32±0.02①0.22±0.01①②13.313 0.000嗜酸性粒细胞/%2.56±0.02 4.93±0.03①2.63±0.03①②19.109 0.000
3 讨论
COPD是一种常见的慢性肺疾病,常造成不完全可逆气流受限,严重影响患者预后。探寻参与COPD发病的关键因子是治疗COPD的临床热点,既往研究证实香烟是发生COPD的重要诱因之一,而NLRP3参与了COPD病程的进展[4-14],因此本研究采用香烟烟雾联合LPS复制COPD大鼠模型。MCC950作为NLRP3抑制剂治疗相关疾病已在多项研究中得到证实,MCC950与NLRP3特征性结合后通过影响后者翻译后修饰过程,从而影响后者的活化,继而阻断NLRP3介导的炎症通路[15-16]。目前,MCC950已在治疗动脉粥样硬化[17]、缺血再灌注损伤[18]及多种炎症疾病的动物模型中得到了积极的效果[19],但对COPD动物模型的治疗效果尚且缺乏相关研究,因此本研究探索了MCC950在COPD动物模型中的治疗效果。
本研究组织病理学分析结果证实COPD组大鼠支气管黏液分泌,炎症细胞和大鼠的细支气管壁厚度、管壁面积、管壁面积和腔周长增加,而MCC950处理后COPD呼吸道相关炎症表现及组织损伤得到显著缓解。MMP-2/TIMP-2、MMP-9/TIMP-1是COPD潜在生物学标志物,COPD患者其血清水平升高[20-23]。TNF-α、IL-6作为炎症反应关键效应分子,也参与COPD的病程进展,在COPD急性加重期发挥重要作用[24-25]。本研究结果提示COPD组大鼠血清气管重塑相关因子MMP-2、MMP-9、TNF-α、IL-6水平升高,TIMP-1、TIMP-2水平降低,而MCC950处理后,以上指标得到逆转。既往研究证实COPD患者中,高浓度的痰液和血液嗜酸性粒细胞计数与特定的临床表型有关[26]。在稳定期和加重期COPD患者中,约40%患者观察到嗜酸性气管炎症,约28%加重期患者发现痰嗜酸性气管炎症[27]。因此,嗜酸性粒细胞炎症被认为是COPD患者的特征。在一项随机、平行组研究中[28],血液嗜酸性粒细胞计数≥ 2%,即细胞接近于≥ 150个/μL,与COPD加重有关;在初级保健机构中约50% COPD患者的细胞计数持续≥150个/μL。本研究发现,与COPD组比较,MCC950组大鼠静脉血嗜酸性粒细胞水平降低。这一结果再次佐证抑制NLRP3可有效缓解COPD大鼠肺组织损伤。
本研究首次证实,MCC950通过下调NLRP3炎症小体可有效缓解COPD大鼠模型气管重塑、肺组织损伤并改善相关细胞因子及嗜酸性粒细胞血清学水平,提示MCC950可作为未来治疗COPD的潜在药物,为其后续作为COPD药物的研发提供了理论依据。本研究作为探索性研究尚存在一些不足,既往研究表明COPD还存在多种炎症细胞因子参与,如IL-8、LTB4、PGE2、sTREM-1、suPAR、sICAM-1等[29-30]。但本研究尚未关注以上细胞因子在COPD大鼠模型及MCC950处理下的改变,后续研究可进一步关注和探索。

