下半身充气保温在胸腔镜肺癌根治术患者中的应用效果观察
耿陈玲,丁胜光,李培培,田 婷
(南通大学第二附属医院手术室,江苏 南通 226001)
胸腔镜肺癌根治术是指利用电视胸腔镜及手术器械完成的一种肺癌微创治疗手术。因麻醉药物、气腹建立、术中输液及冲洗等各种因素的影响,极易发生低体温并发症[1]。低体温可致机体应激反应、凝血功能异常、循环功能紊乱,影响手术顺利进行及术后康复效果[2]。充气式保温毯是经循证医学证实的安全有效的一种术中保温方式,包括全身身下加温、上半身加温、下半身加温3种方式[4]。不同加温方式(特别是上半身加温与下半身加温)保温效果仍存在争议[3]。免疫抑制是所有手术患者无法规避的事实,维持机体核心体温的相对稳定是所有手术关注的焦点,也是预防术中免疫抑制的前提[4]。本研究探讨下半身充气保温对胸腔镜肺癌根治术患者核心体温及细胞免疫功能的影响,现报道如下。
1 资料与方法
1.1 一般资料2020年3月至2022年10月我院拟行胸腔镜肺癌根治术患者83例,纳入标准:①符合《中华医学会肺癌临床诊疗指南(2018版)》[5]原发性肺癌诊断标准;②有明确手术指征且行胸腔镜根治术治疗者;③ASA分级Ⅱ~Ⅲ级;TNM分期Ⅰ~Ⅱ期;④术前体温正常;⑤患者均签署知情同意书。排除免疫性疾病或代谢性疾病者、听力及视力障碍者。按照随机数字表法分为观察组(42例)与对照组(41例),两组患者一般资料比较,差异无统计学意义(P>0.05)。见表1。本研究经南通大学第二附属医院伦理委员会批准(20200120)。
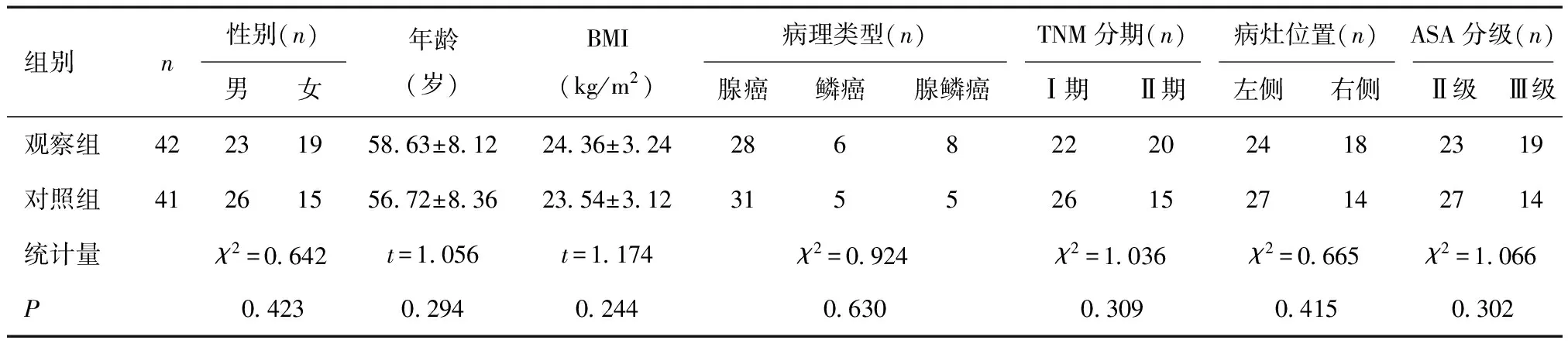
表1 两组肺癌根治术患者一般资料比较
1.2 方法
1.2.1麻醉方法 ①术前禁食(12 h)、禁饮(8 h)。入室后开放静脉通路,面罩吸氧(氧流量4 L/min)。常规监测血压(BP)、心率(HR)、血氧饱和度(SaO2)、脑电双频指数(BIS)、核心体温(T)。② 均采用静-吸复合全身麻醉。麻醉诱导:静脉注射0.05 mg/kg咪达唑仑、1.0~2.0 mg/kg丙泊酚、0.3-0.5 μg/kg舒芬太尼、0.15~0.20 mg/kg顺苯磺酸阿曲库铵。双腔支气管插管,连接麻醉机行机械通气(潮气量6~8 ml/kg,呼吸频率10~12 次/分钟)。③ 麻醉维持:持续泵注丙泊酚4~6 mg/(kg·h)、瑞芬太尼0.1~0.2 g/(kg·min),间断吸入七氟醚(2%~3%)、2 mg/kg顺苯磺酸阿曲库铵,维持BIS值(40~60)、BP(基础值±20%)。
1.2.2保温干预 ①两组均给予常规手术室保温措施。控制手术室温度(22~24 ℃),湿度(40%~60%)。加热手术床垫(40 ℃左右)。输入液体或血液制品加湿预热至(36~38 ℃),腹腔冲洗液加湿预热至(38~40 ℃)。② 对照组:使用充气式保温毯覆盖上半身,包括枕部、背部、手臂,注意避开手术区域,毯子缠绕于手臂上。加温仪温度控制38 ℃,加温时间从入室侧卧至手术结束。若术中核心体温<36 ℃,设定加温仪温度43 ℃;若术中核心体温>37.5 ℃,则停止加温。③ 观察组:使用充气式保温毯覆盖下半身,包括覆盖髂嵴和足部之间。加温时间与加温方法同对照组。使用无菌敷料覆盖术中其他裸露部位,术后覆盖手术室棉被保温。
1.3 观察指标①核心体温:麻醉诱导前(T0),麻醉诱导后30 min(T1)、60 min(T2)、90 min(T3)、120 min(T4)、术毕(T5),采用IRT6520耳温枪(德国博朗)测量患者鼓膜温度。②细胞免疫功能:T0、T5,采用XL/XL-MCL流式细胞仪检测CD3+、CD4+、CD8+,计算CD4+/CD8+。③并发症:包括寒颤、恶心呕吐、低氧血症、躁动等。
1.4 统计学方法应用SPSS 20.0统计学软件进行数据分析。计量资料以均数±标准差表示,两组比较采用t检验或重复测量方差分析;计数资料以例数(%)表示,比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组不同时点核心体温比较两组T1、T2、T3、T4、T5时核心体温均低于本组T0时(P<0.05),且观察组T2、T3、T4、T5时核心体温均高于对照组,差异有统计学意义(P<0.05)。见表2。
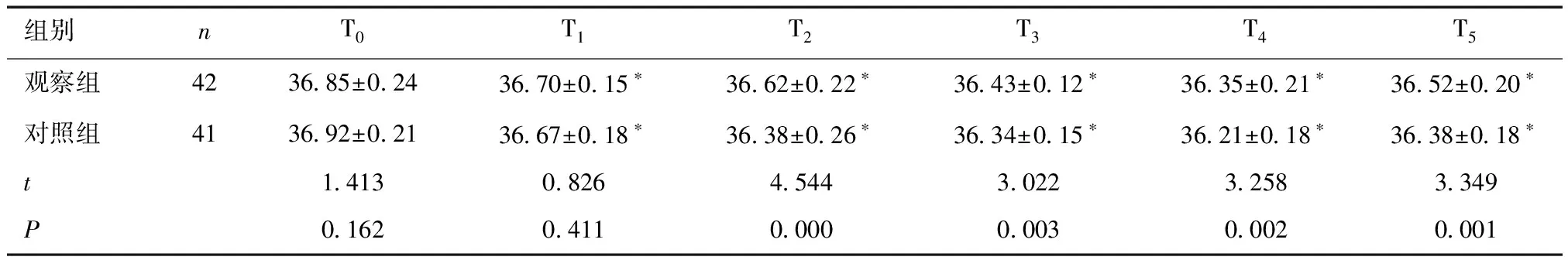
表2 两组患者不同时点核心体温比较 (℃)
2.2 两组不同时点细胞免疫功能比较两组T5时CD3+、CD4+、CD4+/CD8+低于T0时,CD8+高于T0时(P<0.05),且观察组T5时CD3+、CD4+、CD4+/CD8+高于对照组,CD8+低于对照组,差异有统计学意义(P<0.05)。见表3。
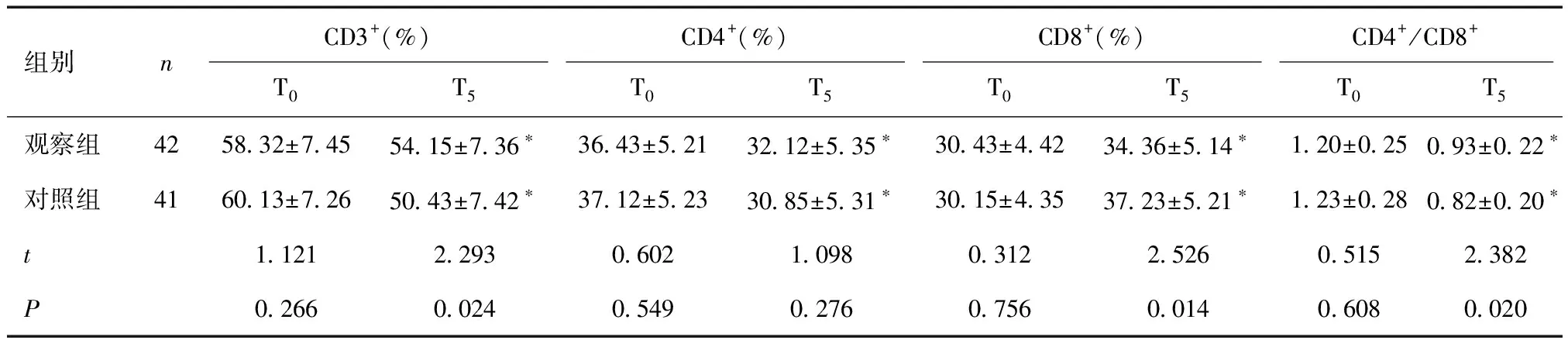
表3 两组肺癌根治术患者不同时点细胞免疫功能比较
2.3 两组并发症比较观察组寒颤及并发症总体发生率低于对照组,差异有统计学意义(P<0.05)。见表4。
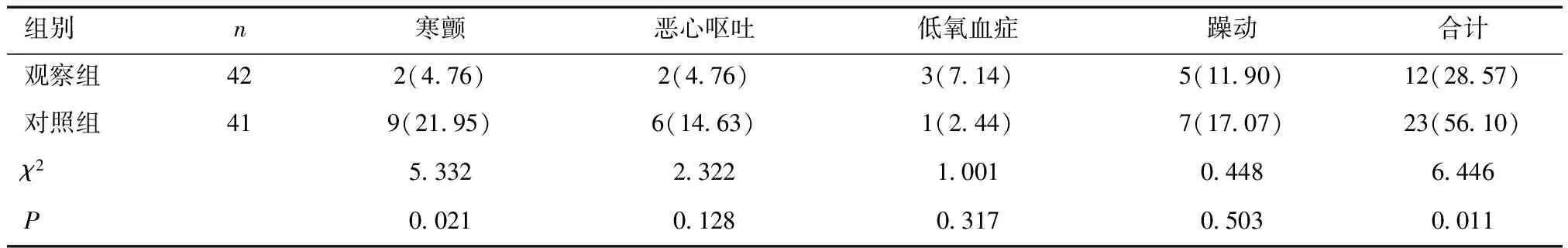
表4 两组患者并发症比较 [n(%)]
3 讨论
我国2020年新增肺癌超过81万,占新确诊癌症患者的17.9%[6]。因创伤小、恢复快、并发症低等优点,胸腔镜肺癌根治术一直被视为治疗早期肺癌(Ⅰ~Ⅱ期)的首选术式。低体温是围术期无法规避的现象,发生率为39.9%~85%[7]。围术期低体温的发生也是导致术后寒颤、切口感染、麻醉苏醒延迟、甚至死亡的主要原因[8]。
手术室温度一般控制在22~24 ℃,手术室温度过高,有诱发细菌繁殖、增加术后感染的风险[9];也会致组织细胞脱水、切口愈合困难[10]。加温手术床垫(40 ℃)能够减少术中核心体温的流失,降低围术期低体温发生率[11]。输注室温下1个单位液体或血液制品会降低机制核心温度0.25 ℃,加温输注液体(冲洗液、输液)或限制性输液是预防术中核心体温降低的有效方法[12]。在手术患者保温干预中,复合保温效果明显优于单一保温。充气式保温毯也是一种强力空气加温毯,利用对流原理完成热量在体表传递,阻止体表及体内热量向外转移(或扩散),维持机体核心体温的相对稳定[13,14]。充气式保温毯的保温效果与加温设备功率、保温毯充盈效果、保温毯热量分布、保温毯覆盖方式有关[15]。这也是全身身下加温方式保温效果较差的主要原因。Zhang等[16]研究报道,上半身充气保温更能维持胸腔镜肺癌根治术患者核心体温的相对稳定,本文研究并不支持这一观点:①保温效果与充气式加温毯覆盖面积有关。下半身充气保温体表覆盖面积高达40%~45%,即使是侧卧位手术时,下半身保温体表覆盖面积也远高于上半身(26%~30%)[17]。②因受到手术操作及头架的影响,上半身加温毯也会受到挤压而不能完全充盈,削弱(或限制)了保温效果。③ 胸腔镜肺癌根治术需要连接机械通气,上半身覆盖保温毯也有部分与外界直接相通,会造成加温毯热量丢失[18]。本研究中,观察组(T2、T3、T4、T5)时核心体温均高于对照组,寒颤(4.76%)及并发症总体发生率(28.57%)低于对照组,说明下半身充气保温能够维持胸腔镜肺癌根治术患者围术期核心体温的相对稳定,减少寒颤等并发症的发生。
免疫抑制是所有手术患者的共同病理特征,任何一种手术创伤必须导致免疫(细胞免疫与体液免疫)功能受损[19]。相关研究表明,核心体温每降低1 ℃,人机体免疫降低会超过30%;核心体温每升高1 ℃,人机体免疫力会增加5~6倍[20]。可见维持围术期核心体温能够缓解机体免疫抑制现象,增强手术患者抗感染、促进术后康复的能力。周鸿志等[21]研究报道,下半身(双下肢或臀部)保温干预能缓解胸腔镜肺癌手术患者应激反应,维持围术期核心体温的相对稳定。藏丽等[22]研究发现,下半身覆盖(双侧髂前上棘连线以下部位)可通过调节白细胞介素(IL-2、IL-6、IL-10)水平,改善胃癌根治术患者(35例)免疫功能。本研究中,观察组(T5)时CD3+、CD4+、CD4+/CD8+高于对照组,CD8+低于对照组,同样说明下半身充气保温缓解胸腔镜肺癌根治术患者细胞免疫功能抑制程度。
综上,下半身充气保温应用于胸腔镜肺癌根治术患者中,能够维持围术期间核心体温的相对稳定,缓解细胞免疫功能抑制程度,减少术后寒颤等并发症的发生。本研究仅仅分析了在常规保温干预中,上半身充气保温与下半身充气保温的差异性,可以预见的是,上半身与下半身联合保温会给胸腔镜手术患者带来更好的临床收益,这也将是我们后期需要重点研究的地方。

