幽门螺杆菌感染与脑梗死的关系及其对血管内皮功能、氧化应激状态的影响
吴舒梅,苏增峰,张铁林
(1.安徽省合肥市第八人民医院,安徽 合肥 238000 ;2.安徽医科大学附属巢湖医院,安徽 巢湖 238000)
急性脑梗死(ACI)主要由血栓形成或动脉栓塞引起的局部脑组织血液循环障碍,该病起病急,进展快,患者预后差[1]。幽门螺杆菌(Hp)可引发消化道溃疡、胃癌等,目前已成为全球公共卫生问题,我国Hp感染率可达40%~90%[2]。有研究指出,心脑血管疾病的发生与致病菌感染密切相关[3]。ACI患者多为免疫力低下的中老年人,Hp感染风险较高。有报道显示脑卒中的发生可能与Hp感染史相关[4]。还有研究指出Hp感染可调节脑梗死患者血脂及相关炎性因子水平,介导动脉粥样硬化[5]。本研究探讨ACI与Hp感染对患者氧化应激反应及血管内皮功能的影响,以期为ACI合并Hp感染患者的临床诊疗提供参考,现报道如下。
1 资料与方法
1.1 一般资料选取2021年3月至2022年6月合肥市第八人民医院收治的92例初发性ACI患者(脑梗死组),纳入标准:①脑梗死组患者首次发病,经临床确诊且符合ACI诊断标准[6];②ACI发病时间<3 d,入院时神志清醒;③两组均行14C尿素呼气检测;④自愿参加本研究且签署知情同意书。排除标准:①既往接受Hp根除治疗者;②合并脑出血者;③合并免疫性疾病、恶性肿瘤者;④入院前1个月服用抗生素,影响相关指标分析者。选取同期92例健康体检者(对照组),男49例,女43例;年龄61~80岁[(70.82±7.11)岁];吸烟36例,嗜酒12例;无糖尿病、高血压。脑梗死组(包括大动脉粥样硬化型63例及小动脉闭塞型29例)男57例,女35例;年龄60~82岁[(71.65±6.32)岁];吸烟40例,嗜酒18例;伴有高血压37例,糖尿病10例。两组基线资料比较,差异无统计学意义(P>0.05),具有可比性。本研究符合赫尔辛基人体试验标准,经医院伦理委员会批准。
1.2 方法
1.2.1Hp感染检测 所有患者入院后均接受空腹14C尿素呼气检测,14C呼吸检测仪购自捷瑞泰医疗器械有限公司;要求患者首先对着集气袋吹气,而后服用14C胶囊25 min再吹气;感染严重程度以衰变数范围判定[7]:未感染(低于200 dpm),轻度(200~1500 dpm),重度(超过1500 dpm)。Hp感染分型测定采用免疫印迹实验(Hp免疫球蛋白G分型检测试剂盒购自上海酶联生物科技有限公司)。细胞毒性相关蛋白(CagA)及细胞空泡毒素A(VacA)阴性为Ⅱ型感染,反之为Ⅰ型感染。
1.2.2血液生化指标检测 入院后留取清晨外周静脉血,3500 r/min离心10 min,取上清备用。采用MOD-EL680酶标仪,以ELISA法测定血清肿瘤坏死因子-α(TNF-α)、血管内皮生长因子(VEGF)、内皮素-1(ET-1)、一氧化氮(NO)、超氧化物歧化酶(SOD)、丙二醛(MDA)及谷胱甘肽过氧化物酶(GSH-Px)水平,速率散射比浊法测定超敏C反应蛋白(hs-CRP),免疫比浊法测定同型半胱氨酸(Hcy)水平。
1.3 观察指标①脑梗死组与对照组Hp感染情况;②脑梗死组不同Hp感染严重程度患者的血管内皮功能指标、氧化应激指标及血清炎性因子水平。
1.4 统计学方法应用SPSS 20.0统计学软件进行数据处理。计量资料以均数±标准差表示,三组间比较采用方差分析;计数资料以例数(%)表示,比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组Hp感染情况比较脑梗死组Hp重度感染率高于健康对照组(P<0.05);两组轻度Hp感染发生率及Hp感染类型比较差异无统计学意义(P>0.05)。见表1。
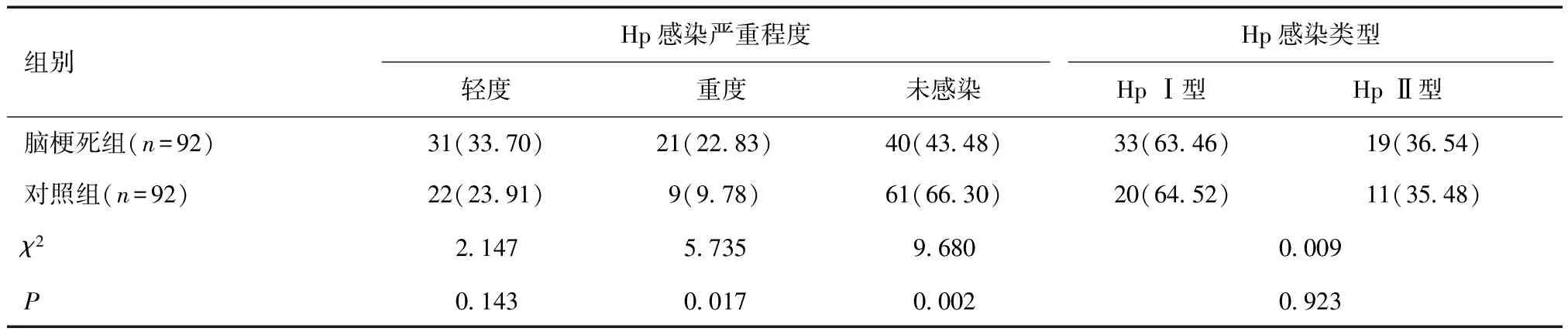
表1 两组Hp感染情况比较 [n(%)]
2.2 不同类型脑梗死患者Hp感染程度比较本组92例脑梗死患者中小动脉闭塞型组感染9例,低于大动脉粥样硬化型组的43例(P<0.05);两组感染严重程度比较差异无统计学意义(P>0.05)。见表2。

表2 不同类型脑梗死患者Hp感染程度比较 [n(%)]
2.3 脑梗死组不同Hp感染严重程度患者血管内皮功能指标比较不同Hp感染严重程度患者NO、VEGF水平比较:重度组<轻度组<未感染组(P<0.05);ET-1水平比较:重度组>轻度组>未感染组(P<0.05)。见表3。

表3 脑梗死组不同Hp感染严重程度患者血管内皮功能指标比较
2.4 脑梗死组不同Hp感染严重程度患者氧化应激指标比较不同Hp感染严重程度患者SOD、GSH-Px水平比较:重度组<轻度组<未感染组(P<0.05);MDA水平比较:重度组>轻度组>未感染组(P<0.05)。见表4。

表4 脑梗死组不同Hp感染严重程度患者氧化应激指标比较
2.5 脑梗死组不同Hp感染严重程度患者血清炎性因子指标比较不同Hp感染严重程度患者血清TNF-α、hs-CRP、Hcy水平比较:重度组>轻度组>未感染组,差异有统计学意义(P<0.05)。见表5。

表5 脑梗死组不同Hp感染严重程度患者血清炎性因子指标比较
3 讨论
临床约60%的老年ACI患者出现遗留性残疾[8]。报道称Hp感染可能是参与动脉粥样硬化的调控,如Keikha等[9]报道肺炎杆菌、Hp及结核分枝杆菌感染与缺血性脑卒中的发生显著相关;近期国内一项相关性研究指出,Hp感染可能是60岁以下女性颅内动脉粥样硬化的重要独立危险因素[10]。本研究显示脑梗死组的Hp总感染率及重症感染率明显高于对照组。提示Hp感染与ACI关系密切,相互影响[11]。进一步分析Hp感染与ACI发病类型的关系,发现大动脉粥样硬化型组的感染率更高,这与Hp感染与动脉粥样硬化相关的观点相符。
ACI患者由于脑组织供血不足,增加氧化自由基形成,损伤血管内皮功能。ET-1是可强烈收缩血管,造成周身血压升高的活性多肽。通常状态下,机体NO、ET-1水平较为稳定,当脑梗死发生时NO水平明显降低,ET-1水平异常升高[12]。NO可舒张血管,抑制血小板聚集。VEGF可增强血管通透性,调节内皮细胞活性。本研究中根据Hp感染程度将脑梗死组患者分为轻度、中度及重度组,三组NO、VEGF水平比较:重度组<轻度组<未感染组;三组ET-1水平比较:重度组>轻度组>未感染组。这是由于Hp定植于上皮细胞带来的慢性持续性感染可刺激机体炎性因子的释放,募集白细胞及单核细胞加剧血管内皮功能损伤;同时Hp感染产生的脂代谢紊乱,可增加血液黏稠度,促进动脉粥样硬化,进一步损伤血管[13]。有报道指出Hp感染可通过外泌体作用损伤患者及小鼠的内皮功能[14]。相关体外实验显示Hp的CagA可激活内皮细胞中信号转导子与激活子3(STAT3)信号,加速炎性反应[15]。
本研究中SOD、GSH-Px水平:重度组<轻度组<未感染组,MDA水平:重度组>轻度组>未感染组。说明Hp感染严重程度与ACI患者氧化应激反应强度相关。陈菊华等[16]选取106例ACI患者,发现鲍曼不动杆菌、铜绿假单胞菌、酿脓链球菌等病原菌感染可加剧患者氧化损伤。Hagag等[17]研究证明Hp感染患者的血清NO、谷胱甘肽水平低于对照组,MDA、过氧化氢酶水平高于对照组。本研究还就患者的血清炎性因子水平进行探究,TNF-α是早期炎性因子,可扩大炎症级联反应,促进脑梗死进展[18]。Hcy是含硫氨基酸的代谢中间产物,其血清水平升高与血管壁炎症、血栓形成有关[19]。hs-CRP属于急性损伤蛋白,参与动脉粥样硬化的发生及演变[20]。本研究中重度组、轻度组及未感染组患者入院时的血清TNF-α、hs-CRP、Hcy水平比较:重度组>轻度组>未感染组,提示Hp感染可增强脑梗死患者的炎性反应,促进疾病进展,这与目前主流研究结论相符[21]。
综上,Hp感染不仅可提高ACI患者的血清炎性因子水平,还可增强患者血管内皮损伤及氧化应激状态。临床治疗时动态监测患者相关指标水平有利于ACI病情的评估及降低Hp感染率,改善患者预后。

