1b型慢性丙型肝炎患者血清巨噬细胞抑制因子-1水平升高临床价值分析
宋洁 聂虹 迟卉 郭瑞芳
文献报道,病毒载量、病毒基因及宿主因素与HCV感染的预后有关[1,2]。MIC-1属于TGF-β超家族的成员,MIC-1编码蛋白对macrophages等细胞活性产生抑制作用,在心血管疾病、恶性肿瘤等疾病状态下大幅增加,血清MIC-1在各肝病状态中显著升高[3-5]。本研究探讨血清MIC-1水平对基因1b型CHC的影响。
资料与方法
一、研究对象
2016年1月至2019年3月内蒙古自治区医院收治的1b型CHC患者84例。纳入标准:18~70岁;病程>6个月或相应流行病学史;抗HCV、HCV DNA阳性;未接受抗病毒治疗。排除标准:其他嗜肝性病毒感染;HIV感染、甲状腺疾病、恶性肿瘤或血液系统疾病等。
二、检测方法
采用LH-750型血细胞分析仪(Beckman Coulter,美国)检测血细胞;TBA-120FR型生化分析仪(Toshiba,日本)检测血生化指标;StepOne PCR(艾康生物有限公司,杭州)检测HCV RNA;Maglumi 2000化学发光仪(新产业生物医学公司,深圳)检测Ⅲ型前胶原N端肽(PⅢNP)、Ⅳ型胶原(C-Ⅳ),正常参考范围:PⅢNP 0.5~30 ng/mL;C-Ⅳ 5~30 ng/mL;CLARIOstar型酶联免疫检测仪(BMG,德国)遵照双抗体夹心法以及对应试剂盒检测血清MIC-1水平。
三、治疗方法
聚乙二醇干扰素(派罗欣,罗氏制药公司,上海)+利巴韦林(美达康制药公司,四川)联合治疗,使用剂量、治疗时间参照文献[6]。治疗结束时评价病毒学应答情况。
四、统计学方法
应用SPSS 22.0软件进行统计分析。偏态分布的计量资料以[M(P25,P75)]表示,比较采用Kruskal-WallisH检验,计数资料以例(%)表示,采用卡方检验;多因素分析影响1b型CHC患者应答状态的独立危险因素。P<0.05为差异有统计学意义。
结 果
一、病毒学应答结果
84例1b型CHC患者中,病毒学应答61例、未应答23例。应答组年龄显著高于未应答组(P<0.05),应答组男性占55.7%(34/61),未应答组为56.5%(13/23)(χ2=0.004,P=0.949);与未应答患者比,应答组ALT、AST、PⅢNP、C-Ⅳ及MIC-1均显著降低(P<0.05),见表1。
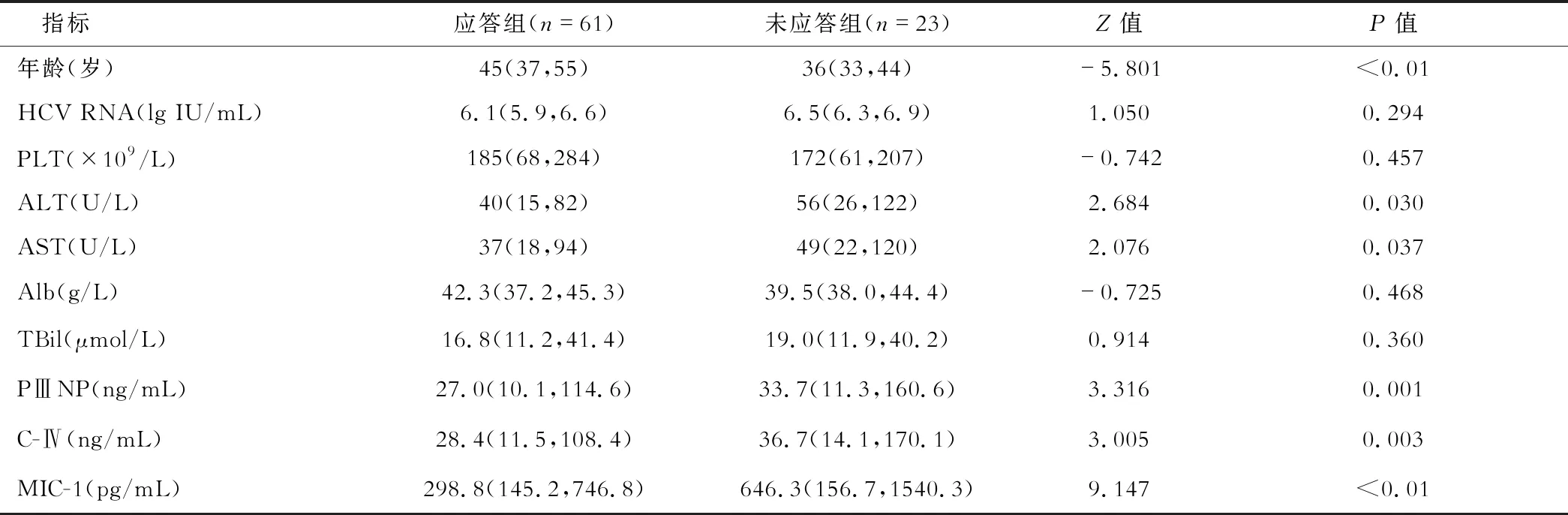
表1 不同病毒学应答1b型CHC患者资料比较[M(P25, P75)]
二、治疗前后MIC-1比较
治疗前84例1b型CHC患者MIC-1为714.8(171.0,1582.1)pg/mL,高于治疗后的365.0(159.9,1004.0)pg/mL(P<0.05)。应答组治疗前MIC-1为720.4(184.7,1570.1)pg/mL,高于治疗后的298.8(145.2,746.8)pg/mL(P<0.05);而未应答组治疗前后MIC-1为710.9(161.2,1532.7)pg/mL比646.3(156.7,1540.3)pg/mL,差异无统计学意义(P>0.05)。
三、多因素分析
以1b型CHC患者病毒学应答状态为因变量,对上述P<0.05的资料(年龄、ALT、AST、PⅢNP、C-Ⅳ及MIC-1)进行多因素分析,结果显示MIC-1[HR=5.31,95%CI: 2.74~11.52,P=0.008]为影响1b型CHC患者应答状态的独立危险因素。
讨 论
MIC-1从活化巨噬细胞中克隆出来,主要参与机体器官生长、分化及发育。当肝脏实质受损时,MIC-1水平显著增加,如肝硬化、肝细胞癌中MIC-1水平明显高于邻近正常肝组织及癌旁组织[7,8]。MIC-1通过改变宿主肝细胞的信号转导和生长来促进HCV复制,并与HCV诱导的原发性肝细胞癌的发生密切相关[9]。有研究发现CHC患者血清MIC-1水平明显高于正常人群[10]。多项研究报道,聚乙二醇干扰素+利巴韦林方案病毒学应答程度较低,因而对影响病毒学应答相关因素的研究是有意义的。
本研究表明,应答组血清MIC-1水平低于未应答组,推测MIC-1可能参与HCV复制,促使肝细胞损伤、肝纤维化程度加剧,MIC-1浓度升高可能是HCV感染的潜在标志物。进一步分析抗病毒治疗前后的MIC-1水平,应答组治疗前后MIC-1差异有统计学意义,而未应答组无类似结果。多因素分析发现,血清MIC-1是1b型CHC患者应答状态的独立危险因素。
本研究纳入的1b型CHC患者接受标准治疗方案后,病毒应答率仅为72.6%,与之前的研究结果相似[11]。近年来直接抗病毒药物被用于治疗CHC,发现RVR、ETVR及SVR病毒学应答率均较高(>85%)[12]。有研究应用艾尔巴韦/格拉瑞韦治疗结束后12周、24周,病毒学应答率可高达99%左右[13]。抗病毒药物的革新将有助于减少相关不良事件发生,改善CHB临床结局。
利益冲突声明:所有作者均声明不存在利益冲突。