太行菊黄酮对α-葡萄糖苷酶活性的抑制作用
陈建中,葛水莲*,2,杨明建,昝立峰,刘 娜
(1. 邯郸学院 生命科学与工程学院,河北 邯郸 056005;2. 邯郸学院 河北省高校冀南太行山区资源植物应用技术研发中心,河北 邯郸 056005;3. 衡水学院 化工学院,河北 衡水 053000)
国际糖尿病联盟于2017 年公布了第8 版的全球糖尿病地图,数据显示全球糖尿病患者 (20~79岁)已超过4.25 亿[1],糖尿病已成为一个全球性的公共健康问题,中国以高达1.14 亿的糖尿病患者数量位居全球第一位[2-3]。 糖尿病对人体危害极大,但至今缺乏依从性高、长效[4]且安全[5]的治疗方法,所以近年来安全有效的降糖物质天然黄酮备受国内外学者高度关注,但天然黄酮来源不同其成分与功效截然不同[6]。 蔡红蝶等发现当黄蜀葵花中二氢黄酮质量浓度提高到20 μg/mL 时,可以增加肝糖摄取量30%~40%[7]。作为α-糖苷酶抑制剂的刺槐素可抑制细胞中多糖的水解反应[8]。 给糖尿病大鼠按照每千克体质量50 mg 的剂量标准注射二氢黄酮紫杉叶3-O 鼠李甲基酸酯[9],可减少食物摄入量,促进胰岛素分泌,通过借助钾离子通道转运,提高糖原合酶和糖原磷酸化酶水平,促进糖原合成,但其对正常大鼠的影响非常小。 芦丁可促进体内胰岛素的分泌,增强骨骼肌或肝脏细胞摄取葡萄糖[10],并降低糖尿病大鼠的血糖水平[11]。 过氧化物酶体增殖物激活受体拮抗剂香叶木素[12]和刺槐素[13]能显著提高胰岛素的敏感性,对STZ 糖尿病大鼠有明显降糖作用。
α-葡萄糖苷酶(α-glucosidase,AG)可催化低聚糖水解释放出葡萄糖。 而α-葡萄糖苷酶抑制剂(αglucosidase inhibitors,AGI)具有保护胰岛细胞功能,可有效降低餐后血糖和改善多种糖尿病并发症。 其药效主要发挥在阻断低聚糖水解释放葡萄糖途径抑、抑制α-葡萄糖苷酶活性和减缓肠道对葡萄糖吸收过程3 个方面,目前已成为治疗2 型糖尿病的首选药物。 虽然临床实践中已有伏格列波糖、米格列醇和阿卡波糖等药物,但这几种的α-葡萄糖苷酶抑制剂均是源自微生物发酵,由AGI 前体经生化合成修饰而得,因而普遍存在对糖类物质不完全分解导致的胃肠道反应剧烈和细胞耐药性增强等问题[14]。因此从天然产物中筛选安全、新颖、有效的AGI 已成为预防和治疗糖尿病的研究热点。
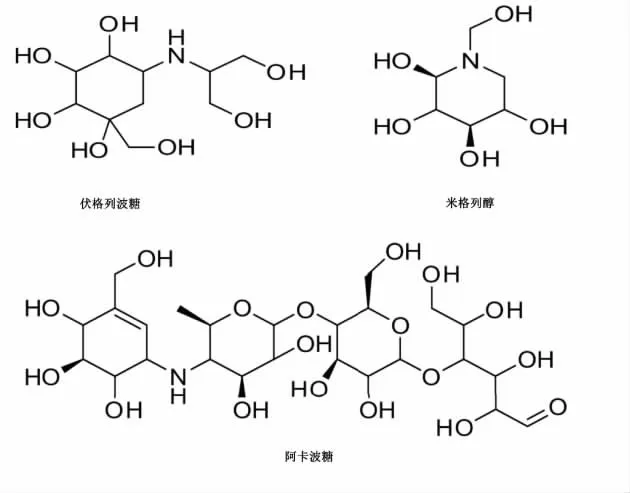
图1 AGI 的化学结构Fig. 1 Chemical structures of AGI
太行菊(Opisthopappus taihangensis)是中国特有珍稀物种,丛生于海拔1 000 m 的峭壁之上,多耐荫耐寒耐旱,主要分布于豫、晋、冀三省太行山南麓。 太行菊全株香气浓郁富含芳香油,干燥后香味持久,太行菊花经水蒸阴干后具有清肝明目和清热润喉的功效,作为药食兼用的野生植物资源极具开发价值。目前国内对太行菊醇提黄酮对α-葡萄糖苷酶抑制活性的研究尚未见报道。 作者以太行菊为研究对象,采用α-葡萄糖苷酶体外筛选模型,对比太行菊醇提物不同极性萃取相黄酮的α-葡萄糖苷酶抑制活性,分析酶促抑制反应动力学特征,为太行菊黄酮深入研发成为降血糖的药品或保健品提供药理基础。
1 材料与方法
1.1 实验材料及试剂
野生种长裂太行菊:取材于冀南山区的河北涉县偏城镇和合漳乡。 太行菊又称“野菊花”,花期4个月,在五月份开花前收集其地上部分,采集时选取株高4~10 cm 为宜。 采后太行菊全株洗净,于60℃鼓风干燥箱中烘干至恒质量,粉碎后过60 目筛备 用;α -glucosidase 和 p -nitrophenyl -α -D -galactopyranoside:Sigma 公 司 ;PNP ≥99.5% 、Acarbose≥99.5%和DMSO:Macklin 公司。
1.2 不同极性萃取相太行菊黄酮的样品制备
精确称取干燥太行菊粉末1 kg,按1 g∶10 mL料液比加70%体积分数乙醇超声,50 ℃浸提60 min,提取3 次后合并滤液并过滤,使用旋转蒸发仪浓缩即得太行菊醇提物浸膏。 混悬液按照1∶5 体积比加入蒸馏水制得,依照石油醚、乙酸乙酯、正丁醇顺序萃取,每相萃取3 次,旋转蒸发仪浓缩后可得到太行菊醇提物的石油醚相、乙酸乙酯相和正丁醇相,均置于4 ℃冷藏备用[15]。
1.3 太行菊黄酮质量浓度的测定
绘制太行菊黄酮标准曲线[16],根据实验数据得到吸光度和黄酮质量浓度的回归方程:Y=0.048 7X+0.000 4,方程回归线性良好(R2=0.999 5)。 太行菊黄酮浓度测定:吸取供试样液1 mL,加入体积分数70%乙醇定容至5 mL,加质量分数5%的NaNO20.3 mL,摇匀后静置10 min;加入质量分数10%的Al(NO3)30.3 mL ,摇匀静置10 min;加入质量分数4%的NaOH 4 mL ,最后定容至l0 mL,摇匀后静置20 min,测定待测样液吸光度,根据回归方程计算其对应的黄酮质量浓度。
1.4 不同极性萃取相太行菊黄酮对α-葡萄糖苷酶抑制作用
太行菊黄酮对α-葡萄糖苷酶活性抑制实验参考Liu 等[17],并稍做改动。 首先缓冲液(PBS)选用pH 6.8 浓度0.1 mol/L 的磷酸盐,配制0.5 mmol/L底物PNPG 溶液和0.04 U/mL α-葡萄糖苷酶溶液。取酶液40 μL 和样品40 μL 于试管中,水浴37 ℃加热5 min,加20 μL 底物PNPG 溶液,反应体系置于37 ℃水浴锅中处理30 min,终止反应试剂为50 μL 的0.2 mol/L Na2CO3溶液,室温(25 ℃)处理5 min 。酶标仪于405 nm 处测定吸光值Ax。反应体系不同处理组的反应配置见表1,设置阿卡波糖作为对照组,每个处理设置3 个重复,按式(1)计算抑制率IR。
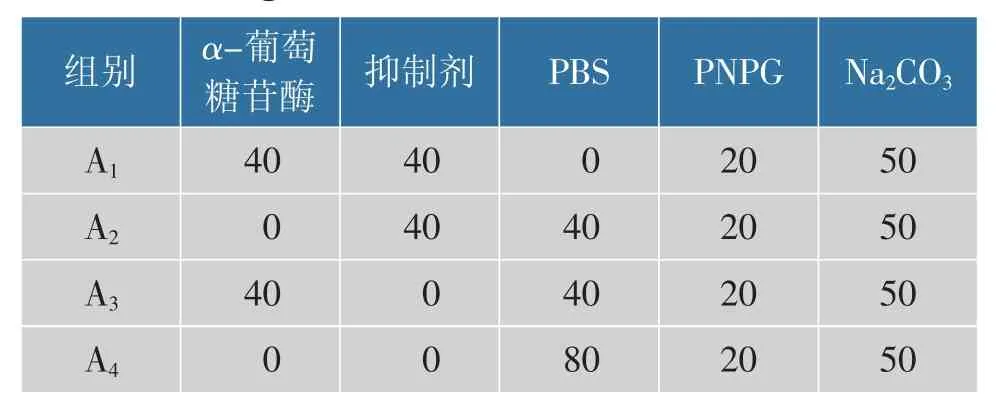
表1 α-葡萄糖苷酶活性抑制试验反应体系Table 1 Reaction system configuration for inhibiting α-glucosidase
式中:IR为抑制率,%;A1为样品组吸光度;A2为阳性对照组吸光度;A3为空白组吸光度;A4为空白对照组吸光度。
1.5 不同极性萃取相中太行菊黄酮对α-葡萄糖苷酶抑制动力学研究
酶动力学实验参照Zhu[18]方法并稍做修改。 底物PNPG 的浓度固定不变,调整α-葡萄糖苷酶的浓度和太行菊黄酮质量浓度:0、2、4、6 mg/mL,采用酶标仪于405 nm 处测定反应体系的吸光值,并计算酶反应速率V,单位mmol/(L·min)。 根据V 与[S] 之间的映射拟合回归曲线判断酶促抑制反应是否可逆。 α-葡萄糖苷酶浓度固定不变,选取太行菊不同极性萃取相的黄酮作为抑制剂,测定底物PNPG浓度下的α-葡萄糖苷酶的酶促反应速率。 最后以1/[S] 为横坐标,1/V 为纵坐标,将1/V 对1/[S] 进行Lineweaver-Burk 法回归作图分析,求得Km和Vmax,判定不同太行菊黄酮对α-葡萄糖苷酶活性的可逆抑制类型。 按式(2)和(3)计算Vmax和Km。
1.6 数据的统计分析
结果数据用x±s 表示,用SPSS 26.0 软件进行方差分析和多重比较,相关性分析采用pearson 法,P<0.01 为差异极显著,P<0.05 为差异显著。
2 结果与分析
2.1 不同极性萃取相太行菊黄酮对α-葡萄糖苷酶抑制活性
将太行菊醇提取物的不同极性萃取相分别浓缩成浸膏,测定各浸膏的黄酮质量分数,结果见表2。 太行菊醇提取物在不同极性萃取相中的黄酮质量分数差异较大,其中乙酸乙酯相和正丁醇相中的黄酮质量分数分别为(83.46±1.24) mg/g 和(56.73±1.01) mg/g,均显著高于其他萃取相(P<0.05);且石油醚相和残余水相中的黄酮质量分数较少,分别为(4.15±0.21) mg/g 和(2.02±0.09) mg/g,两相之间差异不显著(P>0.05)。 由于太行菊黄酮的极性与乙酸乙酯及正丁醇相似,所以萃取后太行菊黄酮主要富集在乙酸乙酯和正丁醇中。
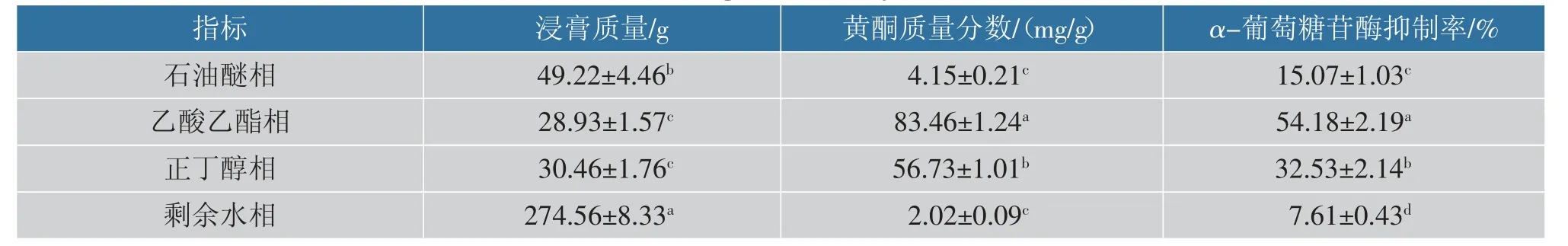
表2 太行菊黄酮在不同极性萃取相中对α-葡萄糖苷酶抑制活性Table 2 Inhibition rate of α-glucosidase by FOT in different solvents
将上述样品均复溶于无水乙醇,测定各萃取相中太行菊黄酮对α-葡萄糖苷酶的抑制作用。结果如表2,太行菊黄酮对α-葡萄糖苷酶活性强弱为:乙酸乙酯相>正丁醇相>残余水相>石油醚相 (P<0.05),而且乙酸乙酯相和正丁醇相中黄酮抑制活性显著高于残余水相和石油醚相中黄酮抑制活性(P<0.05)。 综上所述,太行菊黄酮在乙酸乙酯相和正丁醇相中对α-葡萄糖苷酶抑制活性均强于其他萃取相。
2.2 太行菊黄酮对α-葡萄糖苷酶抑制活性相关性分析
将α-葡萄糖苷酶抑制活性与太行菊不同极性萃取相的黄酮质量分数做相关性研究,结果显示见表3。 各萃取相黄酮质量分数与α-葡萄糖苷酶抑制活性呈正相关,其中乙酸乙酯相和正丁醇相的黄酮质量分数与α-葡萄糖苷酶抑制活性相关系数达到极显著水平(P<0.01),且残余水相和石油醚相的黄酮质量分数与α-葡萄糖苷酶抑制活性相关系数差异不显著(P>0.05)。因此可推测太行菊黄酮是对α-葡萄糖苷酶产生抑制作用的主要活性物质。

表3 太行菊黄酮在不同极性萃取相中对α-葡萄糖苷酶抑制活性相关性Table 3 Correlations between inhibition rate of α-glucosidase by FOT in different solvents
2.3 太行菊黄酮对α-葡萄糖苷酶抑制活性
作者测定了不同质量浓度的太行菊黄酮对α-葡萄糖苷酶抑制活性,太行菊不同极性萃取相黄酮对α-葡萄糖苷酶均显示出不同程度抑制作用,而且抑制效果与黄酮质量浓度之间呈现明显的剂量效应关系。 图2(a)中乙酸乙酯相和正丁醇相黄酮对α-葡萄糖苷酶的抑制效果高于阳性对照阿卡波糖,而图2(b)中残余水相和石油醚相中太行菊黄酮对α-葡萄糖苷酶的抑制效果低于阳性对照阿卡波糖。经过回归方程拟合可得乙酸乙酯(IC50=1.01 mg/mL)<正丁醇 (IC50=1.25 mg/mL)<阿卡波糖(IC50=1.47 mg/mL)<残余水相 (IC50=1.77 mg/mL)<石油醚(IC50=2.12 mg/mL)。
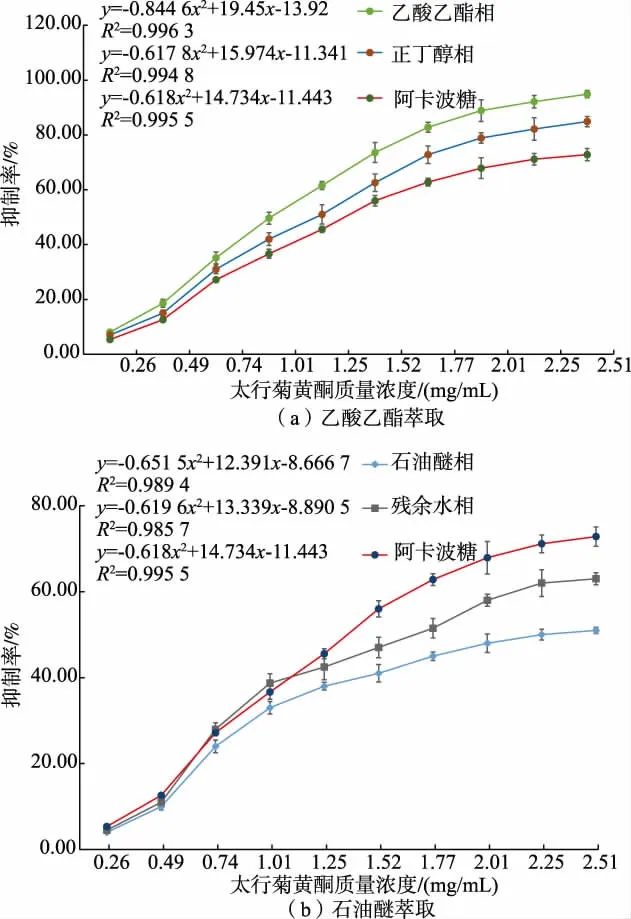
图2 太行菊黄酮对α-葡萄糖苷酶抑制曲线Fig. 2 Inhibition curve of α-glucosidase by FOT
2.4 太行菊黄酮对α-葡萄糖苷酶抑制作用类型
依据酶与抑制剂结合反应特点,抑制分为可逆与不可逆2 种类型。 当可逆抑制剂加入酶促反应体系中时,回归直线截距为0,且斜率随着抑制剂质量浓度增加而变小。 当不可逆抑制剂加入酶促体系时,回归直线截距不等于0[19]。 太行菊黄酮质量浓度对α-葡萄糖苷酶的抑制动力学曲线见图3,向酶促反应体系中添加(0、2、4、6 mg/mL)太行菊黄酮后得到4 条截距为0 的回归直线,且直线的斜率与黄酮质量浓度成反比。 据此,太行菊黄酮对α-葡萄糖苷酶的抑制类型属于可逆抑制。
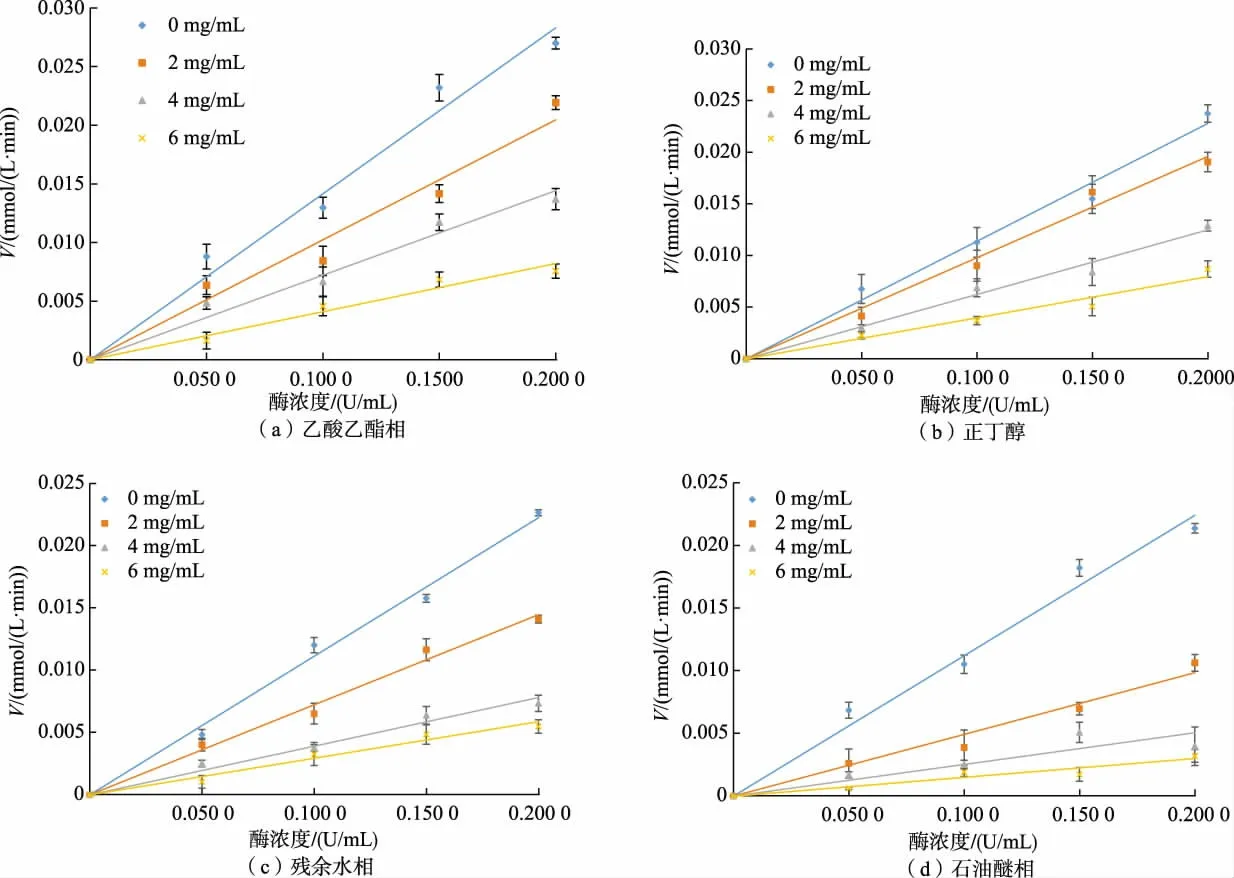
图3 太行菊黄酮对α-葡萄糖苷酶抑制作用类型Fig. 3 Kinetics curves of inhibition on α-glucosidase by FOT
2.5 太行菊黄酮对α-葡萄糖苷酶抑制作用动力学特征
可逆抑制酶促反应分为非竞争性、 竞争性、反竞争性和混合型4 种类型。 混合类型有竞争与非竞争的混合型、 竞争与反竞争的混合型2 种。 如图4所示,当α-葡萄糖苷酶浓度固定不变,而调整反应体系中太行菊黄酮和PNPG 的质量浓度,测定酶促抑制体系反应速率V,依据Lineweaver-Burk 法绘制V 对[S] 的双倒数曲线。
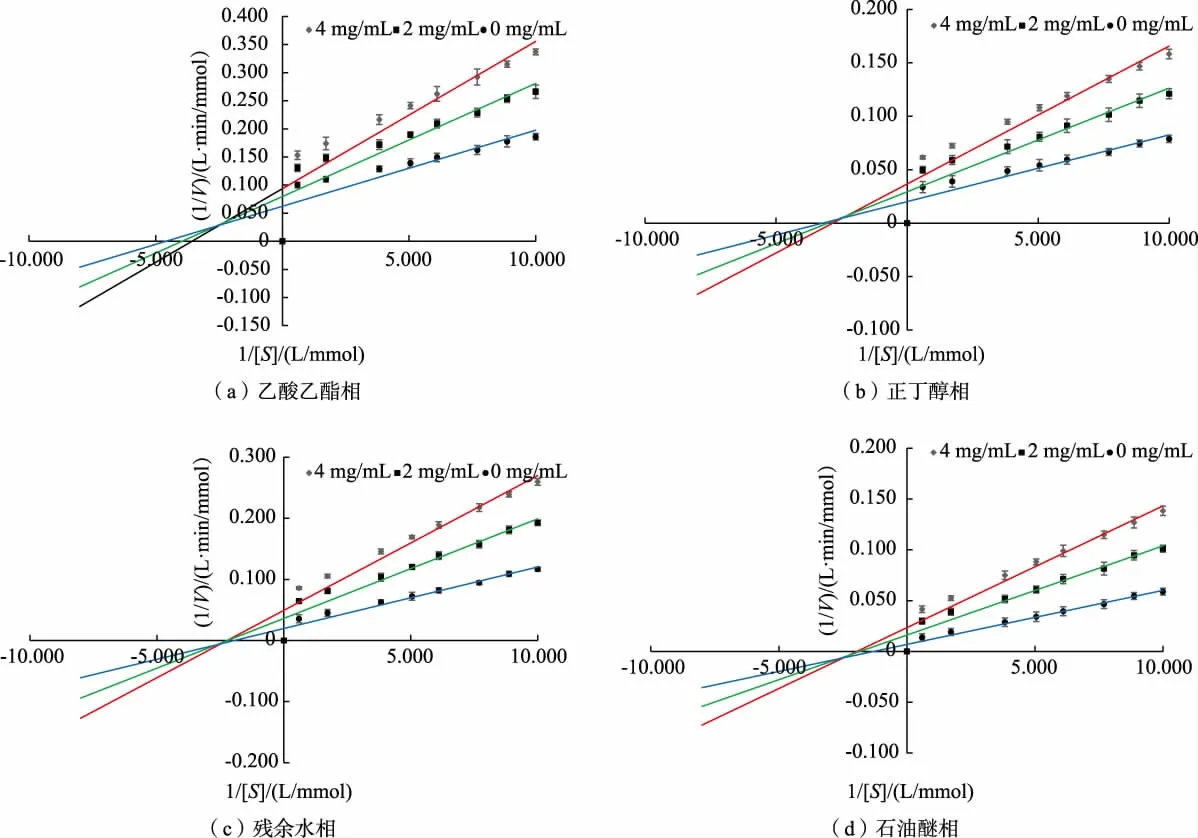
图4 太行菊黄酮对α-葡萄糖苷酶抑制作用Lineweaver-Burk 动力学曲线Fig. 4 Lineweaver-Burk curve of inhibition of α-glucosidase by FOT
由图4(a)和(b)酶促反应体系中添加不同质量浓度梯度太行菊黄酮时,乙酸乙酯相和正丁醇相反应方程直线与空白对照组直线于第二象限相交,随着太行菊黄酮质量浓度的增加,Km逐渐升高,而Vmax却在逐渐降低,这种变化趋势特征是混合抑制类型中竞争与非竞争的关系,即正丁醇相和乙酸乙酯相中太行菊黄酮对α-葡萄糖苷酶是竞争与非竞争的混合抑制类型。 酶促体系中添加不同质量浓度梯度太行菊黄酮时,残余水相(图4(c))和石油醚相(d) 反应方程直线与空白组直线于第三象限相交,随着太行菊黄酮质量浓度的增加,Km和Vmax都逐渐降低(表4),这种变化趋势特征符合混合抑制中竞争与反竞争的关系[20],即残余水相和石油醚相中太行菊黄酮对α-葡萄糖苷酶是竞争与反竞争的混合抑制类型。由于太行菊黄酮与α-葡萄糖苷酶二者结合位点的多样性,导致太行菊黄酮对α-葡萄糖苷酶的抑制类型的复杂性。
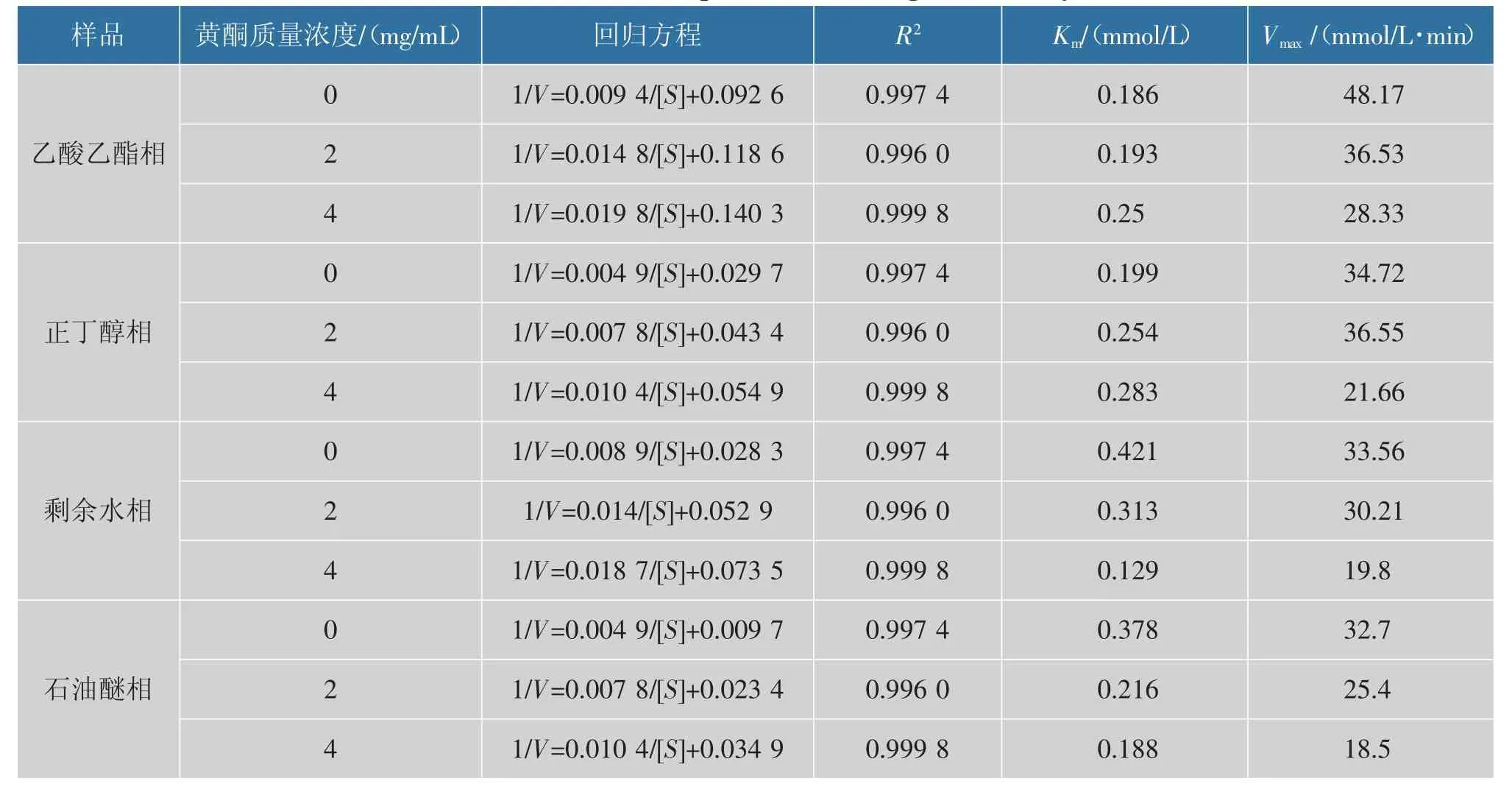
表4 太行菊黄酮对α-葡萄糖苷酶的抑制动力学回归方程参数Table 4 Kinetic inhibition parameters of α-glucosidase by FOT
依据Lineweaver-Burk 法绘制V 对[S] 的双倒数曲线,通过方程组联立计算太行菊黄酮对α-葡萄糖苷酶抑制反应体系中Km和Vmax,比较2 个关键参数的变化特征趋势,由此推断酶促反应可逆抑制类型,见表4。
3 结 语
作者采用体外筛选模型,考察太行菊醇提物的乙酸乙酯相、正丁醇相、残余水相和石油醚相中黄酮对α-葡萄糖苷酶的抑制活性,发现太行菊不同极性萃取相黄酮对α-葡萄糖苷酶均显示出不同程度抑制作用,而且抑制效果与黄酮质量浓度之间呈现明显的剂量效应关系。 其中由乙酸乙酯相和正丁醇相的黄酮质量分数对α-葡萄糖苷酶抑制活性均显著高于其他萃取相,高于阳性对照阿卡波糖,而残余水相和石油醚相中黄酮对α-葡萄糖苷酶的抑制效果低于阳性对照阿卡波糖。 经过回归方程拟合可得乙酸乙酯 (IC50=1.01 mg/mL)<正丁醇 (IC50=1.25 mg/mL)<阿卡波糖 (IC50=1.47 mg/mL)<残余水相(IC50=1.77 mg/mL)<石油醚(IC50=2.12 mg/mL)。 初步确定太行菊醇提物乙酸乙酯相和正丁醇相中太行菊黄酮为抑制α-葡萄糖苷酶活性的有效活性物质。通过酶抑制动力学实验分析太行菊黄酮抑制α-葡萄糖苷酶作用类型。 其中乙酸乙酯相和正丁醇相中太行菊黄酮对α-葡萄糖苷酶活性是竞争与非竞争的混合抑制类型。 残余水相和石油醚相中太行菊黄酮对α-葡萄糖苷酶活性是混合抑制类型中竞争与反竞争的关系。 综上所述,研发太行菊黄酮降血糖药品或保健品具有巨大的市场潜力,有望将乙酸乙酯相和正丁醇相太行菊黄酮开发为新型α-葡萄糖苷酶抑制剂。 但太行菊醇提物黄酮成分复杂,需要在单体分析鉴别的基础上进一步做药理药代的深入分析。本研究结果为太行菊黄酮抑制α-葡萄糖苷酶提供了科学依据,对于提升太行菊的附加值和太行菊食药资源的高效利用具有指导意义。

