基于 RORγt/FoxP3 免疫失衡探讨定喘汤对呼吸道合胞病毒诱导肺炎性损伤幼鼠免疫微环境的影响
张秀英,瞿圣岳,王雪峰,王 蕾,赵航宇
(1. 辽宁中医药大学附属医院,辽宁 沈阳 110032;2. 辽宁中医药大学研究生院,辽宁 沈阳 110032)
呼吸道合胞病毒(RSV)是婴儿急性呼吸道感染的一个重要和常见原因,也是婴儿住院的主要原因[1]。几乎所有儿童在2岁时都感染过RSV[2],RSV感染引起肺部炎性损伤可导致咳嗽、喘息,或毛细支气管炎,严重RSV诱导肺部炎性损伤可致坏死和上皮细胞脱落进入气道,气道黏液、水肿和细支气管周围炎症累积可导致气道阻塞[3-4]。 RSV诱导的肺部炎性损伤目前西医无特效治疗药物。临床研究显示,定喘汤能明显缩短毛细支气管炎患儿病程,缩短肺部体征消失时间[5];基础研究也显示定喘汤能降低RSV诱导肺部炎性损伤时肺组织的病毒载量[6],减轻肺组织损伤程度,但其机制尚不清晰。因此,本研究以转录因子孤核受体(RORγt)/叉头翼状螺旋转录因子3(FoxP3)免疫微环境失衡为切入点,通过观察RSV诱导幼鼠肺炎性损伤时肺组织RORγt/FoxP3基因和蛋白、肺泡灌洗液中抑炎因子和促炎因子的变化,探讨定喘汤对RSV诱导幼鼠肺炎性损伤免疫微环境的调节作用,阐明其作用机制。
1 实验材料与方法
1.1病毒 RSV-long株来源于首都儿科研究所,冻存于辽宁中医药大学附属医院病毒室,半数组织培养感染量为10-3。
1.2实验动物 3周龄雄性SD大鼠18只,体重50~70 g,购于辽宁长生生物有限公司,合格证号(许可证号):SYXK(辽)2021-0001。幼鼠置于无病原体清洁笼内饲养,保持室温(20±2)℃,饲料和饮用水经高温高压消毒,每日自由饮食。本研究符合实验动物保护各项要求,已获得辽宁中医药大学动物伦理委员会的批准(21000042022038)。
1.3实验药物 定喘汤由麻黄9 g、杏仁9 g、半夏9 g、苏子6 g、黄芩12 g、桑白皮9 g、白果9 g、款冬花9 g、甘草3 g组成,药物均购自辽宁中医药大学附属医院中药局,按照传统方法水煎2次混合后,制成含生药2 g/mL的药液备用。
1.4试剂及仪器 超纯水系统(NW10LVF,Heal)、超速冷冻离心机(H-2050R,湖南湘仪)、微量移液器(Proline、BIOHIT)、真空干燥箱(DZF-6050,SYSBERY)、紫外分光光度计(NANO2000,Thermo)、荧光定量PCR仪(QuantStudio3,Thermo)、电泳仪(DYY-7C,北京六一)、转移槽(DYCZ-40D,北京六一)、双垂直蛋白电泳仪(DYCZ-24DN,北京六一)、凝胶成像系统(WD-9413B型,北京六一)、酶标仪(ELX-800,BIOTEK)、电热恒温培养箱(DH36001B,天津泰斯特)、TRIzol(1596-026)、HiFiScript cDNA Synthesis Kit(CW2569M)、SYBR Mixture(CW2601M)。RIPA裂解液(P0013B)、PMSF(ST506)、BCA蛋白浓度测定试剂盒(P0009)、30% Acr-Bis(29∶1)(ST003)、SDS-PAGE 蛋白上样缓冲液(P0015)、ECL发光液(P0018)、PVDF膜(IPVH00010)、RORγt 一抗(13205-1-AP)、Foxp3 一抗(22228-1-AP)、羊抗兔IgG-HRP(31210)、内参抗体 GAPDH(10900R)、转化生长因子-β(TGF-β) ELISA检测试剂盒(SEKR-0012)、白细胞介素-23(IL-23)ELISA检测试剂盒(SEKR-0072)、白细胞介素-10(IL-10)ELISA检测试剂盒(SEKR-0006)、白细胞介素-17(IL-17)ELISA检测试剂盒(SEKR-0007)。
1.5实验方法 正常组给予不含病毒的生理盐水(100 μL/只)滴鼻3 d;模型组和定喘汤组乙醚轻度麻醉,并用50 TCID50RSV病毒液滴鼻感染,每鼻孔25 μL,2鼻孔均滴,共50 μL,连续3 d,建立肺炎性损伤模型。定喘汤组在第3天滴鼻2 h后给予定喘汤2 g/(kg·d)灌胃, 1次/d,连续7 d,所有大鼠均在同一条件下喂养。
1.6检测指标及方法 实验第8天取肺组织,观察肺损伤情况,计算肺湿干比,检测RORγt、FoxP3 mRNA和蛋白表达情况,取肺泡灌洗液检测Th17和Treg相关细胞因子含量。
1.6.1肺组织病理损伤情况 将肺脏浸入4%多聚甲醛固定,石蜡包埋后连续切片,脱蜡,HE 染色,镜下观察。参照文献[7],每张切片随机选高倍视野5个,从肺泡充血、出血、血管壁中性粒细胞浸润和肺泡间隔增厚程度4个方面进行病理学评分,将 4 项得分相加作为总分。
1.6.2肺湿干比 取左侧肺组织,滤纸吸干血迹后称湿重,然后置于60 ℃烤箱中烘烤72 h,再称干重,计算肺湿干比。
1.6.3肺组织中RORγt、FoxP3 mRNA表达情况 取肺组织,采用TRIzol法提取细胞总RNA,用HiFiScript cDNA Synthesis Kit试剂盒反转录合成cDNA,用SYBR Mixture试剂盒测定组织相关基因表达情况。以总RNA为模板合成 cDNA,进行PCR反应。扩增条件: 95 ℃ 30 s;循环 40 次, 72 ℃ 2 min 30 s,40 ℃ 1 min30 s,60 ℃to94 ℃每1.0 ℃1 s,25 ℃2 min。在PCR扩增结束后,以2- △△ CT表示mRNA相对表达量。引物序列由苏州金唯智生物有限公司合成,RORγt上游引物序列为5’-CTTCATGGAGCTGTGCCAGA-3’,下游引物序列为5’-AGACTGTGTGGTTGTTGGCA-3’,引物长度为109 bp;Foxp3上游引物序列为5’-CTGGGATCAATGTGGCCAGT-3’,下游引物序列为5’-TCGAAGGCCTTCTCACAACC-3’,引物长度为174 bp。
1.6.4肺组织中RORγt、FoxP3 蛋白表达情况 采用Western blot法检测:取肺组织,依次装入标好的EP管,放入液氮中快速冷冻,加入300 μL蛋白裂解液冰上快速剪碎组织,超声破碎仪上超声4次,静置10 s,再超声4次(冰上操作,功率50 W),置于水浴锅中,100 ℃水浴5 min,4 ℃下12 000×g离心10 min,取上清,采用BCA法测定蛋白浓度。取蛋白样品20 μg进行SDS-PAGE分离,100 ℃变性5 min,4 ℃下10 000×g离心1 min,100 V电泳2 h。随后260 mV转膜3 h。10%脱脂奶粉封闭。加入 Foxp3一抗(1∶1 000)、RORγt一抗(1∶1 000) ,4 ℃孵育过夜,PBST 洗膜3 次,加入二抗(1∶10 000)室温孵育 2 h,PBST 洗膜 3 次, ECL底物发光,凝胶图像处理系统(Gel-Pro-Analyzer软件)分析目标条带的光密度值。
1.6.5肺泡灌洗液中Th17和Treg相关细胞因子含量 取肺泡灌洗液,严格按照 ELISA试剂盒说明书检测IL-17、IL-23、IL-10、TGF-β含量。
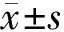
2 结 果
2.1各组肺组织病理形态 正常组幼鼠肺泡、支气管结构正常,无炎性细胞浸润;模型组幼鼠肺泡壁受损,肺间隔增宽,肺间质可见大量炎性细胞浸润;定喘汤组幼鼠肺泡壁损伤较模型组轻,肺间质炎性细胞浸润减少。见图1。

图1 正常组和呼吸道合胞病毒肺炎各组幼鼠肺组织病理形态(HE染色,×200)
2.2各组肺损伤病理评分及肺湿干比比较 模型组肺损伤病理评分和肺湿干比均明显高于正常组(P均<0.05),定喘汤组肺损伤病理评分和肺湿干比均明显低于模型组(P均<0.05)。见表1。
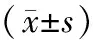
表1 正常组和呼吸道合胞病毒肺炎各组幼鼠肺组织损伤情况
2.3各组肺组织中RORγt、FoxP3 mRNA相对表达量比较 与正常组比较,模型组RORγt mRNA相对表达量明显增高(P<0.05),FoxP3 mRNA相对表达量明显降低(P<0.05);与模型组比较,定喘汤组RORγt mRNA相对表达量明显降低(P<0.05),FoxP3 mRNA相对表达量明显升高(P<0.05)。见表2。
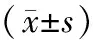
表2 正常组和呼吸道合胞病毒肺炎各组幼鼠肺组织中RORγt、FoxP3 mRNA相对表达量比较
2.4各组肺组织中RORγt、FoxP3蛋白表达情况比较 与正常组比较,模型组RORγt蛋白相对表达量明显增高(P<0.05),FoxP3 蛋白相对表达量明显降低(P<0.05);与模型组比较,定喘汤组RORγt蛋白相对表达量明显降低(P<0.05),FoxP3 蛋白相对表达量明显升高(P<0.05)。见图2及表3。
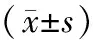
表3 正常组和呼吸道合胞病毒肺炎各组幼鼠肺组织中RORγt、FoxP3 蛋白相对表达量比较
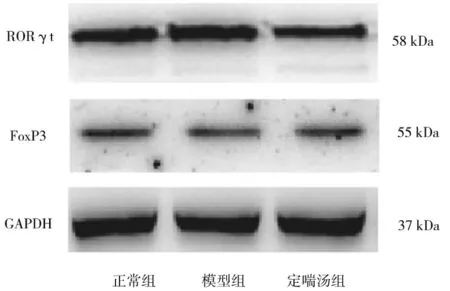
图2 正常组和呼吸道合胞病毒肺炎各组幼鼠肺组织中RORγt、FoxP3 蛋白表达情况
2.5各组肺泡灌洗液中Th17相关细胞因子含量比较 模型组IL-17、IL-23含量均明显高于正常组(P均<0.05),定喘汤组IL-17、IL-23含量均明显低于模型组(P均<0.05)。见表4。
表4 正常组和呼吸道合胞病毒肺炎各组幼鼠肺泡灌洗液中Th17相关细胞因子含量比较
2.6各组肺泡灌洗液中Treg相关细胞因子含量比较 模型组TGF-β、IL-10含量均明显低于正常组(P均<0.05),定喘汤组TGF-β、IL-10含量均明显高于模型组(P均<0.05)。见表5。
表5 正常组和呼吸道合胞病毒肺炎各组幼鼠肺泡灌洗液中Treg相关细胞因子含量比较
3 讨 论
儿童RSV肺炎临床以发热、咳嗽、痰壅、气促为主要特征,符合中医学中“风温”的发病特点,属于“肺炎喘嗽”的范畴。外邪经口鼻而入,首先犯肺,肺失宣肃,肺卫不宣。目前RSV肺炎的证型包括风热闭肺型、风热犯肺型、痰热闭肺型、痰热蕴肺型、热邪闭肺型、血瘀型,其中以痰热闭肺型最为常见[8],而定喘汤是治疗痰热内蕴、哮喘咳嗽的经典方剂[9],因而选用定喘汤治疗。
定喘汤源自明代吴旻辑的《扶寿精方》,《扶寿精方·痰门》曰:“定喘汤专治齁喘,取效甚速。”《重订通俗伤寒论》云:“此寒痰遏热壅塞气管也……白果定喘汤为主。”《景岳全书》则“按此方必风痰在肺者乃可用,他则忌之”。定喘汤方中麻黄直入肺经,宣肺平喘,兼透表达邪。白果敛肺定喘,兼祛痰止咳。麻黄得白果则宣肺平喘而不伤正;白果得麻黄则敛肺定喘而不敛邪,二药合用一散一收、相反相成、开合得宜,共为君药。桑白皮肃降肺气,黄芩清泻肺热,二者共为臣药,可制麻黄之温以防助热。苏子、杏仁、半夏燥湿化痰、降气平喘,款冬花润肺下气、化痰平喘,均为佐药。炙甘草调和诸药,又祛痰止咳,为佐使药。全方共奏清热化痰、宣降肺气、降逆平喘之效。现代药理学研究发现,定喘汤具有舒张支气管、抗炎、抗过敏、抑制免疫反应作用[10]。其中麻黄中有效成分可以通过多分子、多靶点、多通路的方式减轻肺部炎症[11];白果中银杏酸具有抗炎作用[12];黄芩中黄芩素可抑制炎症细胞浸润,减轻肺损伤[13];桑白皮中的桑白皮乙醇提取物对细胞免疫具有抑制作用[14],桑葚多糖能调节参与炎症反应的各种细胞因子的分泌,也具有一定的抗炎作用[15]。
Th17可分泌IL-17和IL-23等细胞因子,RORγt是Th17的谱系决定转录因子[16-17],它们的主要作用是刺激炎症反应,增强细胞免疫反应[18], IL-17可通过刺激促炎因子的分泌来诱导促炎反应[16]。Treg细胞与Th17细胞在功能上是相互拮抗的[19]。Treg细胞是表达转录因子Foxp3的免疫调节细胞[20],它们的主要作用是控制炎症反应,维持免疫平衡,通过避免在诱导免疫应答过程中过度的效应T细胞激活和组织损伤,从而维持机体的稳态[21], Treg细胞通过产生IL-10和TGF-β来发挥这一功能[22-23]。故Th17细胞和Treg细胞之间维持平衡非常重要。RSV感染期间,肺部Th17比例升高,Treg降低,会增强肺部炎症反应,加重RSV感染程度[24],因此调控RORγt和Foxp3平衡可能对RSV的清除很有意义。
本研究结果显示,模型组肺组织病理损伤评分、肺组织中RORγt mRNA及蛋白表达量和肺泡灌洗液中IL-17、IL-23含量均明显增高,肺组织中FoxP3 mRNA及蛋白表达量和肺泡灌洗液中TGF-β、IL-10含量均明显降低,提示RSV诱导肺炎性损伤可引起免疫微环境失衡,肺组织中RORγt/FoxP 3及相关细胞因子TGF-β、IL-10、IL-17、IL-23表达异常。与模型组比较,定喘汤组肺组织病理损伤评分、肺组织中RORγt mRNA及蛋白表达量和肺泡灌洗液中IL-17、IL-23含量均明显降低,肺组织中FoxP3 mRNA及蛋白表达量和肺泡灌洗液中TGF-β、IL-10含量均明显升高,提示定喘汤可调控RORγt、FoxP 3表达,调节免疫微环境,减轻RSV诱导的肺炎性损伤。但中医药对RSV诱导肺炎性损伤的治疗上往往是多分子、多靶点、多通路的,因此,本课题组会进一步研究定喘汤治疗RSV感染的作用机制。
利益冲突:所有作者均声明不存在利益冲突。

