小檗碱抑制JAK2/STAT3信号通路改善糖尿病大鼠前额叶皮层神经元损伤*
万彬彬,张 月,何 昂,袁雨渟,吴宁华,陈清杰**
(1.湖北科技学院医学部药学院,湖北 咸宁 437100;2.湖北科技学院医学部医药研究院糖尿病心脑血管病变湖北省重点实验室)
糖尿病(diabetes mellitus,DM)是一种常见的慢性代谢性疾病[1],随着社会不断发展和生活水平的提高,糖尿病的患病人数在全球范围内呈逐年上升的趋势[2]。糖尿病往往伴随多种并发症,除了会损伤心血管系统、肾脏和眼睛等器官,还会对神经系统产生严重的影响[3]。由于长期的高血糖状态会引起神经元的丢失或损伤,导致大脑神经病变,神经系统功能出现紊乱,甚至影响到其他器官生理功能的正常发挥[4]。研究表明[5],小檗碱具有显著的神经保护作用,能够减轻神经元受损的程度和恢复其功能。这为治疗糖尿病神经元损伤提供了新的思路和依据。
JAK2是一种酪氨酸激酶,在细胞膜下存在,它可以与多种细胞因子受体结合,如胰岛素受体、细胞因子受体等,从而激活STAT3等转录因子[6]。STAT3则是一种核内转录因子,可以促进细胞增殖、分化、凋亡和免疫应答等生物过程[7]。在正常生理情况下,JAK2/STAT3信号通路参与了多种重要的生物学过程,如胚胎发育、免疫应答、细胞增殖和分化等。然而,在某些病理状态下,JAK2/STAT3信号通路也被异常激活,导致多种疾病的发生和发展,如肿瘤细胞的增殖和转移、炎症反应的过度、心血管疾病的发生等[8]。因此,JAK2/STAT3信号通路已成为药物研发的重要靶点之一。
本研究旨在通过给予大鼠高糖高脂饮食(high-glucose-high-fat diet,HFD)和链脲佐菌素尾部静脉注射(streptozotocin,STZ)构建糖尿病模型,探讨小檗碱通过介导JAK2/STAT3信号通路对糖尿病大鼠前额叶皮层神经元的保护作用。
1 材料与方法
1.1 材料
1.1.1 实验试剂
盐酸小檗碱(上海阿拉丁,批号B139120),盐酸二甲双胍(上海阿拉丁,批号M107827),链脲佐菌素(北京索莱宝,批号S8050),柠檬酸钠(上海麦克林,批号C885549),胆固醇(上海麦克林,批号C804517),胆汁盐(上海创赛科技,批号C25-213020),生理氯化钠溶液(四川科伦,L122101704),HE染液(上海尚宝生物,批号ST2001),JAK2(CST,批号3230S),STAT3(CST,批号9139S),p-JAK2(CST,批号3771S),p-STAT3(CST,批号9145S),Iba-1(赛默飞,批号JM36-62),Cleaved-caspase-3(Abcam,批号ab32042),其他试剂均从当地市场购买。
1.1.2 实验动物
SPF级雄性Wistar大鼠48只,8周龄,体重180~200g,购自中国北京生命河实验动物科技有限公司。将大鼠喂养于湖北科技学院医药研究院SPF动物房,室内温度控制在20℃~26℃,相对湿度保持在40%~70%,12h光暗循环,自由饮食饮水。本研究所有实验得到湖北科技学院医药研究院实验动物委员会的批准,并严格执行伦理委员会相关规定,伦理证编号:2020-01-900。
1.2 方法
1.2.1 动物实验
Wistar大鼠经过1周的适应性喂养后随机分4组:对照组(Nor组)、糖尿病组(DM组)、小檗碱治疗组(BBR组)、二甲双胍治疗组(Met组)。参考前期造模方法,Nor组大鼠给予普通饲料喂养,DM组和药物治疗组大鼠给予HFD(67.5%的标准实验大鼠食物,10%的猪油,20%的糖,2%的胆固醇和0.5%的胆汁盐)饲养4周。饲养结束后,对DM组和药物治疗组大鼠以腹腔给药方式注射STZ(25mg/kg),Nor组注射柠檬酸钠缓冲液。注射1周后,采用尾静脉取血的方法来测定造模后的大鼠空腹血糖,若血糖值≥11.1mmol/L,则视为糖尿病模型构建成功。接下来,对BBR组和Met组大鼠分别用小檗碱100mg/(kg·d)和二甲双胍184mg/(kg·d)灌胃给药治疗,连续治疗6周。在给药期间,Nor组大鼠和DM组以生理盐水灌胃给药。动物实验结束后处死取材。
1.2.2 脑组织样本采集
将大鼠麻醉后进行全身灌注,取出全脑置于4℃生理盐水进行清洗。每组取3只动物大脑组织用4%多聚甲醛固定24h,再将组织脱水并进行石蜡包埋,用于HE染色、免疫组化和免疫荧光染色;将剩余样本迅速分离出大脑前额叶皮层组织,在液氮中速冻后保存于-80℃冰箱,以备后续在Western blot实验中使用。
1.2.3 HE染色
将大脑组织蜡块进行切片、烤片。依次使用二甲苯、无水乙醇、95%乙醇、80%乙醇、70%乙醇及纯水进行脱蜡与水化处理,每次处理5~10min,共两次。切片经处理后用苏木精染色5min;用1%盐酸乙醇处理5s后,使用伊红染液浸润3min;依次使用梯度浓度的乙醇和二甲苯进脱水与透明处理,每次5min;封片,将玻片置于光学显微镜镜下观察。
1.2.4 免疫组化
将大脑组织蜡块进行切片、烤片。在完成脱蜡、水化和组织抗原恢复步骤后,加入5%的BSA孵育1h,以阻断非特异性蛋白之间的相互作用;随后在4℃环境中用0.5%的一抗孵育组织过夜;第2d,滴加与一抗相应种属的二抗覆盖组织,孵育1h;滴加新鲜配置的DAB显色液,镜下控制显色时间,及时终止显色;使用苏木素复染2~3min;最后,脱水、透明和封片,将玻片置于光学显微镜镜下观察。
1.2.5 免疫荧光
将大脑组织蜡块进行切片、烤片。在完成脱蜡、水化和组织抗原恢复步骤后,加入5%的BSA孵育1h,以阻断非特异性蛋白之间的相互作用;随后在4℃环境中用0.5%的一抗孵育组织过夜;第2d,滴加与一抗相应种属的二抗覆盖组织,在避光条件下孵育1h;用DAPI和抗荧光猝灭剂对细胞核进行染色;封片,置于光学显微镜下观察。
1.2.6 Western blot检测
从-80℃冰箱里取出各组大鼠的前额叶皮层组织,将组织捣碎,以组织质量∶裂解液体积=1mg∶3μL的比例向前额叶皮层组织加入裂解液,裂解10min后放入4℃匀浆机中充分研磨,使用超速离心机15000r/min离心15min,取上清液,并采用BCA法测定蛋白浓度,浓度配平后将蛋白变性,得到样本总蛋白溶液;在SDS-PAGE凝胶上分离出样本溶液中不同分子量大小的蛋白;将凝胶上的蛋白转移到PDVF膜;置于5%脱脂奶粉室温封闭1h;1×TBST洗涤4次,每次5~10min;在4℃环境中孵育一抗过夜;1×TBST洗膜4次后,加入羊抗兔IgG二抗,室温下孵育1h;1×TBST洗膜4次,用ECL曝光显影,并用Image Lab软件分析蛋白条带的灰度值,比较各组蛋白表达情况。
1.3 统计学方法

2 结 果
2.1 小檗碱改善糖尿病大鼠前额叶皮层区神经元细胞的损伤
HE染色(图1)结果显示,Nor组的前额叶皮层区神经元形态正常,细胞质均匀淡染,细胞核圆润透亮。与Nor组相比,DM组的前额叶皮层区神经元发生了变性,细胞核固缩,且染色较浓。给予BBR和Met干预后,大鼠前额叶皮层区神经元均有不同程度的改善,细胞核变得圆润透亮,变性神经元显著减少。表明小檗碱能够有效改善糖尿病大鼠前额叶皮层区神经元的损伤。
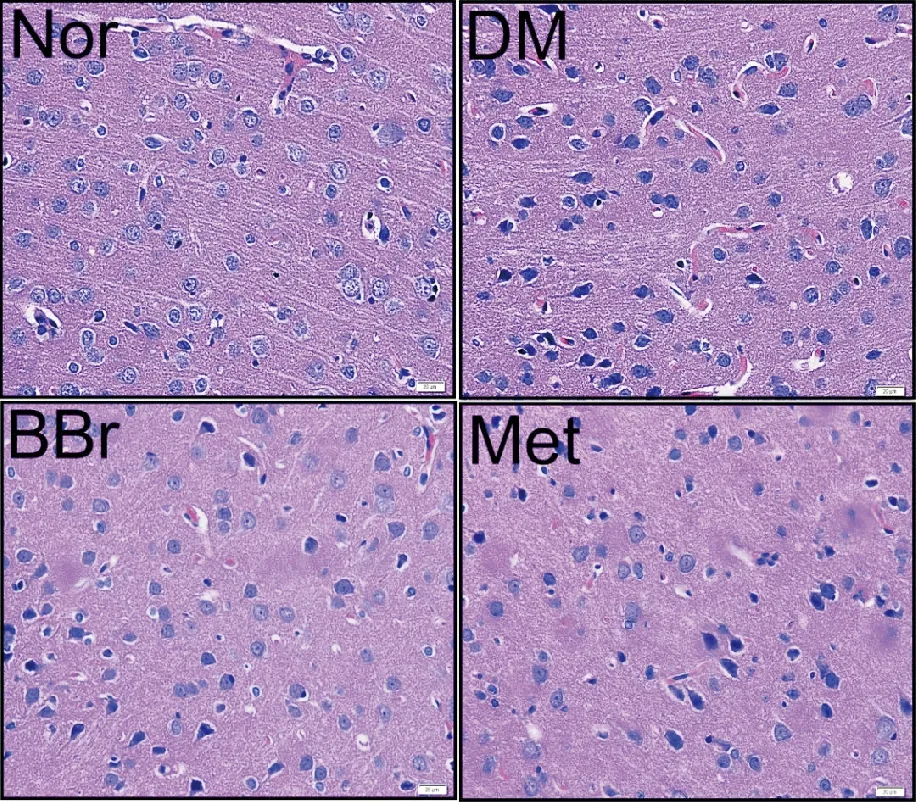
图1 各组大鼠前额叶皮层HE染色图(×400,标尺=2.5μm)
2.2 小檗碱抑制糖尿病大鼠前额叶皮层区中小胶质细胞的过度活化
如图2,免疫组化实验结果显示,与Nor组相比,DM组大鼠前额叶皮层区中小胶质细胞的活化程度明显升高;与DM组相比,BBR组及Met组在前额叶皮层区中小胶质细胞的活化程度明显降低。同时,蛋白免疫印迹实验结果显示,与Nor组相比,DM组大鼠前额叶皮层区中Iba-1蛋白的表达水平明显增加(P<0.01);与DM组相比,BBR组及Met组在前额叶皮层区中Iba-1蛋白的表达水平显著减少(P<0.05)。表明小檗碱可以抑制糖尿病大鼠前额叶皮层区中小胶质细胞的过度活化。
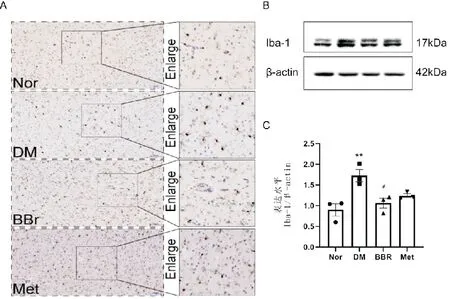
A:各组大鼠前额叶皮层区中小胶质细胞的代表图(×400,标尺=2.5μm);B:各组大鼠前额叶皮层区中Iba-1蛋白表达条带图;C:各组大鼠前额叶皮层区中Iba-1蛋白表达统计图(与Nor组比较,**P<0.01;与DM组比较,#P<0.05,n=3)
2.3 小檗碱抑制糖尿病大鼠前额叶皮层区JAK2/STAT3信号通路的激活
结果显示,与Nor组相比,DM组大鼠前额叶皮层区中JAK2和STAT3蛋白表达水平无明显变化(P>0.05),p-JAK2和p-STAT3蛋白表达水平明显增加(P<0.05);与DM组相比,BBR组及Met组大鼠前额叶皮层区中JAK2和STAT3蛋白表达水平也无明显变化(P>0.05),p-JAK2和p-STAT3蛋白表达水平则明显减少(P<0.05)。见图3。表明小檗碱可以抑制糖尿病大鼠前额叶皮层区JAK2/STAT3信号通路的激活。
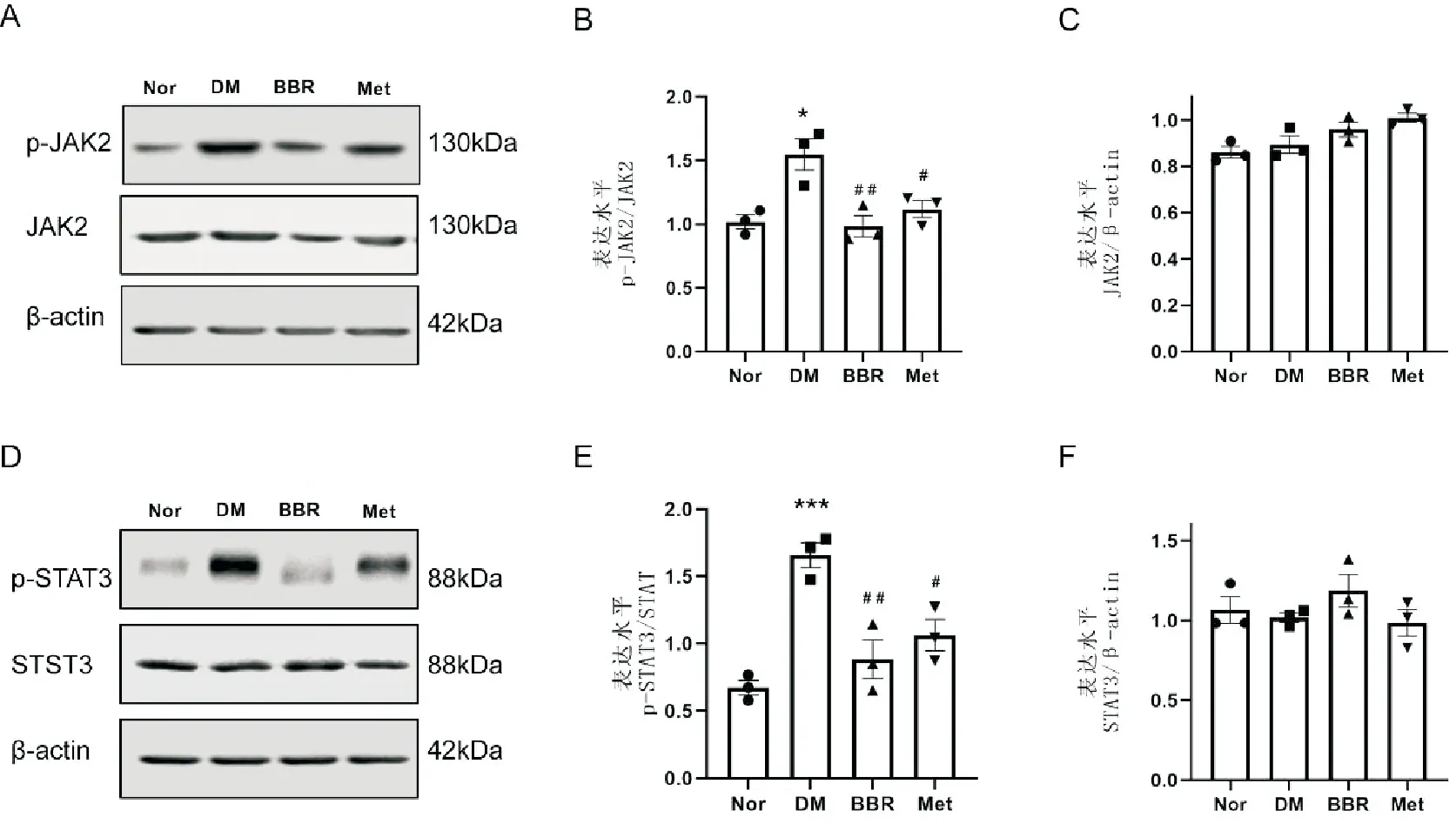
A:各组大鼠前额叶皮层区p-JAK2和JAK2蛋白表达条带图;B:各组大鼠前额叶皮层区p-JAK2和JAK2蛋白表达比值统计图;C:各组大鼠前额叶皮层区JAK2蛋白表达统计图;D:各组大鼠前额叶皮层区p-STAT3和STAT3蛋白表达条带图;E:各组大鼠前额叶皮层区p-STAT3和STAT3蛋白表达比值统计图;F:各组大鼠前额叶皮层区STAT3蛋白表达统计图(与Nor组比较,*P<0.05,***P<0.001;与DM组比较,#P<0.05,##P<0.01,n=3)
2.4 小檗碱对糖尿病大鼠前额叶皮层区中Cleaved-caspase-3的影响

Cleaved-caspase-3是凋亡的marker(白色箭头所示),Nue-N是神经元的marker(绿色荧光所示)
如图4所示,与Nor组相比,DM组大鼠前额叶皮层区中Cleaved-caspase-3蛋白荧光强度明显增强;与DM组相比,BBR组及Met组大鼠前额叶皮层区中Cleaved-caspase-3蛋白荧光强度明显减弱。结果显示小檗碱能够有效缓解糖尿病大鼠前额叶皮层区中神经元细胞的凋亡。
3 讨 论
大脑中的神经元作为构成神经系统的最基本单位,对于人类的思维形成和行为能力具有至关重要的作用[9]。然而,当机体生理功能发生异常或在病理状态下,如缺血、炎症、糖尿病等,会引起大脑神经元受损[10]。针对神经元的损伤,科学家们一直在寻找有效的保护方法以维护神经系统的正常功能。随着社会的进步和科技的发展,现代医学中将各种天然药物经加工或处理后用于治疗各种疾病,而天然药物发挥药效的关键是其含有的各种活性成分。中药单体化合物小檗碱是一种源于小檗树的天然化合物,具有多种生物活性。多项研究证实[11-12],小檗碱具有抗炎、抗精神病和显著的神经保护作用。然而,其产生有效作用的分子机制和治疗效果仍有待于进一步研究。
在本实验中,我们通过使用HFD+STZ联合诱导糖尿病大鼠动物模型构建,探讨了小檗碱对糖尿病大鼠前额叶皮层区中神经元的保护作用。在HE染色结果中发现,与Nor组相比,糖尿病大鼠前额叶皮层区中神经元发生了变性,细胞核固缩,染色较浓;给予BBR和Met治疗后,细胞核变得圆润透亮,神经元变性数量减少。这表明小檗碱可以改善因糖尿病所至的神经元损伤。
此外,小胶质细胞是中枢神经系统中的一种神经胶质细胞,可产生和释放炎症趋化因子、NO和活性氧自由基(ROS)等;当小胶质细胞过度活化,会释放ROS、NO和炎症趋化因子,并导致神经元的损伤[13]。Iba-1(ionized calcium-binding adapter molecule 1)是一种钙离子结合适配分子。由于它在小胶质细胞中高度表达,并且在其他类型的细胞中表达较少,因此,通常被用作小胶质细胞的标记物。我们在免疫组化和蛋白免疫印迹实验结果中发现,与Nor组相比,糖尿病大鼠前额叶皮层区中小胶质细胞的活化程度明显升高,Iba-1蛋白表达水平显著增加;给予BBR和Met治疗后,上述现象均被逆转。这些结果表明小檗碱能够抑制糖尿病大鼠前额叶皮层区中小胶质细胞的过度活化。
JAK2/STAT3信号通路在神经元损伤中扮演着重要的作用。有研究发现[13],抑制JAK2-STAT3信号通路,可以减少炎症因子和凋亡相关蛋白的表达,增加神经元的存活数量,从而对癫痫诱导的脑损伤具有保护作用。我们在蛋白免疫印迹实验结果中发现,糖尿病大鼠前额叶皮层区中p-JAK2和p-STAT3蛋白的表达水平均显著增加;给予BBR和Met治疗后,上述蛋白的表达水平均明显减少。表明小檗碱可能是通过抑制JAK2/STAT3信号通路来降低糖尿病大鼠前额叶皮层区中小胶质细胞的过度活化。
Cleaved-caspase-3和NeuN是神经元凋亡和成熟标记物,它们在神经元发生损伤或死亡时被检测。因此,同时检测Cleaved-caspase-3和NeuN可以帮助确定神经元是否正在发生凋亡[14]。我们在免疫荧光实验结果中发现,糖尿病大鼠前额叶皮层区中Cleaved-caspase-3蛋白荧光强度明显增强;给予BBR和Met治疗后,Cleaved-caspase-3蛋白荧光强度则明显减弱。表明小檗碱能够有效缓解糖尿病大鼠前额叶皮层区中神经元细胞的凋亡。
综上所述,我们认为小檗碱可能主要通过抑制JAK2/STAT3信号通路来降低小胶质细胞的活化程度,从而减少炎症反应和细胞凋亡,最终改善糖尿病大鼠前额叶皮层区中神经元的损伤。此外,我们发现小檗碱虽然产生了与二甲双胍类似的生物效应,但是二甲双胍的生物效应却较小檗碱低,这可能是我们没有考虑到二甲双胍半衰期短,且给药次数仅1次/d,导致大鼠体内血药浓度低。同时,小檗碱是否还可以通过其他信号通路来改善糖糖尿病大鼠前额叶皮层区中神经元的损伤,还需要进一步研究。如若小檗碱的神经元保护作用在临床试验中得以验证,将对预防和治疗糖尿病诱导的神经元损伤有着重要的意义。

