启动子上的增强子和CpG岛在转基因沉默和位置效应中的作用
肖 捷,纪 华,王 宵,王 静,刘凌云,李美荃,王 斌
(1.大理大学药学院,云南 大理 671000;2.云南省第一人民医院肿瘤科,云南 昆明 650034;3.昆明学院云南教育厅新型畜禽疫苗及产业关键技术工程研究中心,云南 昆明 650214)
重组蛋白药物是利用基因工程技术表达的产物,用于弥补体内某些功能蛋白的缺失[1],在生物医药领域被广泛应用。但是,目前在哺乳动物细胞中重组蛋白药物的高效和稳定表达仍是生产上的主要难题。外源基因在哺乳动物细胞中高效和稳定表达的主要障碍与转基因沉默效应和位置效应等表观遗传机制有关。转基因沉默是宿主细胞中转入的外源基因受到细胞的内在机制的抑制而不表达,这是生物体在基因调控上的一种自我保护机制,也是基因工程产品生物实用化和商品化的巨大障碍[2-3]。转基因沉默可发生在转录水平、转录后水平和染色质DNA水平3种不同层次上[4-5]。位置效应是指当转基因插入转录不活跃区域或异染色质区域,导致转基因处于低水平的转录或不能转录[6-7]。启动子上的调控元件能影响转基因沉默和位置效应[8],如增强子能消除DNA甲基化[9-10],CpG岛调节元件对DNA甲基化具有抵抗能力等[11]。但是,启动子上的调节元件如何影响转基因沉默效应和位置效应尚不完全清楚。多能干基因八聚体结合转录因子4(octamer binding transcription factor 4,OCT4)、性别决定区Y框蛋白2(sex determining region Y box protein 2,SOX2)和NANOG是典型的受表观遗传调控的细胞命运决定基因的关键因子,其中OCT4基因启动子主要包含近端增强子和近端启动子,SOX2基因启动子包含CpG岛,而NANOG基因启动子不含近端增强子和CpG岛[12-13]。同时含CpG岛和增强子的巨细胞病毒(cytomegalovirus,CMV)基因启动子是真核表达载体中常用的高表达启动子[14],能够在多种不同类型的细胞中高效表达外源基因。本研究观察NANOG、SOX2、OCT4、CMV基因启动子介导的载体稳定转染到中国仓鼠卵巢细胞株CHO-K1细胞和人胚胎肾细胞(human embryonic kidney 293,HEK293)中的表达差异,以及各启动子介导的载体转染后在不同时间段所受的转基因沉默效应和不同单克隆中受位置效应的影响,探讨启动子上增强子和CpG岛调节元件在转基因沉默和位置效应中的作用,以期为构建高效稳定表达的载体提供理论依据,为解决重组蛋白药物在生产过程中的低产量、不稳定等问题提供方向。
1 材料与方法
1.1 细胞、主要试剂与仪器
中国仓鼠卵巢细胞株CHO-K1和HEK293细胞株(冷冻管干冰保存运输)购自广州吉妮欧生物科技有限公司。含增强绿色荧光蛋白(enhanced green fluorescent protein,EGFP)载体pE-C1购自上海生工生物工程股份有限公司,pE-Oct4、pE-Sox2、pE-Nanog 载体为云南教育厅新型畜禽疫苗及产业关键技术工程研究中心构建,卡那霉素购自大连美仑生物技术有限公司,胰蛋白酶细胞消化液购自上海碧云天生物技术有限公司,胎牛血清购自以色列Biological Industries公司,大提质粒试剂盒购自美国Omega 公司,总RNA提取试剂盒购自北京索莱宝科技有限公司,AseⅠ酶和AgeⅠ酶购自TaKaRa宝生物技术(大连)有限公司,引物由昆明硕擎生物科技有限公司合成;聚合酶链式反应仪购自美国ABI公司,电穿孔系统、电击杯型号640购自美国BTX公司,荧光倒置显微镜购自德国Leica公司,SpectraMax M2酶标仪购自美国Molecular Devices公司。
1.2 实验方法
1.2.1 pE-Oct4、pE-Sox2、pE-Nanog载体构建
取pE-C1载体,用AseⅠ酶和AgeⅠ酶对pE-C1载体行双酶切,去除mCMV基因启动子片段,用人源OCT4、SOX2、NANOG基因启动子连接在mCMV基因启动子去除片段位置进行载体构建,从而获得pE-Oct4、pE-Sox2、pE-Nanog 3种载体。
1.2.2 细胞培养
将CHO-K1细胞接种于含体积分数10%胎牛血清和体积分数1%双抗的RPMI 1640培养基中,将HEK293细胞接种于含体积分数10%小牛血清和体积分数1%双抗的达尔伯克改良伊格尔培养基,置于37 ℃、含体积分数5% CO2的细胞培养箱中培养;待细胞融合达80%~90%时传代,按所需浓度接种至培养瓶中或细胞培养板上,用于后续实验。
1.2.3 细胞转染及G418筛选单克隆细胞株
将CHO-K1、HEK293细胞转移到75 cm2细胞培养瓶中,细胞融合达50%~70%时,用胰蛋白酶消化细胞,加入1 mL RPMI 1640培养基获得细胞混悬液;分别取400 μL细胞混悬液(细胞数约为 2×106)和pE-C1、pE-Oct4、pE-Sox2、pE-Nanog 载体质粒(各20 μg)加入到电击杯中混匀,进行电击转化;将电击杯放入电击槽中,280 V、20 ms脉冲电击1次,电击后将电击杯于冰上静置5 min;将CHO-K1和HEK293细胞分别吸入含有0.8 mL CHO-K1细胞培养基和HEK293细胞培养基的12孔板中,置于37 ℃、含体积分数5% CO2的恒温培养箱中培养24 h,待细胞融合度达50%~70%时,加入700~800 mg·L-1G418 15 μL;48 h后观察细胞,当有大量细胞死亡时,换成筛选培养基培养,将G418浓度减半,持续G418加压筛选,直至细胞克隆生成;10~14 d 左右细胞克隆形成,长出肉眼可见的单克隆细胞株后,使用软琼脂法筛选细胞单克隆;将单个细胞株挑至96孔板内,移液枪吹打细胞形成细胞悬液,置于37 ℃、含体积分数5%CO2培养箱中培养,细胞贴壁生长后,在荧光显微镜下筛选单克隆细胞株。
1.2.4 荧光强度分析EGFP蛋白表达
使用荧光显微镜对构建载体稳定转染第20天的CHO-K1细胞和HEK293细胞以及构建载体稳定转染第30天的CHO-K1细胞进行荧光拍照,参数:10倍焦距;70%绿光、蓝光和白光强度,每个样品选取3个不同拍摄点进行拍照,并应用Image J 软件中Mean算法对荧光图片进行荧光强度分析,以荧光强度值代表EGFP蛋白表达。
1.2.5 克隆表达差异分析
应用Image J 软件中Mininum、Maxentropy、Mean 3种算法分别计算pE-C1、pE-Oct4、pE-Sox2、pE-Nanog 4个载体稳定转染后形成的多个单细胞克隆混合生长样品在同一个样本中最大荧光强度的细胞、大于平均荧光强度的所有细胞和最小荧光强度的所有细胞的平均荧光强度值,以此表示该样品中表达载体整合在不同位置导致的表达差异,反映其克服位置效应后的稳定表达程度[13]。
1.2.6 单克隆筛选和荧光强度分析EGFP蛋白表达
采用有限稀释法从G418筛选后获得的稳定转染多个单克隆混合CHO-K1细胞中分别筛选pE-C1、pE-Oct4、pE-Sox2、pE-Nanog质粒稳定转染的单克隆细胞,每个质粒载体随机筛选3个单克隆细胞,应用Image J软件进行平均荧光强度分析,根据平均荧光强度观察载体整合位置不同的单克隆细胞中EGFP荧光强度变化。
1.2.7 酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法检测CMV、OCT4、SOX2、NANOG基因启动子在CHO-K1细胞中介导表达的EGFP蛋白
将筛选出的CHO-K1单克隆细胞株在T25培养瓶中扩大培养,待细胞融合达90%时,加入适量NP-40裂解液于冰上充分裂解,使用移液器将裂解物移至1.5 mL离心管中,4 ℃下14 000×g离心10 min,取上清液,置于新的1.5 mL离心管中,得到待测蛋白样品;对标准品进行稀释,终质量浓度分别为10、8、6、4、2 μg·L-1,各孔分别加50 μL;将pE-C1、pE-Oct4、pE-Sox2、pE-Nanog质粒稳定转染的4种单克隆细胞待测蛋白样品进行11稀释,将稀释后的标准品和待测样品加入反应孔中,立即加入50 μL小鼠EGFP单抗,盖上膜板,轻轻振荡摇匀,37 ℃ 孵育1 h;洗涤后在各反应孔中加入0.1 mL新鲜稀释的亲和链霉素-辣根过氧化物酶,37 ℃孵育0.5~1.0 h,洗涤3次后,加底物液四甲基联苯胺显色,应用酶标仪于波长450 nm处检测各孔吸光度值,绘制样品标准曲线,根据标准曲线计算EGFP蛋白表达水平。实验重复3次,取均值。
1.2.8 实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)法检测CMV、OCT4、SOX2、NANOG基因启动子在CHO-K1细胞中介导表达的EGFP mRNA
取筛选得到的pE-C1、pE-Oct4、pE-Sox2、pE-Nanog 质粒稳定转染的CHO-K1单克隆细胞,用TRIzol试剂提取细胞总RNA,用反转录试剂盒将1.0 μg RNA反转录为cDNA。PCR反应体系:cDNA 2.0 μL,上下游引物各0.4 μL,Eastep®qPCR Master Mix 2×10.0 μL,Rox 0.4 μL,无酶水 6.8 μL。 引物序列由上海生工生物工程股份有限公司合成。EGFP上游引物序列为5′-GTGCAGTGCTTCAGCCGCTAC-3′,下游引物序列为5′-GTGCAGT GCTTCAGCCGCTAC-3′;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)上游引物序列为5′-GTGCAGTGCTTCAGCCGCTAC-3′,下游引物序列为5′-GTGCAGTGCTTCAGCCGCTAC-3′。以内参GAPDH的循环数作为对照,将配制好的样品和内参置于荧光定量 PCR仪(EppendorfQX200)上进行PCR扩增反应,采用2-△△Ct法计算CHO-K1细胞中EGFP mRNA的相对表达量。实验重复3次,取均值。
1.3 统计学处理
2 结果
2.1 不同时段内不同启动子对转基因沉默效应的反应
pE-Sox2、pE-Oct4、pE-Nanog、pE-C1载体构建成功,其结构见图1。
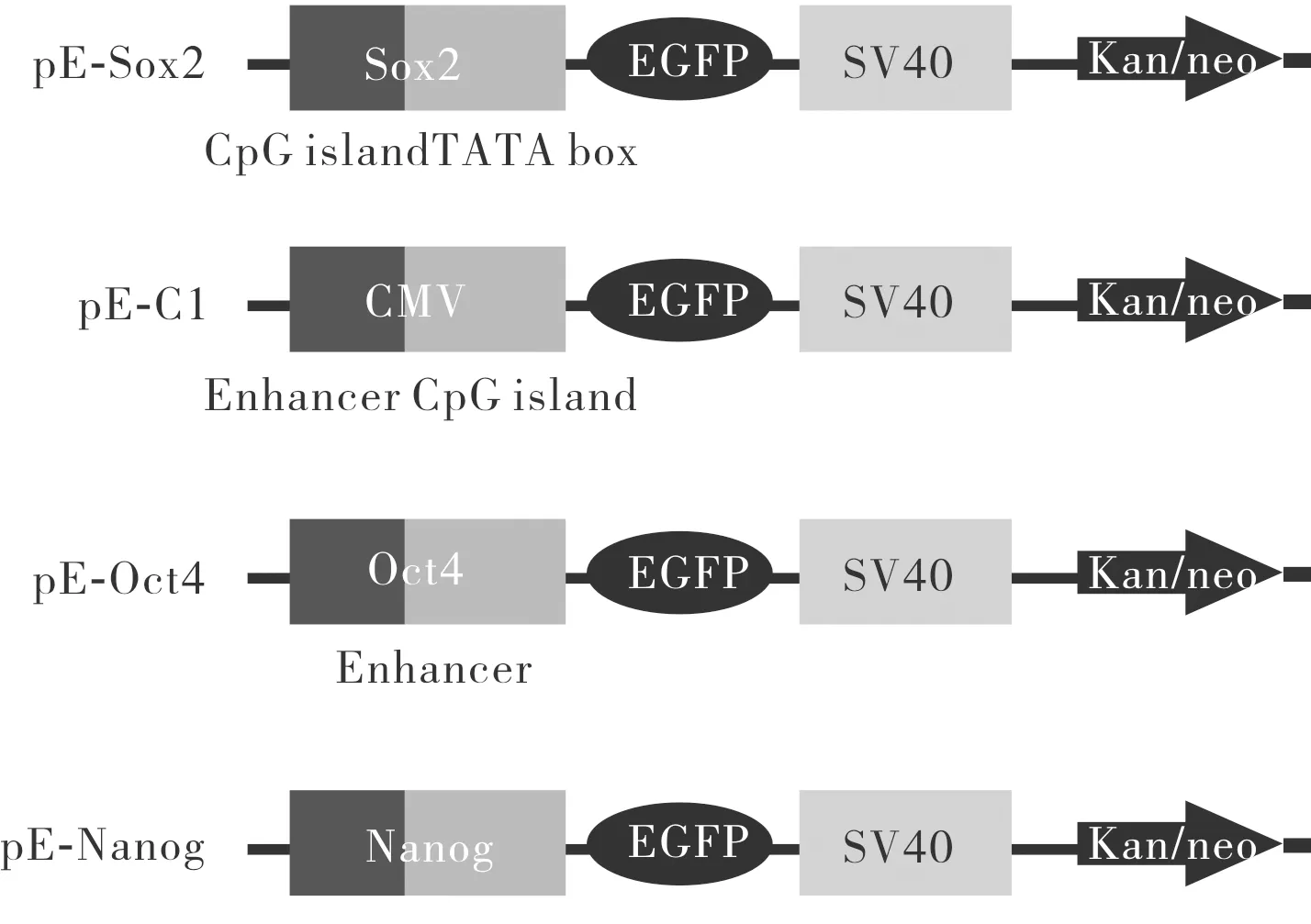
图1 含SOX2、CMV、OCT4、NANOG基因启动子表达载体的结构示意图Fig.1 Structural diagram of expression vector containing SOX2,CMV,OCT4 and NANOG gene promoter
SOX2基因启动子在CHO-K1细胞和HEK293细胞中介导表达的EGFP平均荧光强度分别为0.200±0.081、0.150±0.060,SOX2基因启动子在CHO-K1细胞和HEK293细胞中介导表达的EGFP平均荧光强度比较差异无统计学意义(t=0.770,P>0.05)。OCT4基因启动子在CHO-K1细胞和HEK293细胞中介导表达的EGFP平均荧光强度分别为0.250±0.041、0.061±0.019;OCT4基因启动子在CHO-K1细胞中介导表达的EGFP平均荧光强度显著高于HEK293细胞,差异有统计学意义(t=7.000,P<0.05)。CMV基因启动子在CHO-K1细胞和HEK293细胞中介导表达的EGFP平均荧光强度分别为 0.330±0.020、0.180±0.013;CMV基因启动子在CHO-K1细胞中介导表达的EGFP平均荧光强度显著高于HEK293细胞,差异有统计学意义(t=11.100,P<0.05)。NANOG基因启动子在CHO-K1细胞和HEK293细胞中介导表达的EGFP平均荧光强度分别为 0.240±0.029、0.150±0.020;NANOG基因启动子在CHO-K1细胞中介导表达的EGFP平均荧光强度显著高于HEK293细胞,差异有统计学意义(t=4.900,P<0.05)。 结果见图2。
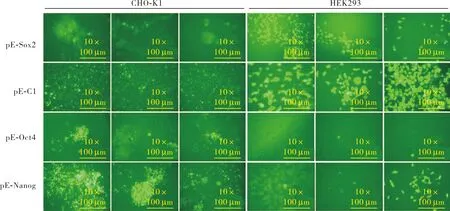
图2 携带不同启动子的载体在CHO-K1细胞和HEK293细胞中介导EGFP基因的表达Fig.2 Expression of EGFP in CHO-K1 cells and HEK293 mediated by vectors carrying different promoters
ELISA结果显示,转染第20、30天,SOX2基因启动子在CHO-K1细胞中介导表达的EGFP蛋白水平分别为(1.77±0.18)、(1.81±0.04)μg·L-1;SOX2基因启动子转染第20、30天在CHO-K1细胞中介导表达的EGFP蛋白水平比较差异无统计学意义(t=0.330,P>0.05)。转染第20、30天,CMV基因启动子在CHO-K1细胞中介导表达的EGFP蛋白水平分别为(2.19±0.17)、(1.74±0.07)μg·L-1;CMV基因启动子转染第20天在CHO-K1细胞中介导表达的EGFP蛋白水平显著低于转染第30天,差异有统计学意义(t=3.770,P<0.05);转染第20、30天,OCT4基因启动子在CHO-K1细胞中介导表达的EGFP蛋白水平分别为(2.11±0.16)、(1.84±0.10)μg·L-1;OCT4基因启动子转染第20、30天在CHO-K1细胞中介导表达的EGFP蛋白水平比较差异无统计学意义(t=2.500,P>0.05)。转染第20、30天,NANOG基因启动子在CHO-K1细胞中介导表达的EGFP蛋白水平分别为(2.02±0.14)、(2.02±0.09)μg·L-1;NANOG基因启动子转染第20、30天在CHO-K1细胞中介导表达的EGFP蛋白水平比较差异无统计学意义(t=0.014,P>0.05)。荧光强度分析显示,转染第20、30天,SOX2基因启动子在CHO-K1 细胞介导表达的EGFP平均荧光强度值分别为0.140±0.020、0.140±0.009,CMV基因启动子在CHO-K1细胞中介导表达的EGFP平均荧光强度值分别为0.220±0.032、0.240±0.015,NANOG基因启动子在CHO-K1细胞中介导表达的EGFP平均荧光强度值分别为0.220±0.005、0.220±0.063;转染第20天与转染第30天,SOX2、CMV、NANOG基因启动子在CHO-K1细胞中介导表达的EGFP平均荧光强度值比较差异均无统计学意义(t=0.130、0.830、0.210,P>0.05)。转染第20、30天,OCT4基因启动子在CHO-K1细胞中介导表达的EGFP平均荧光强度值分别为0.250±0.042、0.099±0.015;OCT4基因启动子转染第30天在CHO-K1细胞中介导表达的EGFP平均荧光强度值显著低于转染第20天,差异有统计学意义(t=5.750,P<0.05)。 结果见图3。
2.2 不同启动子介导翻译阶段转基因沉默效应
SOX2、CMV、OCT4和NANOG基因启动子在CHO-K1细胞中介导表达的EGFP蛋白水平分别为(1.77±0.18)、(2.19±0.17)、(2.11±0.16)、(2.02±0.14)μg·L-1,SOX2、CMV、OCT4、NANOG基因启动子在CHO-K1细胞中介导表达的EGFP蛋白水平比较差异无统计学意义(F=4.070,P>0.05)。SOX2、CMV、OCT4、NANOG基因启动子在CHO-K1细胞中介导表达的EGFP mRNA相对表达量分别为0.013±0.007、0.400±0.120、1.190±0.410、1.670±0.510;CMV、OCT4、NANOG基因启动子在CHO-K1细胞中介导表达的EGFP mRNA相对表达量显著高于SOX2基因启动子,差异有统计学意义(t=5.440、5.000、5.740,P<0.05);CMV、OCT4基因启动子在CHO-K1细胞中介导表达的EGFP mRNA相对表达量显著高于NANOG基因启动子,差异有统计学意义(t=3.220、4.270,P<0.05);CMV基因启动子在CHO-K1细胞中介导表达的EGFP mRNA相对表达量高于OCT4基因启动子,但差异无统计学意义(t=1.270,P>0.05)。
为研究SOX2、CMV、OCT4、NANOG基因启动子在转录水平和转录后水平的差异,转录水平用EGFP mRNA相对表达量表示,转录后水平用EGFP蛋白水平来表示,以1.5为基准对转录水平和转录后水平进行相对定量分析,结果显示,SOX2基因启动子介导表达的EGFP在转录水平和转录后水平差异最大(t=16.900,P<0.05),NANOG基因启动子介导表达的EGFP在转录水平和转录后水平差异次之(t=14.930,P<0.05),OCT4和CMV基因启动子介导表达的EGFP在转录水平和转录后水平差异最小(t=2.060、0.430,P>0.05)。结果见表1。
2.3 不同细胞克隆显示不同启动子克服位置效应的能力
用Mininum、Maxentropy、Mean等3种算法计算OCT4基因启动子在多克隆下介导表达的EGFP荧光强度值分别为0.170±0.049、0.082±0.066、0.210±0.085,三者比较差异无统计学意义(F=3.720,P>0.05);SOX2基因启动子在多克隆下介导表达的EGFP荧光强度值分别为0.290±0.012、0.110±0.022、0.490±0.001,三者比较差异有统计学意义(F=516.400,P<0.05);CMV基因启动子在多克隆下介导表达的EGFP荧光强度值分别为0.440±0.009、0.096±0.004、0.580±0.035,三者比较差异有统计学意义(F=428.500,P<0.05);NANOG基因启动子在多克隆下介导表达的EGFP荧光强度值分别为 0.380±0.062、0.150±0.058、0.500±0.055,三者比较差异有统计学意义(F=28.120,P<0.05)。不同单克隆细胞中的差异分析显示,OCT4基因启动子介导表达的EGFP荧光强度值分别为0.085±0.009、0.083±0.020、0.075±0.013,标准误差值为0.005;CMV基因启动子介导表达的EGFP荧光强度值分别为0.093±0.004、0.099±0.017、0.100±0.009,标准误差值为 0.004;NANOG基因启动子介导表达的EGFP荧光强度值分别为0.210±0.016、0.160±0.012、0.092±0.010,标准误差值为0.057;SOX2基因启动子介导表达的EGFP荧光强度值为0.110±0.008、0.140±0.016、0.099±0.029,标准误差值为0.019。4种载体在不同单克隆细胞中介导表达的EGFP荧光强度值的标准误差相比,从高到低依次为NANOG基因启动子在不同单克隆细胞中介导表达的EGFP荧光强度值标准误差、SOX2基因启动子在不同单克隆细胞中介导表达的EGFP荧光强度值标准误差、OCT4基因启动子在不同单克隆细胞中介导表达的EGFP荧光强度值标准误差、CMV基因启动子在不同单克隆细胞中介导表达的EGFP荧光强度值标准误差,且OCT4基因启动子与SOX2、CMV基因启动子在单克隆细胞中介导表达的EGFP平均荧光强度比较差异有统计学意义(t=3.070、4.360,P<0.05)。结果见图4。
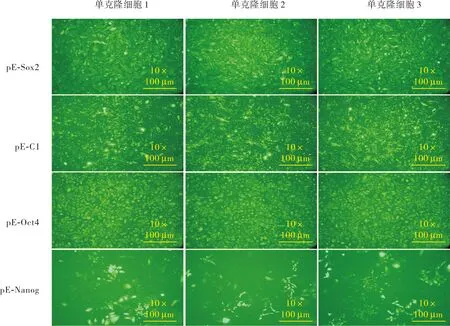
图4 稳定转染4种质粒载体的单克隆细胞中EGFP荧光图Fig.4 Fluorescence images of EGFP in the monoclonal cells stably transfected with four plasmid vectors
3 讨论
启动子上的CpG岛是发生DNA甲基化的主要区域,甲基化的CpG岛会通过干扰转录因子的结合使其所调控的基因表达受到抑制[15-17];同时启动子上的CpG岛大多不发生甲基化,这就使带CpG岛的启动子具有克服转基因沉默效应的结构基础[18-20]。研究报道,带增强子的启动子在不同细胞中受转基因沉默效应的影响差异最明显[21-22],且OCT4基因启动子上的增强子调控元件活性会受到细胞类型特异性DNA甲基化的影响[23]。本研究结果显示,带CpG岛的SOX2基因启动子介导的EGFP在CHO-K1细胞和HEK293细胞中表达量比较差异无统计学意义;这说明,启动子上的CpG岛有助于介导基因在不同细胞染色质环境中的稳定表达。而本研究结果同时显示,OCT4、CMV和NANOG基因启动子在CHO-K1细胞中介导表达的EGFP基因平均荧光强度显著高于HEK293细胞,说明,OCT4、CMV和NANOG基因启动子在CHO-K1细胞中表达的稳定性更高;因此,本研究选择CHO-K1细胞为观察细胞。
本研究通过对含增强子和CpG岛调控的启动子介导表达的标记基因EGFP在CHO-K1细胞中的表达分析,以其转染不同时段表达量变化作为表达载体受转基因沉默效应影响的衡量标准,结果表明,转染第20、30天,带CpG岛的SOX2基因启动子介导表达的EGFP蛋白水平比较差异无统计学意义,带增强子和CpG岛的CMV基因启动子介导的EGFP蛋白水平有显著差异;而带增强子的OCT4基因启动子介导的EGFP表达在转录水平差异极显著,在翻译水平差异也非常明显;这说明,含CpG岛的启动子受转基因沉默效应的影响小,而增强子单独作用的启动子介导的EGFP表达受转基因沉默效应的影响较大。本研究结果显示,CpG岛和增强子共同作用在同一个启动子上时,在EGFP翻译表达水平上具有显著差异,而在EGFP基因转录水平上差异不显著;这说明,带增强子和CpG岛的CMV基因启动子受转基因沉默效应的影响介于带CpG岛的SOX2基因启动子和带增强子的OCT4基因启动子之间;相比之下,不含CpG岛和增强子的NANOG基因启动子受转基因沉默效应的影响与只带CpG岛的启动子相当,提示增强子与CpG岛共同作用时,存在抵消后者克服转基因沉默效应的现象;因此,推测启动子上的CpG岛可能具有较强克服转基因沉默效应的能力,而增强子可能会有利于转基因沉默效应的发生。另外,本研究结果显示,带增强子的OCT4基因启动子增强基因表达的同时会使其在不同细胞环境中表达量差异显著,同时带CpG岛和增强子的CMV基因启动子和不含CpG岛和增强子2个调节元件的NANOG基因启动子均有显著差异;这也说明,增强子的存在可抵消CpG岛克服转基因沉默效应。综上所述,启动子上的CpG岛具有克服转基因沉默效应的能力。
本研究结果显示,带CpG岛的SOX2基因启动子介导的EGFP蛋白表达水平与EGFP mRNA相对表达量之间具有显著差异,且在转录后水平的表达远大于转录水平的表达,这可能是因为SOX2基因启动子上的转录起始位点后300 bp附近的CpG岛对转录后mRNA 5′端非翻译区(5′untranslated region,5′UTR)区有显著影响。研究报道,带CpG岛的启动子在不同细胞中的稳定表达体现在转录后水平的克服转基因沉默效应能力,而带增强子的启动子克服转录后水平转基因沉默的能力弱[24-27]。基因表达的转录后水平调控是以mRNA为中心[28],真核细胞mRNA主要通过包含了保守的茎环结构的5′UTR参与转录后协同调控的生物路径影响转录后水平[29]。CpG岛的启动子中的5′UTR可以启动转录翻译的过程,由此间接促进转录后水平表达,克服转录后水平的转基因沉默效应[30]。另外,高CG的5′UTR区也可能会导致mRNA水平的RNA甲基化程度的增加[31]。一方面,增强子通过粘连蛋白复合物参与,再结合转录因子能够在空间上形成的增强子-启动子染色质环[32],增强子形成的染色质环可在一定程度上调控细胞特异性基因表达。另一方面,增强子具有参与蛋白质修饰、开放染色质结构等经典表观遗传特征,介导表观改变与转录因子之间的相互作用,可实现精确和动态的基因调节表达[33-34]。用同一个载体在不同单克隆中的荧光强度标准差及多个克隆群体中的表达差异,作为反映该载体在同一细胞中不同整合位置表达能力差异的评判标准,以考察不同载体克服位置效应的能力[13]。本研究结果显示,带增强子的OCT4基因启动子在不同单克隆细胞中介导的荧光强度值和同时带增强子和CpG岛的CMV基因启动子在不同单克隆细胞中荧光强度比较差异无统计学意义,说明OCT4和CMV基因启动子在CHO-K1细胞中均能较好地克服位置效应的影响;而带CpG岛调节元件的SOX2基因启动子在不同单克隆细胞中介导的荧光强度值的标准误差最大,克服位置效应的能力最弱;由此说明,CpG和增强子共同作用在同一启动子上时,其克服位置效应的能力有所增强,这可能是带增强子的启动子能较好地克服位置效应,实现带增强子的表达载体在不同单克隆细胞中较为稳定表达的原因。
4 结论
启动子上的CpG岛能克服转基因沉默效应,增强子能够较好地克服位置效应。高效稳定表达的CMV启动子同时带增强子和CpG岛;但CMV基因启动子中增强子和CpG岛的协调并不完美,增强子可能具有抵消CpG岛克服转基因沉默效应的能力。因此,如何在启动子上进一步优化布局,既能避免增强子对CpG岛的克服转基因沉默效应能力的削弱,又能发挥增强子和CpG岛协同增强的克服位置效应能力,值得更深入地研究和探讨。

