雷帕霉素对多囊卵巢综合征大鼠子宫内膜的作用及机制
许 鑫,杨 君,2,赵金金,吴霏霏,张 瑾,李柯欣
(1.新乡医学院第一附属医院妇科,河南 卫辉 453100;2.新乡市妇科恶性肿瘤防治重点实验室,河南 卫辉 453100; 3.新乡医学院第一附属医院生命科学研究中心,河南 卫辉 453100)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄期妇女常见的内分泌、生殖障碍性疾病[1]。PCOS往往始于月经初潮,可导致月经不调、不孕、高雄激素血症、肥胖、卵巢多囊改变等[2],远期可增加子宫内膜癌、心血管疾病、2型糖尿病非依赖性肥胖、代谢综合征等疾病风险[3]。不孕是PCOS患者突出的临床问题,其主要原因是卵巢排卵障碍及子宫内膜功能异常[4]。有研究表明,哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)相关信号通路是PCOS的重要病理生理基础,可参与控制细胞的增殖、生长和代谢等,而雷帕霉素是一种mTOR蛋白特异性抑制剂,可以直接或间接抑制mTOR相关信号通路的激活[5-6]。近年来,关于mTOR相关信号通路在PCOS大鼠卵巢病理变化中作用机制的研究较多,但关于mTOR相关信号通路对PCOS子宫内膜功能障碍的影响及机制相关研究较少。基于此,本研究旨在探讨雷帕霉素对PCOS大鼠子宫内膜的作用及机制,以期为PCOS的基础与临床研究提供参考。
1 材料与方法
1.1 实验动物
健康清洁级Sprague Dawley雌性大鼠30只,6周龄,体质量180~200 g,购自山西医科大学实验动物中心。大鼠分笼饲养,自由饮水、进食,饲养温度(22±2)℃,相对湿度40%~60%,每日光照及黑暗时间各12 h。
1.2 主要试剂与仪器
脱氢表雄酮、雷帕霉素购自上海麦克林生化科技股份有限公司,医用大豆油购自浙江田雨山药用油有限公司,苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒、Masson染色试剂盒购自北京索莱宝科技有限公司,末端脱氧核苷酸转移酶介导的脱氧尿苷三磷酸缺口末端标记测定法(terminal-deoxynucleotidyl transferase mediated deoxyuridine triphosphate nick-end labeling,TUNEL) 细胞凋亡检测试剂盒、抗荧光淬灭封片剂、mTOR抗体、辣根过氧化物酶标记的山羊抗兔抗体购自郑州赛维尔生物科技有限公司,磷酸化哺乳动物雷帕霉素靶蛋白(phosphorylated-mammalian target of rapamycin,p-mTOR)抗体购自艾博抗(上海)贸易有限公司,磷酸化p70核糖体蛋白S6(phosphorylated-p70 ribosomal protein S6,p-p70S6)抗体购自美国Santa公司;轮转切片机、恒温培养箱购自美国Thermo Scientific公司,荧光生物显微镜系统购自日本 Nikon公司,BM-IX 生物组织包埋机、冷冻台购自孝感宏业医用仪器有限公司。
1.3 实验方法
1.3.1 动物分组及干预
6周龄雌性大鼠断乳,适应性喂养1周后称质量,于7周龄时将大鼠随机分为对照组、PCOS组、雷帕霉素组,每组10只。PCOS组和雷帕霉素组大鼠经颈背部皮下注射脱氢表雄酮(60 mg·kg-1),每日1次,连续注射28 d;对照组大鼠每日注射等量生理盐水。造模成功后,雷帕霉素组大鼠每日腹腔注射雷帕霉素10 mg·kg-1,PCOS组和对照组大鼠每日腹腔注射等量生理盐水,连续注射28 d。
1.3.2 各组大鼠体质量检测
分别于造模前、造模后和给药28 d后称各组大鼠体质量。
1.3.3 HE染色法观察大鼠子宫内膜病理学变化
给药28 d后,给予各组大鼠100 g·L-1水合氯醛麻醉,解剖取子宫,分离表面多余组织,生理盐水冲洗血管。将分离的子宫组织用40 g·L-1多聚甲醛固定,脱水、透明后进行石蜡包埋,制备石蜡切片(厚4 μm)。将石蜡切片经二甲苯脱蜡、梯度乙醇复水,苏木精、伊红溶液依次染色,常规脱水、透明后,用中性树胶封片,晾干后置于光学显微镜下观察大鼠子宫内膜病理学变化,并拍照。
1.3.4 Masson染色法检测大鼠子宫内膜纤维化
将“1.3.3” 项中制备的子宫组织石蜡切片经二甲苯脱蜡后进行Masson染色,严格按照试剂盒说明书进行操作,在光学显微镜下观察各组大鼠子宫内膜纤维化情况,子宫内膜纤维化分布显示为蓝色,每张切片随机选取3个视野,应用Image J软件分析子宫内膜纤维化面积占比。
1.3.5 免疫组织化学法检测大鼠子宫内膜组织中mTOR、p-mTOR及p-p70S6的相对表达量
将“1.3.3” 项中制备的子宫组织石蜡切片经二甲苯脱蜡后,浸入枸橼酸钠缓冲液中,95 ℃高压锅内煮沸3 min后,室温下充分冷却,滴加体积分数3%过氧化氢,室温孵育 20 min,滴加山羊血清室温封闭30 min,滴加mTOR、p-mTOR、p-p70S6一抗(滴度均为1200),4 ℃孵育过夜,滴加二抗(滴度1200),室温孵育 50 min,滴加二氨基联苯胺孵育 10 min,自来水冲洗终止显色,苏木精染色1 min,盐酸乙醇溶液分化,梯度乙醇中脱水,二甲苯溶液透明,滴加中性树脂封片,置于显微镜下观察并拍照。阳性细胞被染成棕黄色。每张切片随机选取3个视野,应用 Image J-Pro 软件分析每个视野中mTOR、p-mTOR 及p-p70S6的吸光度值,以吸光度值表示各组蛋白的相对表达量。
1.3.6 TUNEL法检测大鼠子宫内膜细胞凋亡
将“1.3.3” 项中制备的子宫组织石蜡切片经二甲苯脱蜡后,滴加蛋白酶 K于 37 ℃温箱中孵育 20 min,洗片后滴加 Triton X-100于室温下孵育 20 min,洗片后滴加反应混合液(末端转移酶+脱氧尿嘧啶)避光孵育 2 h,洗片后于二脒基苯基吲哚染液中避光孵育 5 min,冲洗后滴加含抗荧光淬灭剂的封片液进行封片,于荧光显微镜下避光观察子宫内膜细胞凋亡情况,凋亡细胞呈现为绿色,每张切片随机选取3个视野,以视野下的凋亡细胞数占细胞总数的百分比表示细胞凋亡率。
1.4 统计学处理
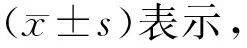
2 结果
2.1 3组大鼠体质量比较
造模前各组大鼠体质量比较差异无统计学意义(F=0.506,P>0.05)。造模后,PCOS组、雷帕霉素组大鼠的体质量显著高于对照组,差异有统计学意义(P<0.05);PCOS组与雷帕霉素组大鼠的体质量比较差异无统计学意义(P>0.05)。给药28 d后,PCOS组大鼠的体质量显著高于对照组和雷帕霉素组,雷帕霉素组大鼠的体质量显著低于对照组,差异有统计学意义(P<0.05)。结果见表1。
表1 3组大鼠体质量比较Tab.1 Comparison of body mass of rats among the three groups
2.2 3组大鼠子宫内膜病理学变化
给药28 d后,对照组大鼠子宫内膜腺体为多个腺体簇状排列,腺腔较大且迂曲较多;PCOS组大鼠子宫内膜腺体数目较对照组减少,为单个腺体分散排列,腺腔小且少有迂曲;雷帕霉素组大鼠子宫内膜腺体数目较多,呈簇状排列,但腺腔多小而直,部分可见到一些皱褶和分支,结果见图1。
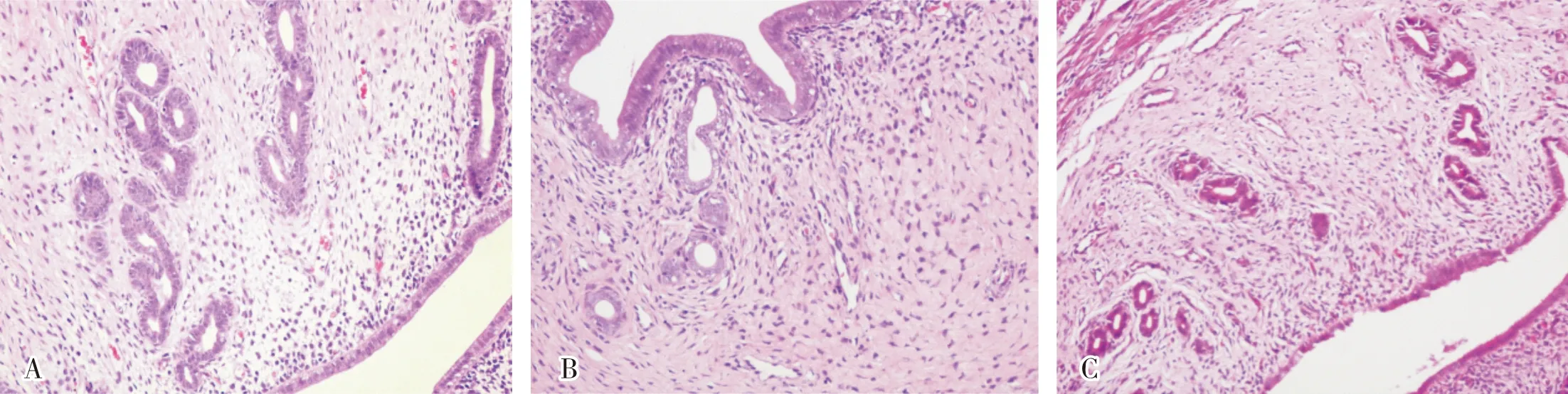
A:对照组;B:PCOS组;C:雷帕霉素组。图1 3组大鼠子宫内膜病理学变化(HE染色,×200) Fig.1 Pathological changes of endometrium of rats in the three groups (HE staining,×200)
2.3 3组大鼠子宫内膜纤维化情况比较
对照组、PCOS组、雷帕霉素组大鼠子宫内膜纤维化面积占比分别为(56.0±8.8)%、(77.0±9.4)%、(74.4±8.2)%。3组大鼠的子宫内膜纤维的面积占比比较差异有统计学意义(F=8.271,P<0.05)。PCOS组和雷帕霉素组大鼠子宫内膜纤维化面积占比显著高于对照组,差异有统计学意义(P<0.05)。 PCOS组与雷帕霉素组大鼠子宫内膜纤维化面积占比比较差异无统计学意义(P>0.05)。 结果见图2。
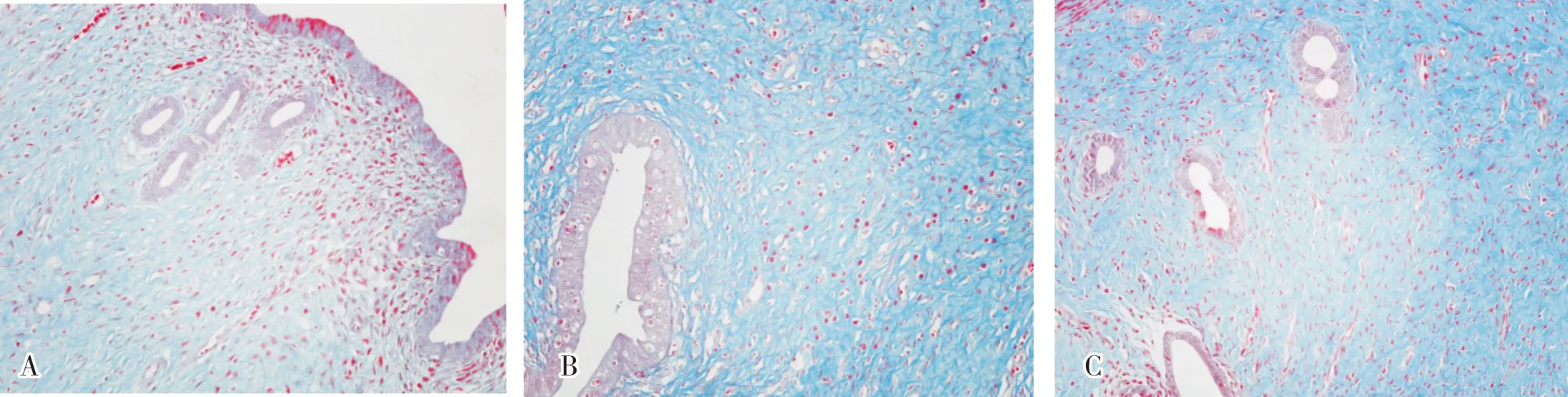
A:对照组;B:PCOS组;C:雷帕霉素组。图2 3组大鼠子宫内膜纤维化情况(Masson染色,×200)Fig.2 Endometrial fibrosis of rats in the three groups (Masson staining,×200)
2.4 3组大鼠子宫内膜细胞凋亡情况比较
对照组、PCOS组、雷帕霉素组大鼠子宫内膜细胞凋亡率分别为 (3.582±0.709)%、(6.606±0.844)%、(2.132±0.744)%。3组大鼠子宫内膜细胞凋亡率比较差异有统计学意义(F=88.390,P<0.05)。PCOS组大鼠子宫内膜细胞凋亡率显著高于对照组和雷帕霉素组,差异有统计学意义(P<0.05)。对照组与雷帕霉素组大鼠子宫内膜细胞凋亡率比较差异无统计学意义(P>0.05)。
2.5 3组大鼠子宫内膜组织中mTOR、p-mTOR及p-p70S6相对表达量比较
PCOS组大鼠子宫内膜组织中mTOR、p-mTOR及p-p70S6的相对表达量显著高于对照组和雷帕霉素组,差异有统计学意义(P<0.05)。雷帕霉素组大鼠子宫内膜组织中p-mTOR的相对表达量显著低于对照组,差异有统计学意义(P<0.05)。对照组与雷帕霉素组大鼠子宫组织内膜组织中mTOR、p-p70S6 的相对表达量比较差异无统计学意义(P>0.05)。 结果见图3和表2。
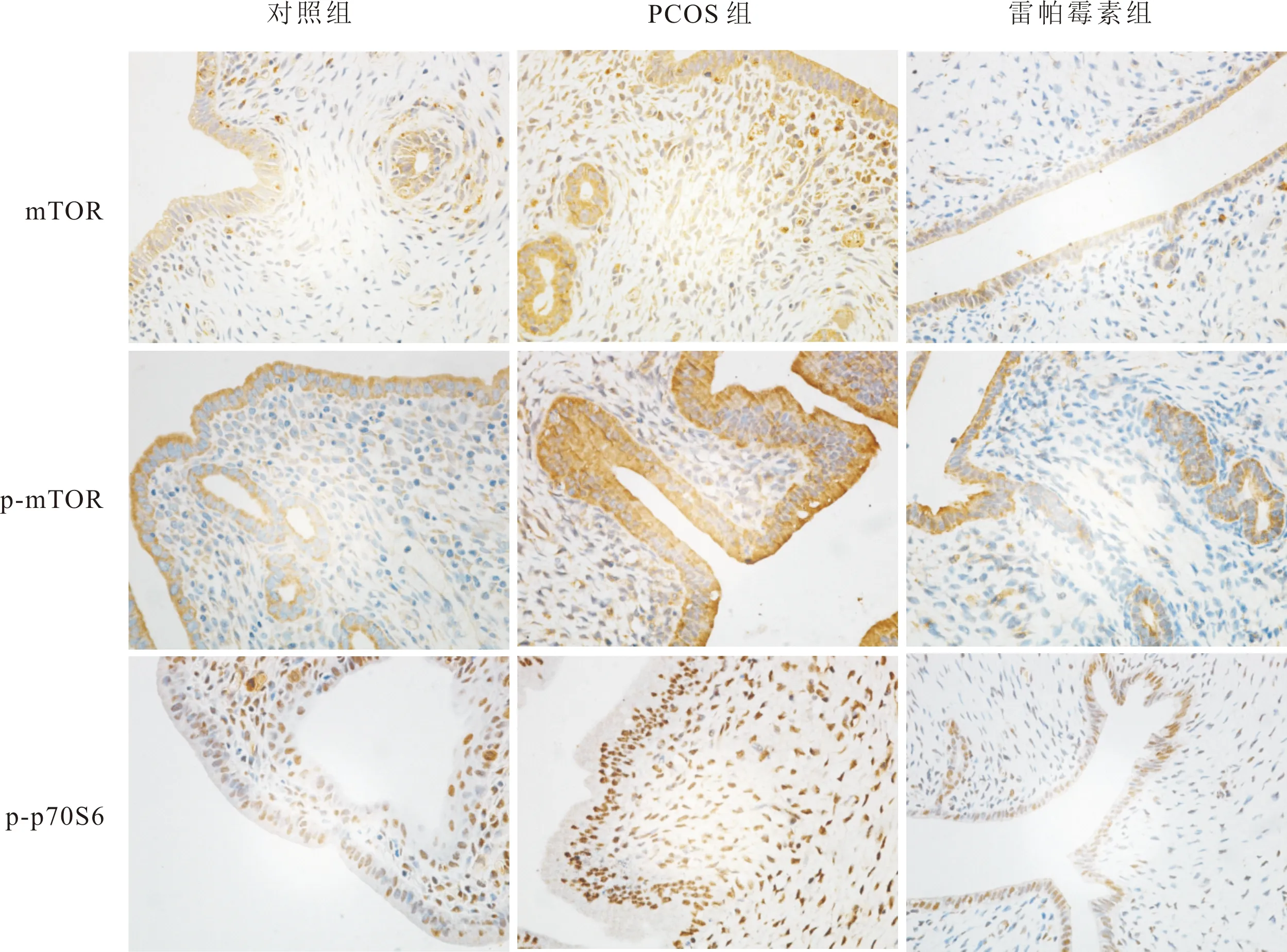
图3 3组大鼠子宫内膜组织中mTOR、p-mTOR及p-p70S6的表达(免疫组织化学染色,×400)Fig.3 Expressions of mTOR,p-mTOR and p-p70S6 in the endometrium of rats in the three groups (immunohistochemical staining,×400)
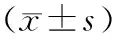
表2 3组大鼠子宫内膜组织中mTOR、p-mTOR及p-p70S6相对表达量比较Tab.2 Comparison of the relative expressions of mTOR,p-mTOR and p-p70S6 in the endometrium of rats among the three groups
3 讨论
PCOS 是一种以高雄激素血症为特征的疾病,可导致子宫内膜增生、子宫内膜癌、胚胎植入失败、复发性流产、子宫内膜功能障碍等[7-9]。mTOR是磷脂酰肌醇3激酶/蛋白激酶B/mTOR信号通路的成员,该通路涉及许多下游靶点,可参与细胞生长、增殖、蛋白质合成、转录、血管生成、凋亡和自噬等生物过程[10]。研究表明,mTOR途径的过度表达参与PCOS病理生理过程,可导致胰岛素抵抗,促进卵巢颗粒细胞的凋亡、膜细胞的增殖,从而影响卵泡的发育,雷帕霉素可通过抑制mTOR信号通路异常激活,保护卵泡储备功能[11]。WANG等[12]研究表明,雌激素可诱导大鼠子宫内膜组织中p-mTOR、磷酸化核糖体蛋白S6水平明显升高,雷帕霉素可通过抑制mTOR通路降低p-mTOR、磷酸化核糖体蛋白S6的蛋白质和DNA合成,表明雷帕霉素可用于治疗雌激素导致的子宫内膜增生性疾病。
本研究通过经颈背部皮下注射脱氢表雄酮构建PCOS大鼠模型[13-14],造模后,PCOS组、雷帕霉素组大鼠的体质量显著高于对照组,符合PCOS大鼠模型的病理特点;给药28 d后,PCOS组大鼠的体质量显著高于对照组和雷帕霉素组,雷帕霉素组大鼠的体质量显著低于对照组,说明雷帕霉素可抑制PCOS大鼠体质量的增加,PCOS组大鼠体质量低于对照组大鼠可能与雷帕霉素浓度过高或雷帕霉素引起的不良反应有关,仍待进一步研究证明。
本研究中,HE染色显示,雷帕霉素组大鼠子宫内膜腺体数目较多,呈簇状排列,但腺腔多小而直,部分可见到一些皱褶和分支,说明雷帕霉素能缓解PCOS大鼠子宫内膜病理形态改变。本研究结果显示,PCOS组和雷帕霉素组大鼠子宫内膜纤维化面积占比显著高于对照组,PCOS组与雷帕霉素组大鼠子宫内膜纤维化面积占比比较差异无统计学意义;这说明,PCOS大鼠子宫内膜纤维化程度较高,而雷帕霉素并未明显改善PCOS大鼠子宫内膜纤维化情况。
本研究结果显示, PCOS组大鼠子宫内膜细胞凋亡率显著高于对照组和雷帕霉素组,对照组与雷帕霉素组大鼠子宫内膜细胞凋亡率比较差异无统计学意义;说明,PCOS大鼠子宫内膜细胞凋亡增加,原因可能与mTOR通路异常激活有关。机体正常细胞凋亡可清除子宫内膜功能层的衰老细胞,从而维持内膜组织的正常结构和功能,而子宫内膜癌早期患者的子宫内膜细胞凋亡调控表现出异常[15]。
有研究表明,雷帕霉素可通过抑制mTOR信号通路,抑制始基卵泡激活,减缓始基卵泡向生长卵泡的转化速率,保护卵泡储备能力并改善排卵功能,并可减少肥胖小鼠的体质量,这为解决肥胖女性生育能力的问题带来了希望[16-17]。本研究结果显示,PCOS 组大鼠子宫内膜组织中mTOR、p-mTOR及p-p70S6 的相对表达量显著高于对照组和雷帕霉素组;雷帕霉素组大鼠子宫内膜组织中p-mTOR的相对表达量显著低于对照组;对照组与雷帕霉素组大鼠子宫内膜组织中mTOR、p-p70S6的相对表达量比较差异无统计学意义;说明雷帕霉素处理后PCOS大鼠子宫内膜组织中mTOR、p-mTOR及mTOR信号通路下游的p-p70S6水平下调,雷帕霉素可抑制 mTOR信号通路的异常激活,与YABA等[11]研究一致。
4 结论
雷帕霉素能缓解PCOS大鼠体质量增加、子宫内膜病理形态改变,减少子宫内膜细胞凋亡,其作用机制可能与抑制mTOR信号通路异常激活有关。本研究仅初步探讨了雷帕霉素对PCOS大鼠子宫内膜细胞凋亡的影响及机制,雷帕霉素对子宫内膜细胞增殖、迁移、侵袭等其他细胞过程的影响及机制尚需深入研究。
——雷帕霉素

