对映-贝壳杉烯型二萜类化合物J32对胰腺癌细胞的作用及机制
刘 胜,赵梦圆,金 巍,段长恩,可 钰
(1.新乡医学院第一附属医院普通外科,河南 卫辉 453100;2.河南医药健康技师学院,河南 开封 475006;3.郑州大学药学院,河南 郑州 450001)
胰腺癌是最常见的消化系统癌症之一,在发达国家和发展中国家均呈现发病率和病死率双高的态势[1]。胰腺癌的特点是解剖结构隐蔽,生物学侵袭性强,对常规治疗药物易产生耐药性[2]。胰腺癌的治疗选择非常有限,只有不到20%的胰腺癌患者被诊断为可切除或潜在可治愈。胰腺癌在早期阶段难以发现,大多数胰腺癌患者在发现症状时已属晚期,预后较差[3]。
冬凌草是河南省优势资源,其抗肿瘤作用是目前国内外研究的热点之一。冬凌草的化学成分主要为单萜、二萜、三萜等萜类化合物,同时还有挥发油、甾体、黄酮、生物碱等[4],其中二萜类成分是冬凌草的主要抗肿瘤活性成分[5]。目前,各学者对冬凌草甲素的研究最为普遍和全面。冬凌草甲素是一种四环二萜类化合物,可抑制胰腺癌细胞增殖,抑制胰腺癌细胞DNA、RNA和蛋白质合成,以及诱导胰腺癌细胞凋亡[6]。济源冬凌草素(Jiyuan oridonin A,JOA)为本课题组首次从济源冬凌草中分离得到的对映-贝壳杉烯型二萜,其具有较冬凌草甲素更为良好的体内外抗肿瘤细胞增殖活性,且能够升高细胞内活性氧水平和抑制铁死亡[7]。本研究旨在探讨对映-贝壳杉烯型二萜类化合物 J32对胰腺癌SW1990细胞株的作用及机制,以期为胰腺癌的基础和临床研究提供参考。
1 材料与方法
1.1 细胞、主要试剂与仪器
人胰腺癌细胞SW1990购自武汉普诺赛生命科技有限公司;化合物J32是本课题组前期以JOA为母核合成的全新结构化合物,达尔伯克改良伊格尔培养基(Dulbeco′s modified Eagle′s medium,DMEM)、结晶紫染色液、活性氧检测试剂盒、二喹啉甲酸蛋白浓度测定试剂盒购自北京索莱宝科技有限公司,蛋白酶抑制剂购自美国Biamake 公司,放射免疫沉淀(radio-immunoprecipitation,RIPA)裂解液、DNA损伤检测试剂盒购自上海碧云天生物技术有限公司,吐温-20购自北京博奥拓达科技有限公司,兔抗人单克隆抗体B细胞淋巴瘤-2相关X蛋白(B-cell lymphoma-2 associated X protein,Bax)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、β-actin、磷酸化H2组蛋白家族成员X(phosphorylated H2A histone family member X,γ-H2AX)、共济失调毛细血管扩张和Rad3相关蛋白(ataxia telangiectasia and Rad3 related protein,ATR)、细胞周期检查点激酶1(checkpoint kinase 1,Chk1)、磷酸化p53(phospho-p53,p-p53)、caspase-3、细胞周期素D1(Cyclin D1)购自武汉三鹰生物技术有限公司;CO2恒温细胞培养箱购自美国Thermo Fisher公司,稳压恒流电泳仪购自北京六一实验仪器厂,酶标仪购自美国宝特有限公司,光学显微镜购自厦门麦克奥迪公司。
1.2 实验方法
1.2.1 细胞培养及分组
将SW1990细胞置于直径为10 cm的培养皿中培养,待细胞融合度达到80%~90%时,用胰蛋白酶消化细胞,以1×1010L-1接种于5个培养皿中,每个培养皿中加入10 mL含体积分数10%胎牛血清的DMEM培养基。将细胞随机分为对照组、0.5 μmol·L-1J32组、1.0 μmol·L-1J32组、2.0 μmol·L-1J32组、4.0 μmol·L-1J32组,24 h后弃去旧培养液,并分别加入含终浓度0.0、0.5、1.0、2.0、4.0 μmol·L-1J32的DMEM培养基,继续培养24 h后,收集各组细胞进行后续实验。
1.2.2 细胞划痕试验检测细胞迁移能力
取对照组、1.0 μmol·L-1J32组、2.0 μmol·L-1J32组、 4.0 μmol·L-1J32组细胞,用胰蛋白酶消化,然后接种到6孔板中,每组设3个复孔,置于细胞培养箱中培养24 h后,弃去培养液,用100 μL枪头的尖端垂直划痕,用1 mL 磷酸盐缓冲液(phosphate buffered solation,PBS)清洗后,加入含不同浓度J32的培养基,置于37 ℃细胞培养箱中进行培养。分别于培养0、24、48 h时,置于显微镜下对各孔划线位置拍照。应用 Image J 软件测量图中空白区域面积,并计算划痕愈合率,划痕愈合率 = (0 h 空白面积-24 h或48 h 空白面积) /0 h 空白面积 ×100%,划痕愈合率越高表示细胞迁移能力越强。实验重复 3 次,取均值。
1.2.3 单克隆形成试验检测细胞增殖能力
取对照组、0.5 μmol·L-1J32组、1.0 μmol·L-1J32组细胞,以每孔1×104个细胞接种到6孔板中,置于37 ℃细胞培养箱中培养24 h后,弃去上清,沿孔壁分别加入含不同浓度J32的培养基。再将6孔板放入细胞培养箱中,每隔1~2 d更换一次培养液。当细胞呈现肉眼可见的克隆时,弃去上清,用PBS清洗3次,加入多聚甲醛固定细胞,20 min后,弃去上清,PBS清洗3次,加入结晶紫染液染色30 min,缓慢洗去染液,静置晾干,然后计数克隆形成数,并计算克隆形成率。克隆形成率=克隆形成数/接种细胞数×100%,克隆形成率越低表示J32对细胞增殖的抑制作用越强。实验重复3次,取均值。
1.2.4 流式细胞术检测细胞凋亡情况
取对照组、1.0 μmol·L-1J32组、2.0 μmol·L-1J32组、 4.0 μmol·L-1J32组细胞,用胰蛋白酶消化,以每孔1×105个细胞接种于6孔板中,置于 37 ℃细胞培养箱中培养24 h后,弃去上清,沿孔壁分别加入含不同浓度J32的培养基。将6孔板再次放入培养箱中,24 h后,将每个孔内的悬浮细胞以及胰蛋白酶消化得到的细胞合并在同一EP管中,1 000 r·min-1离心 5 min,收集细胞沉淀,用Binding Buffer将细胞沉淀吹打均匀,然后加入2 μL人膜联蛋白V-异硫氰酸荧光素(annexin V-fluorescein isothiocyanate,Annexin V-FITC)及2 μL碘化丙啶(propidium iodide,PI)染色液,涡旋混匀,放置于冰盒中,避光反应5~15 min,最后用流式细胞仪检测细胞凋亡情况。实验重复3次,取均值。
1.2.5 流式细胞术检测细胞中活性氧水平
取对照组、1.0 μmol·L-1J32组、2.0 μmol·L-1J32组、 4.0 μmol·L-1J32组细胞,用胰蛋白酶消化,然后以每孔6×104个细胞接种于6孔板中,于对数生长期时舍弃旧培养液,沿孔壁分别加入含不同浓度J32的培养基,置于培养箱中孵育 24 h 后,加入活性氧荧光探针(用无血清培养液稀释2,7-二氯荧光素二乙酸酯,终浓度为10 μmol·L-1),置于细胞培养箱中孵育20 min,用无血清培养液清洗细胞后,立即用流式细胞仪检测细胞平均荧光强度,细胞平均荧光强度越高表示细胞中活性氧水平越高。实验重复3次,取均值。
1.2.6 γ-H2AX免疫荧光法检测细胞DNA损伤程度
取对照组、1.0 μmol·L-1J32组、2.0 μmol·L-1J32组细胞,用胰蛋白酶消化,以每孔6×103个细胞接种于96孔板中,置于37 ℃培养箱内孵育24 h后,更换含不同浓度J32的培养基继续培养24 h,吸除培养液,PBS洗涤1次,每孔加入100 μL固定液,固定 5~15 min 后吸除固定液,洗涤液洗涤3次,每次 3~5 min。 每孔加入100 μL免疫染色封闭液,室温封闭10~20 min。吸除免疫染色封闭液,每孔加入50 μL γ-H2AX兔单抗,室温孵育1 h后吸出,用洗涤液洗涤3次,每次5~10 min,然后加入抗兔488,室温孵育1 h后用洗涤液洗涤2次,加入细胞核染色液4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole, DAPI)室温染色5 min左右。吸除细胞核染色液,洗涤液洗涤3次,每次3~5 min,使用荧光显微镜直接进行观察和拍照,γ-H2AX被染成绿色荧光,细胞核被DAPI染成蓝色荧光。应用Image J软件分析荧光强度值,绿色荧光强度值越高表示细胞的DNA损伤程度越高。实验重复3次,取均值。
1.2.7 流式细胞术检测细胞周期
取对照组、1.0 μmol·L-1J32组、2.0 μmol·L-1J32组细胞,用胰蛋白酶消化,以每孔2×105个细胞接种于6孔板中,37 ℃培养箱中孵育24 h后,更换为含不同浓度J32的培养基继续培养24 h,用预冷的PBS清洗细胞,胰蛋白酶消化,1 200 r·min-1离心5 min,收集细胞沉淀,用预冷PBS洗涤细胞2次,用200 μL PBS重悬细胞,加入720 μL 体积分数95%乙醇吹打混匀,4 ℃下固定8 h,2 000 r·min-1离心5 min,再用1 mL预冷PBS洗涤2次,加入 400 μL PI染色液重悬细胞,用流式细胞仪检测细胞周期。实验重复3次,取均值。
1.2.8 Western blot法检测ATR-Chk1-p53-CyclinD1通路及凋亡相关蛋白相对表达量
取对照组、1.0 μmol·L-1J32组、2.0 μmol·L-1J32组、 4.0 μmol·L-1J32组细胞, 用胰蛋白酶消化,以每个培养皿2×105个细胞接种于细胞培养皿中,然后置于37 ℃细胞培养箱中培养 24 h,弃去上清,更换为含不同浓度J32的培养基继续培养24 h,用胰蛋白酶消化,收集细胞至离心管中,加入RIPA裂解液,混合均匀后,于冰盒上裂解30 min, 4 ℃下25 000 r·min-1离心15 min,将上清转移至新的离心管中,用二喹啉甲酸法进行蛋白定量,煮沸10 min使蛋白变性,取 30 μg 蛋白进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳、转膜、脱脂牛奶封闭,加入ATR、磷酸化ATR(phospho-ATR,p-ATR)、Chk1、p-p53、CyclinD1、Bax、caspase-3、Bcl-2、β-actin一抗孵育过夜、洗膜,二抗孵育、洗膜后,显色、曝光。应用Image J软件分析条带灰度值,以目的蛋白与内参蛋白条带灰度值比值表示目的蛋白相对表达量。实验重复3次,取均值。
1.3 统计学处理
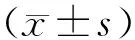
2 结果
2.1 对照组、1.0 μmol·L-1 J32组、2.0 μmol·L-1 J32组和4.0 μmol·L-1 J32组细胞迁移能力比较
培养24、48 h 时,1.0 μmol·L-1J32组、2.0 μmol·L-1J32组和4.0 μmol·L-1J32组细胞的迁移能力均显著低于对照组,2.0 μmol·L-1J32组和4.0 μmol·L-1J32组细胞的迁移能力均显著低于1.0 μmol·L-1J32组,4.0 μmol·L-1J32组细胞的迁移能力显著低于2.0 μmol·L-1J32组,差异有统计学意义(P<0.05) 。结果见图1和表1。
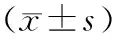
表1 对照组、1.0 μmol·L-1 J32组、2.0 μmol·L-1 J32组、4.0 μmol·L-1 J32组细胞迁移能力比较Tab.1 Comparison of the migration ability of cells among the control group,1.0 μmol·L-1 J32 group,2.0 μmol·L-1 J32 group and 4.0 μmol·L-1 J32 group

A:对照组;B:1.0 μmol·L-1 J32组;C:2.0 μmol·L-1 J32组;D:4.0 μmol·L-1 J32组。图1 对照组、1.0 μmol·L-1 J32组、2.0 μmol·L-1 J32组、4.0 μmol·L-1 J32组细胞迁移情况Fig.1 Migration of cells in the control group,1.0 μmol·L-1 J32 group,2.0 μmol·L-1 J32 group and 4.0 μmol·L-1 J32 group
2.2 对照组、0.5 μmol·L-1 J32组和1.0 μmol·L-1 J32组细胞增殖能力比较
对照组、0.5 μmol·L-1J32组、1.0 μmol·L-1J32组细胞克隆形成率分别为(72.04±8.17)%、(54.62±7.31)%、(8.39±1.72)%。0.5 μmol·L-1J32组、1.0 μmol·L-1J32组细胞的增殖能力显著低于对照组,1.0 μmol·L-1J32组细胞的增殖能力显著低于0.5 μmol·L-1J32组,差异有统计学意义(P<0.05)。
2.3 对照组、1.0 μmol·L-1 J32组、2.0 μmol·L-1 J32组和4.0 μmol·L-1 J32组细胞凋亡情况比较
对照组、1.0 μmol·L-1J32组、2.0 μmol·L-1J32组、4.0 μmol·L-1J32组细胞的凋亡率分别为(6.78±0.47)%、(17.50±1.05)%、(49.40±3.21)%、(69.70±2.42)%。 1.0 μmol·L-1J32组、2.0 μmol·L-1J32组、 4.0 μmol·L-1J32组细胞的凋亡率显著高于对照组,2.0 μmol·L-1J32组、 4.0 μmol·L-1J32组细胞的凋亡率显著高于1.0 μmol·L-1J32组,4.0 μmol·L-1J32组细胞的凋亡率显著高于2.0 μmol·L-1J32组,差异有统计学意义(P<0.05)。结果见图2。

A:对照组;B:1.0 μmol·L-1 J32组;C:2.0 μmol·L-1 J32组;D:4.0 μmol·L-1 J32组。图2 对照组、1.0 μmol·L-1 J32组、2.0 μmol·L-1 J32组、4.0 μmol·L-1 J32组细胞凋亡情况Fig.2 Cell apoptosis in the control group,1.0 μmol·L-1 J32 group,2.0 μmol·L-1 J32 group and 4.0 μmol·L-1 J32 group
2.4 对照组、1.0 μmol·L-1 J32组、2.0 μmol·L-1 J32组和4.0 μmol·L-1 J32组细胞中活性氧水平比较
对照组、1.0 μmol·L-1J32组、2.0 μmol·L-1J32组、4.0 μmol·L-1J32组细胞平均荧光强度分别为2.19±0.21、4.31±0.89、7.74±1.27、45.40±3.24。1.0 μmol·L-1J32组、2.0 μmol·L-1J32组、 4.0 μmol·L-1J32组细胞的活性氧水平显著高于对照组,2.0 μmol·L-1J32组、4.0 μmol·L-1J32组细胞的活性氧水平显著高于1.0 μmol·L-1J32组,4.0 μmol·L-1J32组细胞的活性氧水平显著高于2.0 μmol·L-1J32组,差异有统计学意义(P<0.05)。
2.5 对照组、1.0 μmol·L-1 J32组和 2.0 μmol·L-1 J32组细胞DNA损伤程度比较
对照组、1.0 μmol·L-1J32组、2.0 μmol·L-1J32组细胞的绿色荧光强度值分别为13.72±1.09、22.28±2.15、29.25±1.48。1.0 μmol·L-1J32组、2.0 μmol·L-1J32组细胞的DNA损伤程度显著高于对照组,2.0 μmol·L-1J32组细胞的DNA损伤程度显著高于1.0 μmol·L-1J32组,差异有统计学意义(P<0.05)。 结果见图3。
2.6 对照组、1.0 μmol·L-1 J32组和2.0 μmol·L-1 J32组细胞周期比较
对照组、1.0 μmol·L-1J32组、2.0 μmol·L-1J32组细胞中G1/S期细胞占比分别为(23.4±1.16)%、(46.4±2.02)%、(54.3±0.69)%。1.0 μmol·L-1J32组、2.0 μmol·L-1J32组细胞中G1/S期细胞占比显著高于对照组,2.0 μmol·L-1J32组细胞中G1/S期细胞占比显著高于1.0 μmol·L-1J32组,差异有统计学意义(P<0.05)。
2.7 对照组、1.0 μmol·L-1 J32组、2.0 μmol·L-1 J32组和4.0 μmol·L-1 J32组细胞中ATR-Chk1-p53-Cyclin D1通路及凋亡相关蛋白相对表达量比较
对照组、1.0 μmol·L-1J32组、2.0 μmol·L-1J32组、4.0 μmol·L-1J32组细胞中随着J32浓度的增加,p-ATR/ATR值及p-p53蛋白相对表达量呈升高趋势(F=25.534、3.970,P<0.05),Chk1、Cyclin D1蛋白相对表达量呈降低趋势(F=19.532、0.485,P<0.05)。1.0 μmol·L-1J32组、2.0 μmol·L-1J32组、4.0 μmol·L-1J32组细胞中p-ATR/ATR值及p-p53蛋白相对表达量显著高于对照组,2.0 μmol·L-1J32组、4.0 μmol·L-1J32组细胞中p-ATR/ATR值及p-p53蛋白相对表达量显著高于1.0 μmol·L-1J32组,4.0 μmol·L-1J32组细胞中p-ATR/ATR值及p-p53蛋白相对表达量显著高于2.0 μmol·L-1J32组,差异有统计学意义(P<0.05)。1.0 μmol·L-1J32组、2.0 μmol·L-1J32组、4.0 μmol·L-1J32组细胞中Chk1蛋白相对表达量显著低于对照组,2.0 μmol·L-1J32组细胞中Chk1蛋白相对表达量显著高于1.0 μmol·L-1J32组、4.0 μmol·L-1J32组,4.0 μmol·L-1J32组细胞中Chk1蛋白相对表达量显著低于1.0 μmol·L-1J32组,差异有统计学意义(P<0.05)。1.0 μmol·L-1J32组、2.0 μmol·L-1J32组、4.0 μmol·L-1J32组细胞中Cyclin D1蛋白相对表达量显著低于对照组,2.0 μmol·L-1J32组、4.0 μmol·L-1J32组细胞中Cyclin D1蛋白相对表达量显著低于1.0 μmol·L-1J32组,4.0 μmol·L-1J32组细胞中Cyclin D1蛋白相对表达量显著低于2.0 μmol·L-1J32组,差异有统计学意义(P<0.05)。
对照组、1.0 μmol·L-1J32组、2.0 μmol·L-1J32组、4.0 μmol·L-1J32组细胞中随着J32浓度的增加,促凋亡蛋白caspase-3、Bax的表达呈升高趋势(F=0.219、4.314,P<0.05),抗凋亡蛋白Bcl-2表达呈下降趋势(F=0.324,P<0.05)。1.0 μmol·L-1J32组、2.0 μmol·L-1J32组、4.0 μmol·L-1J32组中Bax蛋白相对表达量显著高于对照组,2.0 μmol·L-1J32组、4.0 μmol·L-1J32细胞组中Bax蛋白相对表达量显著高于1.0 μmol·L-1J32组,4 μmol·L-1J32组细胞中Bax蛋白相对表达量显著高于2.0 μmol·L-1J32组,差异有统计学意义(P<0.05)。1.0 μmol·L-1J32组、2.0 μmol·L-1J32组、4.0 μmol·L-1J32组细胞中caspase-3蛋白相对表达量显著高于对照组,2 μmol·L-1J32组细胞中caspase-3蛋白相对表达量显著低于1.0 μmol·L-1J32组、4.0 μmol·L-1J32组,4.0 μmol·L-1J32组细胞中caspase-3蛋白相对表达量显著高于1.0 μmol·L-1J32组,差异有统计学意义(P<0.05)。2.0 μmol·L-1J32组、4.0 μmol·L-1J32组细胞中Bcl-2蛋白相对表达量显著低于对照组、1.0 μmol·L-1J32组,4.0 μmol·L-1J32组细胞中Bcl-2蛋白相对表达量显著低于2.0 μmol·L-1J32组,差异有统计学意义(P<0.05);对照组与 1.0 μmol·L-1J32组细胞中Bcl-2蛋白相对表达量比较差异无统计学意义(P>0.05)。结果见图4和表2。
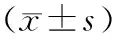
表2 对照组、1.0 μmol·L-1 J32组、2.0 μmol·L-1 J32组、4.0 μmol·L-1 J32组细胞中ATR-Chk1-p53-Cyclin D1通路及凋亡相关蛋白相对表达量比较Tab.2 Comparison of relative expression levels of ATR-Chk1-p53-Cyclin D1 pathway and apoptosis related proteins among the control group,1.0 μmol·L-1 J32 group,2.0 μmol·L-1 J32 group and 4.0 μmol·L-1 J32 group
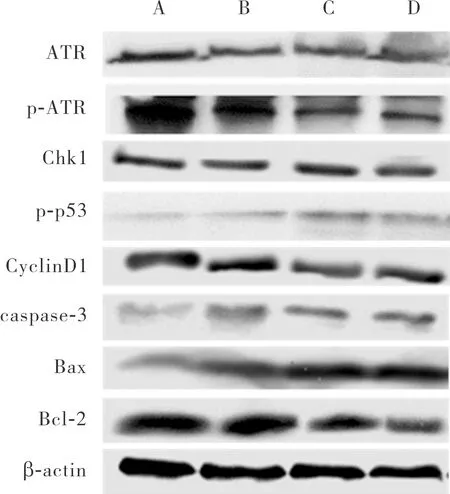
A:对照组;B:1.0 μmol·L-1 J32组;C:2.0 μmol·L-1 J32组;D:4.0 μmol·L-1 J32组。图4 对照组、1.0 μmol·L-1 J32组、2.0 μmol·L-1 J32组、4.0 μmol·L-1 J32组细胞中ATR-Chk1-p53-Cyclin D1通路及凋亡相关蛋白表达Fig.4 Expression of ATR-Chk1-p53-Cyclin D1 pathway and apoptosis related proteins in the control group,1.0 μmol·L-1 J32 group,2.0 μmol·L-1 J32 group and 4.0 μmol·L-1 J32 group
3 讨论
恶性肿瘤已成为全球第二大死因,但目前尚无有效的根治手段,胰腺癌的治疗更是临床中的难题[8-9]。中草药是天然的药物宝库,多种中草药在肿瘤治疗中具有显著的疗效。冬凌草是近年来天然抗肿瘤植物研究的热点之一,对映-贝壳杉烯型二萜是冬凌草中重要的抗肿瘤活性成分,其不仅具有良好的抗肿瘤作用,还具有抗炎、抗氧化等作用[10]。本课题组对冬凌草及其对映-贝壳杉烷型二萜化合物进行了长期研究,合成了多个对映-贝壳杉烷型二萜类化合物[11-13]。 然而,对映-贝壳杉烷型二萜类化合物对胰腺癌的作用及机制尚不明确。
本研究结果显示,培养24、48 h 时,1.0 μmol·L-1J32组、2.0 μmol·L-1J32组、4.0 μmol·L-1J32组细胞的迁移能力显著低于对照组,2.0 μmol·L-1J32组、4.0 μmol·L-1J32组细胞的迁移能力均显著低于1.0 μmol·L-1J32组,4.0 μmol·L-1J32组细胞的迁移能力显著低于2.0 μmol·L-1J32组,表明J32可抑制胰腺癌SW1990细胞的迁移能力,且这种抑制作用呈明显的浓度依赖性。本研究结果显示,0.5 μmol·L-1J32组、1.0 μmol·L-1J32组细胞的增殖能力显著低于对照组,1.0 μmol·L-1J32组细胞的增殖能力显著低于0.5 μmol·L-1J32组,表明J32对胰腺癌细胞的增殖能力具有抑制作用,并表现出明显的浓度依赖性。
本研究结果显示,1.0 μmol·L-1J32组、2.0 μmol·L-1J32组、 4.0 μmol·L-1J32组细胞的凋亡率显著高于对照组, 2.0 μmol·L-1J32组、 4.0 μmol·L-1J32组细胞的凋亡率显著高于1.0 μmol·L-1J32组,4.0 μmol·L-1J32组细胞的凋亡率显著高于2.0 μmol·L-1J32组,表明J32可呈浓度依赖性地促进胰腺癌细胞凋亡。
机体在某些应激条件下,尤其是暴露于环境氧化剂和某些导致氧化应激的药物中,可能会导致产生过量活性氧。过量的活性氧会破坏DNA、蛋白质和脂质等细胞分子,最终导致细胞死亡。本研究结果显示,1.0 μmol·L-1J32组、2.0 μmol·L-1J32组、 4.0 μmol·L-1J32组细胞的活性氧水平显著高于对照组,2.0 μmol·L-1J32组、 4.0 μmol·L-1J32组细胞的活性氧水平显著高于1.0 μmol·L-1J32组,4.0 μmol·L-1J32组细胞的活性氧水平显著高于2.0 μmol·L-1J32组,说明J32可呈浓度依赖性地提高胰腺癌细胞的活性氧水平,进而促进细胞DNA损伤及细胞凋亡的发生。
DNA的完整性对细胞至关重要,DNA发生损伤可能使细胞丧失某些生物功能甚至死亡。本研究结果显示,1.0 μmol·L-1J32组、2.0 μmol·L-1J32组细胞的DNA损伤程度显著高于对照组,2.0 μmol·L-1J32组细胞的DNA损伤程度显著高于1.0 μmol·L-1J32组,说明J32可呈浓度依赖性地导致胰腺癌细胞核内发生DNA损伤。此外,本研究结果显示,1.0 μmol·L-1J32组、2.0 μmol·L-1J32组细胞中G1/S期细胞占比显著高于对照组,2.0 μmol·L-1J32组细胞中G1/S期细胞占比显著高于1.0 μmol·L-1J32组,说明J32可将细胞周期阻滞于G1/S期。原因可能为,DNA损伤引起p53依赖的细胞周期阻滞和细胞凋亡[14],DNA损伤可诱导p53激活,p53激活可促进细胞周期调节因子转录,使细胞周期停滞在G1检查点,从而引起细胞周期停滞和凋亡[15]。 p53在DNA损伤反应(DNA damage response,DDR)中发挥重要作用,可协调多种DDR通路,是DDR和肿瘤抑制之间的关键环节[16-17]。p53相关信号通路是肿瘤的经典信号通路,有研究发现,四环二萜类代表化合物冬凌草甲素可通过调节此通路相关蛋白的表达来发挥抑制肿瘤细胞增殖或促进其凋亡的作用[18-19]。基于此,本研究探讨了J32作用于胰腺癌细胞后,p53相关的ATR-Chk1-p53-Cyclin D1通路中ATR、Chk1、p-p53、Cyclin D1蛋白、促凋亡蛋白(Bax、caspase-3)以及抗凋亡蛋白(Bcl-2)的表达变化情况。结果表明,随着J32浓度的增加,p-ATR/ATR值及p-p53蛋白表达呈升高趋势,Chk1、Cyclin D1蛋白表达呈降低趋势;促凋亡蛋白caspase-3、Bax的表达呈升高趋势,抗凋亡蛋白Bcl-2表达呈下降趋势。进一步验证了J32可促进胰腺癌细胞凋亡,此外, J32对胰腺癌细胞生物学过程的影响可能与ATR-Chk1-p53-Cyclin D1通路有关。
4 结论
对映-贝壳杉烯型二萜类化合物J32可以呈浓度依赖性地抑制胰腺癌SW1990细胞的迁移和增殖、促进细胞凋亡及细胞内活性氧水平,促进细胞发生DNA损伤及细胞周期阻滞,其作用机制可能与ATR-Chk1-p53-Cyclin D1通路有关。本研究可为进一步研究对映-贝壳杉烯型二萜类化合物的抗肿瘤作用机制及其作用靶点提供线索和思路。

