基于荧光素酶生物发光检测方法的研究及其应用进展
刘 琳,胡婷婷,王梦灵,聂 耀,张惟杰,王 琛,邹秉杰,2*,宋沁馨**,周国华
(1中国药科大学药物质量与安全预警教育部重点实验室,南京 210009;2南京大学生命分析化学国家重点实验室,南京 210093;3东部战区总医院临床药学科,南京 210002)
生物发光(bioluminescence,BL)现象是一种普遍存在于自然界中的现象,是由生物体在体内进行生物发光反应,产生可见光的现象。在大多数情况下,BL被认为是求偶、阻止捕食者和吸引猎物的一种行为[1]。它的反应底物是各种荧光素,即氧化后易于发光的小分子,是通过各种生化途径进化而来的。这些小分子的氧化是由非同源荧光素酶进行催化的,从而产生一系列不同颜色、不同催化速率、不同细胞定位以及对三磷酸腺苷(ATP)、还原型烟酰胺腺嘌呤二核苷酸磷酸(NADH)等依赖的发光反应[2]。由于该反应具有高灵敏度、高选择性和高信噪比等特点,已被广泛应用于各种生物技术和生物医学领域。一般,生物体首先通过在细胞内合成具备发光能力的物质,即荧光素。然后在细胞中特定酶的催化下,将荧光素中的化学能转化为光能,从而产生光信号。具备发光能力的有机体在自然界中有很多。由体内荧光素和荧光素酶之间的化学反应而发生的自然发光现象,是大多数陆地发光生物的遗传特征。还有一部分发光生物是通过其他各种途径来获取发光共生体,从而在海洋中产生光。例如,腔肠素是一种众所周知的荧光素,主要来源于栉水母、十足动物和桡足类动物等。而刺胞动物、甲壳类动物和深海鱼类通过多层食物链来捕获栉水母、十足动物和桡足类动物等,使自身获取荧光素。另外,一些不发光的弧菌通过水平基因转移从发光的弧菌物种中获得lux基因,从而使自己具备生物发光特性[3]。距今,大约10 000多个物种具备了在黑暗中发光的能力。
尽管BL 反应在分子水平上并未得到充分的研究,但由于其易于检测以及结果可视化的特点,已经成为现代检测技术的重要组成部分之一。其中,荧光素作为生物发光反应的关键底物,关于它的人工合成也一直在被研究和探索着。直至1905年,诺贝尔化学奖颁给了合成荧光素的研究者,从此人工合成荧光素时代拉开序幕。此后荧光染色技术被开发出来,用于特异性地标记细胞中不同的细胞器。再到2008 年,有学者从发光水母中获得绿色荧光蛋白,再次被授予诺贝尔化学奖。在此基础上,活体成像技术得到巨大发展。接下来在2014 年,超分辨率荧光显微技术获得诺贝尔化学奖,在生物发光荧光分子的作用下,通过光学显微镜技术可以观测到纳米级别的物体。
近年来,荧光素和荧光素酶的结构以及生物发光反应的作用不断被研究和改进着。因此,许多检测方法应运而生,并被广泛应用于体内外的各项研究,包括环境监测、食品检测、分子诊断、药物筛选以及各种生物医学研究。本文简要概述了荧光素和荧光素酶发光反应的原理,以及它们在实际检测中的各种应用。
1 生物发光系统
BL 是生物体通过化学反应产生光的能力,属于化学发光的范畴,是自然界令人惊奇的现象之一,存在于一些特定的细菌、真菌、昆虫、植物和海洋生物等种属中。常见的生物发光系统一般分为以下4种,见表1。

表1 4种常见生物发光系统的介绍
1.1 萤火虫荧光素系统
萤火虫荧光素系统是一组重要的生物发光反应系统,也是目前研究最彻底的一种。虫荧光素经过氧化、热解、发射光、再生成荧光素、储存、释放等一系列反应,形成循环。该过程不仅实现了发光底物的生成与储存,也在反应过程中输出了光信号。大部分反应利用的是一种称为D-荧光素的稳定且无毒的化合物发出黄色、橙色或者红色的光。图1 是萤火虫生物发光周期的6 个阶段。该系统已经在几种甲虫谱系中进化,包括萤火虫、点击甲虫和铁路蠕虫。
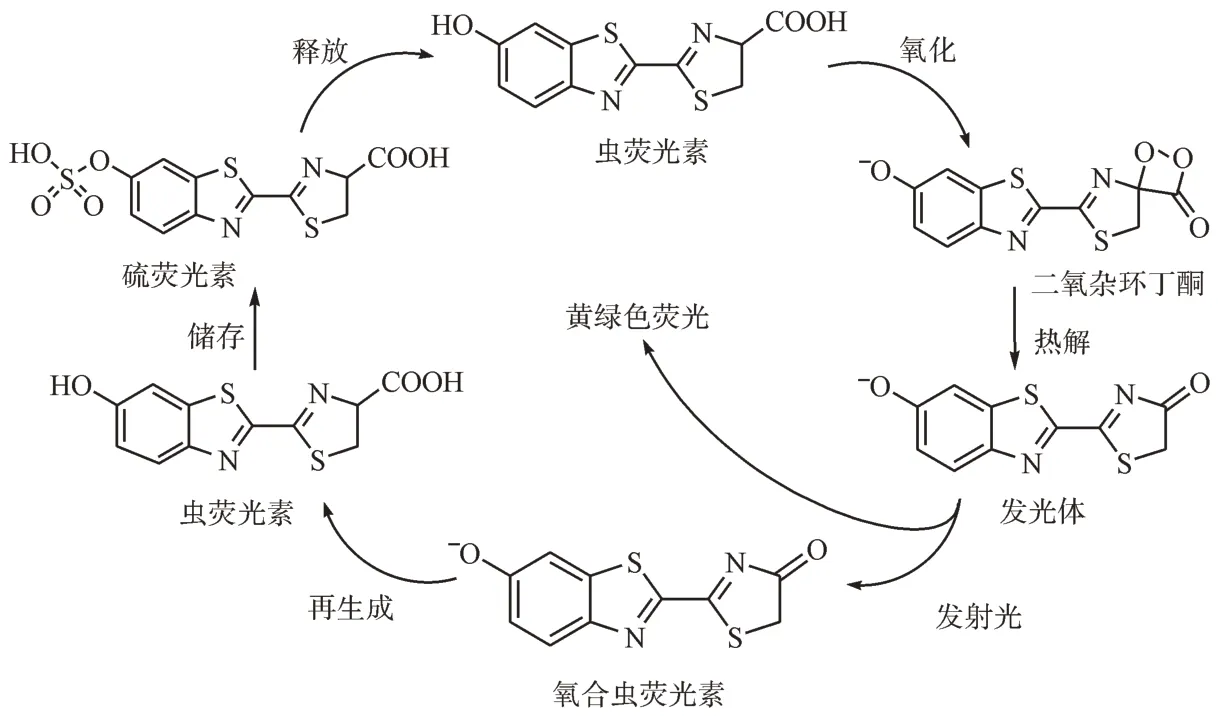
图1 萤火虫生物发光周期的6个阶段[4]
1.2 腔肠素依赖系统
海洋生态系统中存在着许多发光生物。腔肠素是一种广泛存在于海洋生物中的化学发光单分子[5],是许多独立进化的海洋生物细胞内荧光素酶作用的底物。但是大多数海洋生物本身并不合成腔肠素,而是从食物中获取。这可能就是海洋生态系统中的生物不断趋向于发光生物进化的原因。自然界中所有依赖腔肠素的发光系统都会发出蓝光,图2 是各种腔肠素依赖性的生物发光系统,通常不需要除氧气外的任何其他辅助因子,其发射最大值在450 ~ 500 nm之间。在某些情况下,与荧光素酶相互作用的荧光蛋白会改变生物发光的颜色。其他特性,如相对分子质量、pH 敏感性、热稳定性和荧光素酶的催化速率在腔肠素依赖系统之间变化也很大。
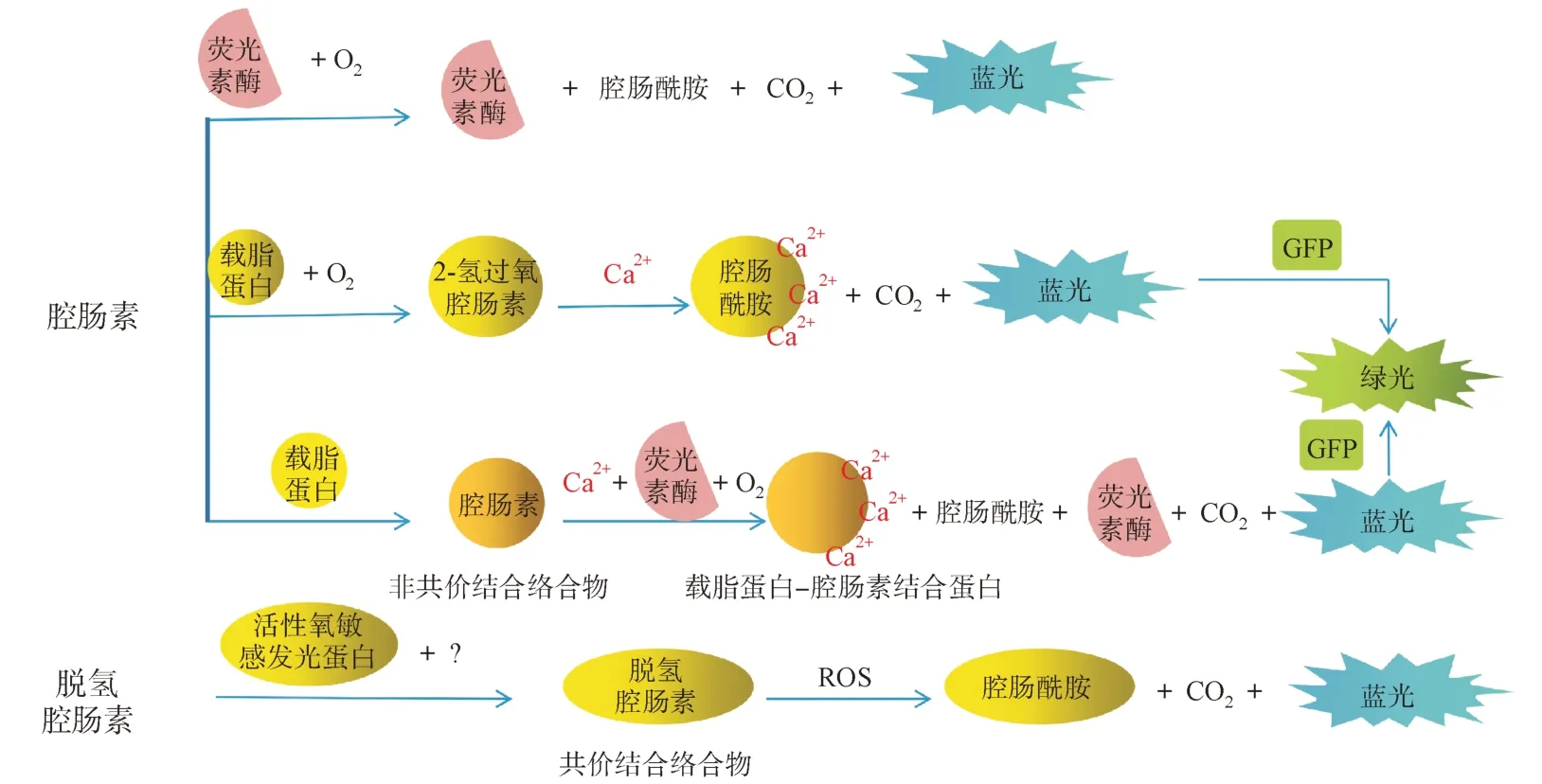
图2 各种腔肠素依赖性生物发光系统[6]
1.3 细菌生物发光系统
作为分布最广的发光生物,发光细菌在正常生理条件下发出蓝绿色光。迄今为止,已经发现了30 多种发光细菌,但只有5 种被详细研究过。这5 种发光细菌通过相同的荧光素酶催化机制(图3-A)产生生物发光。详细过程如图3-B 所示。首先,还原的黄素单核苷酸阴离子(FMNH,- R)与氧气反应生成4α-过氧羟基-5-氢黄素单核苷酸(HFOOH*, IM-1)。随后,HFOOH*与长链脂肪醛(RCHO,体内十四醛)反应得到中间体。然后,HFOOCH(OH)R 解离产生第一个单重激发态(S1态)4α- 羟基-5- 氢-FMN(HFOH*)和羧酸(RCOOH)。随即,生物发光体HFOH*去激发为HFOH 并发射光。最后,HFOH 转化为黄素单核苷酸(FMN)和水。该发光系统可以在没有外部荧光素的情况下在活细胞中产生光。由于其发光水平相对较低,进一步限制了生物发光成像的许多应用[7]。
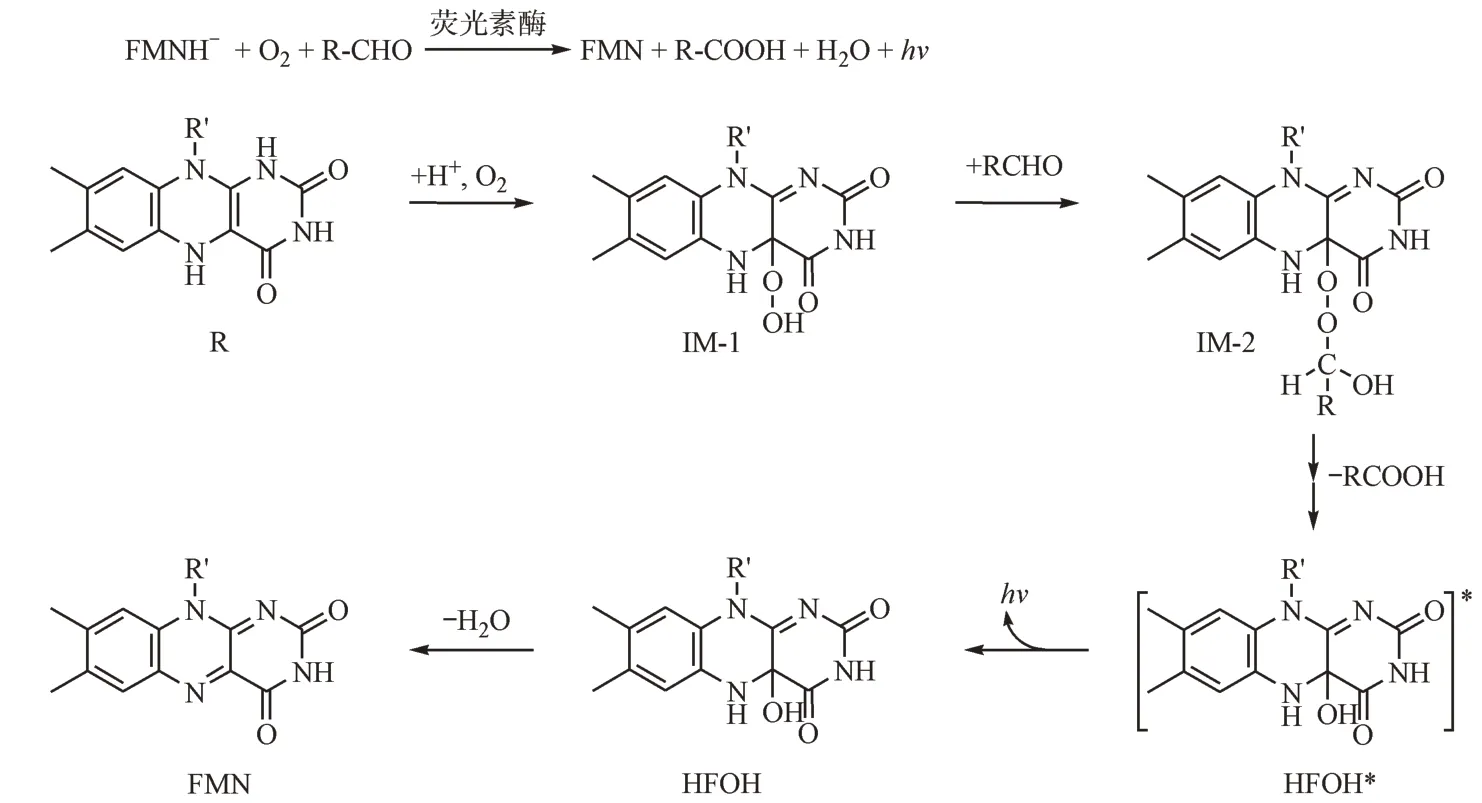
图3 细菌生物发光反应过程[8]
1.4 真菌系统
生物发光真菌的最早记录可以追溯到两千年前。距今,已发现约100 多种发光真菌,分布在9个种属中。所有报道的发光真菌都发出绿光,最大强度在520 ~ 530 nm,并且可能共享一个单一的生物发光系统。2018 年,有学者完整描述了一种在真菌中产生生物发光的生化途径,提供了第1个来自真核生物的基因可编码途径。真菌利用一种简单的化合物(α-吡喃酮)作为荧光素,在反应中被不溶性的荧光素酶氧化,只需要氧气就能使反应发出绿光。真菌荧光素生物合成和回收的途径如图4 所示,咖啡酸通过咖啡豆素合酶(HispS)转化为牛奶树碱,并被牛奶树碱3-羟基化酶(H3H)羟基化,产生3-羟基牛奶树碱,即真菌荧光素。接着荧光素酶(Luz)联合分子氧,将真菌荧光素氧化为内过氧化物,并以高能中间体的形式存在。最后,高能中间体分解为氧化荧光素(咖啡酰丙酮酸)并发射光。而氧化荧光素可通过咖啡酰丙酮酸水解酶(CPH)循环生成咖啡酸。有研究表明来自真菌生物发光系统最少3 个基因的表达就足以改造其他不发光的真核生物。Mitiouchkina 等[9]在重组真菌生物发光系统的基础上,对烟草进行改造,将咖啡酸转化为荧光素,转化后的植株可在活体生长状态下发出肉眼可见的光,即可视光。
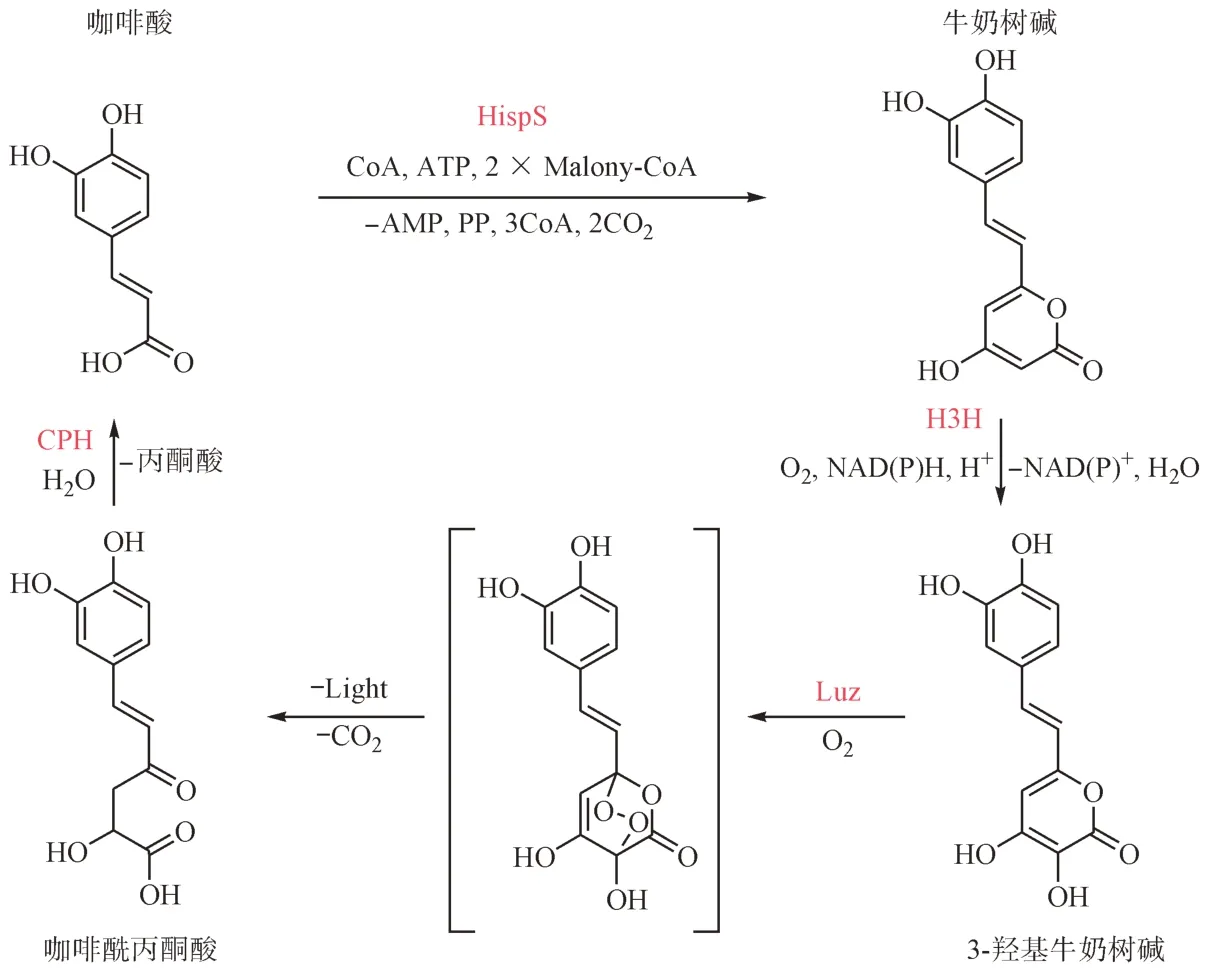
图4 真菌荧光素生物合成和回收的途径[10]
2 荧光素酶种类
荧光素酶不是一种具有特定结构的特定分子,凡是可以催化生物发光反应的酶都可以称为荧光素酶,可以是天然的,即来自生物体内的,也可以是在实验室中用基因工程的方法生成。虽然从类型上来说各不相同,但本质上都是生物发光反应的催化剂,用于催化不同的发光反应。常见的几种荧光素酶有以下4种。
2.1 虫荧光素酶
萤火虫荧光素酶和点击甲虫荧光素酶是被广泛应用的两大虫荧光素酶。
萤火虫荧光素酶:已经克隆、测序和表征了几种萤火虫荧光素酶,它们具有不同的动力学特性并在黄绿色光谱范围内引起光发射。其中一些被用作生物成像和生物传感器的分析试剂和报告基因,还有被用作细胞内pH 和有毒金属颜色调节的指示剂[11]。
点击甲虫荧光素酶:第二大流行的D-荧光素依赖性荧光素酶来源于点击甲虫。该物种使用4 种类型的荧光素酶发光,发射光最大波长在绿色(540 nm)到橙红色(593 nm)之间。其颜色可变性、对各种pH 的耐受性以及工程变体的可用性使点击甲虫荧光素酶在众多实际应用中应用广泛[12]。
2.2 高斯荧光素酶
高斯荧光素酶主要来自海洋桡足类——高斯氏菌,这是一类具有生物发光性质的海洋生物。该酶本质上是一种蛋白质,相对分子质量大约为20 kD,通常会从哺乳动物的细胞中分泌出来。在氧气的作用下,该酶能将腔肠素催化氧化,然后发出光信号。它由带有分泌信号肽的N 末端可变部分和包含10 个高度保守的Cys 残基的C 末端催化结构域组成,存在多达5个二硫键。在生物医学研究中得到了广泛应用。
2.3 海肾荧光素酶
广泛使用的腔肠素驱动的海肾荧光素酶是在40 多年前发现的,是来自珊瑚的中等大小(36 kD)胞质蛋白。在生物发光反应中可产生稳定的发光信号。但就目前来说,它通过氧化产生蓝色光子的机制仍不清楚[13]。绿色海肾(Green Renilla)荧光素酶是一种在细胞内产生的蛋白。在血清中等复杂样品中,绿色海肾荧光素酶与天然的海肾荧光素酶相比具有更高的稳定性和更好的发光强度。故选择绿色海肾荧光素酶作为报告基因进行相关检测时比天然海肾荧光素酶能获得更高的灵敏度。
2.4 海萤荧光素酶
海萤(Cypridina)荧光素酶的相对分子质量在62 kD 左右。同高斯荧光素酶相似,也是一种分泌型蛋白。绝大部分荧光素酶将分泌到细胞外。在此基础上,可通过对荧光素酶的检测从而实现对活细胞的持续监测,简单便捷。由于荧光素酶能使反应产生高信号,所以当细胞内存在未分泌的荧光素酶时,便可以通过常规的裂解方法对细胞进行检测。其次,海萤荧光素酶还可以和红色萤火虫荧光素酶组合为双色检测,实现多重检测。
3 基于荧光素酶生物发光的检测方法的开发及应用
3.1 基于虫萤光素酶和D-荧光素的ATP生物发光法
ATP 生物发光检测的反应底物有ATP 和D-荧光素。在底物量充足的情况下,当Mg2+和O2存在时,荧光素酶会催化D-荧光素氧化,从而产生荧光,荧光信号的强度与ATP 的含量在一定范围内成正比,进而可以使用光度计以超高灵敏度进行量化。ATP 生物发光检测法因其快速、简便、灵敏度高的优势,已被广泛用于现场快速检测中。目前主要应用于以下几方面。
3.1.1 微生物数量检测 ATP 是生物的主要能量来源,普遍存在于所有活的生物体中,测量 ATP是所有微生物存在与否的实时指标[14]。大部分细胞内的ATP 含量基本上是恒定的,所以ATP 的浓度便与细胞的数量成正比。理论情况下细胞的数目越多,ATP 含量就会越高,发光信号也就越高。当细胞处于凋亡、坏死或毒性状态时,ATP 水平会迅速下降。因此,细胞内ATP 的浓度,反映了微生物的活性和活细胞的数量。当ATP 浓度较低无法用于检测时,可以对其进行扩增[15]后再检测。
Ishimaru 等[16]通过比较ATP 检测法和平板计数法,发现它们基本呈正相关。但在很多方面,ATP 生物发光检测法是优于平板计数法的。就细胞可检测的状态而言,ATP法可检测具有胞内ATP的细胞,包括可培养和不可培养的细胞以及受损的细胞;而平板计数法仅能检测在琼脂培养基中培养的细胞,即可培养的活细胞。在这种情况下,ATP检测方法的对数减少可能低于平板计数方法,即ATP生物发光法比平板计数法准确度更高。
3.1.2 药敏试验 传统的基于虫荧光素酶和D-荧光素检测ATP 并用于药敏试验的方法,都是检测细胞内ATP。但有研究者认为只测定细胞内ATP,准确度有待商榷,便将细胞内ATP 与其在600 nm 处的吸收度(A600)结合起来。Heller 等[17]开发了一种药敏试验,通过利用生物发光法确定细菌释放的ATP 以及测定细菌溶液的A600来表明抗生素的抗菌效果。当细菌在生长期或在抗生素存在时会被溶解从而释放ATP,所以培养基中ATP含量增加。虽然吸收度会在生长期增加,但在细菌裂解过程中并不改变。所以用细菌达到对数生长期后的吸收度与释放的ATP 的比值即可表明抗生素的功效。随着研究的不断进步,也可以通过监测给药过程中细胞外ATP 的释放来对耐药菌进行筛选。Ihssen 等[18]构建了一种工程化的耐热荧光素酶用于实时监测细菌培养物中的细胞外ATP。该方法能够快速检测抗生素对细菌培养物的影响。因为用β-内酰胺抗生素攻击氨苄青霉素敏感菌株时,即使在细菌没有生长的情况下,也表现出强烈的胞外ATP 的积累。由此可得,基于虫荧光素酶和D-荧光素的ATP 生物发光法在药敏试验中发挥着重要作用,其操作简单、结果快速的优势使其有望在日后与传统检测方法并驾齐驱。
3.1.3 洁净度检测 食品、药品等重点产品在生产过程中对环境的洁净程度要求很高。只有对生产环境进行严格的监督和管理,才能提供洁净的环境以及生产出安全、高质量的产品。基于荧光素酶的生物发光检测ATP 的方法由于其简单快速的特点已经被广泛用于洁净度的检测中。Tršan等[19]在医院药房的洁净室中评估了ATP 生物发光方法对监测表面卫生的有用性。他们发现该方法的灵敏度适合用于评估清洁和消毒的效率,并优于传统的基于微生物培养的表面洁净度检测方法。Buczinski 等[20]使用ATP 发光法评估奶牛场用于收集和喂养初乳设备的清洁度,给出了ATP 发光法在小牛饲养过程中的相关设备洁净度检测方面具有潜在应用的结论。还有一些通过结合纳米探针和ATP 生物发光技术来快速检测食品中大肠埃希菌的方法[21]。这些研究都表明,基于荧光素酶的ATP 生物发光法能很好地用于洁净度检测中,包括食品、环境以及一些机械设备等。
3.1.4 焦磷酸测序 传统的焦磷酸测序方法,使用了4种酶。它们是用于延伸DNA 链的DNA 聚合酶、用于在腺苷5'磷酸硫酸盐(APS)存在下将PPi转化为ATP 的ATP 硫酸化酶、用于通过消耗ATP将荧光素转化为氧化荧光素而产生可见光的荧光素酶以及用于降解ATP 和未掺入的dNTPs 的腺苷三磷酸双磷酸酶。当添加的dNTP 与测序引物杂交的模板链中的碱基互补时,就会发生链延伸反应。随后ATP 生成并和荧光素酶发生反应产生光信号。光信号被检测为热解图中的峰值。每个峰的相对强度与掺入的核苷酸数量成正比。最后,核苷酸序列由掺入的核苷酸种类和热解图中的峰高确定。在以APS 为底物的荧光素酶测定中,很难检测核苷酸掺入反应期间产生的少量PPi,因为会产生很高的背景信号。从PPi 产生ATP 的另一种方法是使用PPDK和AMP,这种改进大大降低了背景信号。使用了荧光素-荧光素酶的焦磷酸测序,在准确性、系统灵活性和整个测序过程的自动化方面与其他新测序方法相比具有较多优势,使其在测序界榜上有名。
3.2 荧光酶-荧光素探针
荧光探针是一种小分子传感器,可在特定刺激时暴露出明亮的荧光,是化学、生物学领域里的强大工具。基于封闭策略,许多生物发光探针得到了很好的开发。在各种生物发光系统中,应用最广泛的生物发光系统是萤火虫荧光素系统。萤火虫荧光素系统探针已成功应用于生理过程分析、环境监测、疾病诊断、筛选候选药物,评估治疗效果等方面[22]。
3.2.1 测定细胞信号 G 蛋白偶联受体(GPCR)处G 蛋白依赖性信号级联的激活越早,对测量信号的放大效应就越小。这在精确量化激动剂功效的情况下特别有用,并且在确定与β-arrestin 途径相关的激动剂偏倚时至关重要。Littmann 等[23]开发了一种具有近端读数和足够高通量的技术,可用于检测活细胞的信号。主要是通过分裂荧光素酶互补实验(SLC)来评估Gαq蛋白及其效应物磷脂酶C-β3的相互作用。该方法具有近端读数和足够的高通量,并且可用于活细胞的检测。Nazari等[24]将来海肾荧光素酶(RLuc)与膜蛋白V 相连,开发了一类新的基于膜蛋白V 的细胞凋亡探针,以可溶的形式在大肠埃希菌BL21(DE3)中成功表达,并对纯化后的探针Rluc/AnnexinV,进行了功能检测,最后用于检测放线菌素D 诱导的Jurkat 细胞凋亡。结果表明,Rluc/Annexin V 可以与凋亡细胞结合,并且可以通过光度测量来检测海肾荧光素酶的信号。该探针可能对改善当前细胞凋亡的检测具有潜在的商业意义。以上可以看出荧光素酶在探测细胞信号中发挥着极大作用。
3.2.2 检测核酸 核酸检测方法以荧光定量PCR 最为常见,也是实验室的金标准,然而荧光素酶在核酸检测中也有一席之位。Endoh 等[25]构建了一种分子内荧光素酶互补探针,用于检测除蛋白质-蛋白质相互作用之外的目标生物分子。它由插入肽的萤火虫荧光素酶(PI-FLuc)组成,在内部分开的萤火虫荧光素酶之间含有短肽。插入的短肽通过其诱导的构象变化触发其与FLuc 互补,并随后重新激活或灭活FLuc 的活性。将RNA 与含有ARM、Rev 或Tat 的精氨酸相结合,用于模型肽插入,并使用没有小麦生殖细胞的蛋白质合成系统表达PI-FLuc 探针变体。当结合特定的RNA 靶标后,会显示FLuc 活性发生变化,重新激活或失活。Joda 等[26]基于高斯荧光素酶的生物发光设计了一种茎环状的探针,用于检测HIV-1核酸。检测过程中显示出对单个和双重错配核酸靶标的极佳选择性,低检测限以及检测人血清基质中HIV-1RNA 的能力。以及来自大肠埃希氏菌O157 的实际基因组DNA 样本也可以利用荧光素酶进行检测。
3.2.3 检测蛋白 Ozawa 等[27]基于蛋白质剪接过程设计了与萤火虫荧光素酶互补的片段,开发了一种检测哺乳动物细胞中蛋白质-蛋白质相互作用的新方法。在这种方法中,蛋白质之间相互作用会触发DnaE 内含肽的折叠,发生蛋白质剪接,从而使连接的荧光素酶的外泌蛋白恢复其酶活性。这为研究蛋白质的磷酸化和整合膜蛋白之间的相互作用提供了一种简便的方法。
3.2.4 细胞成像 生物发光成像(BLI)是新开发的非侵入性的可视化的方法,其特点为灵敏度高,分辨率和选择性高,背景信号低以及不需要外部光激发[28]。基于萤火虫荧光素-荧光素酶系统的BLI已被广泛用于肿瘤特异性酶的活性评估,包括与疾病相关的生物活性小分子和金属离子的检测以及疾病的诊断和治疗,也包括药物转运的研究,生理病理过程中[29]免疫反应的研究以及对药物效力和组织分布的评估。
3.3 荧光素酶报告基因系统
第1个报告基因系统是在20世纪80年代初期开发的,其最初目的是为了测量酶的活性(作为启动子驱动的转录活性的替代指标)以及分析特定启动子的活性(即,在与报告基因相连的特定启动子的调控下的基因表达)。该系统可以高度敏感地可视化特定启动子的活性。通常,有两类报告系统:用于细胞跟踪的组成型表达报告构系统,以及用于表征特定的组织,肿瘤或信号通路的内源信号分子和转录因子的诱导型报告系统。基于荧光素酶的报告基因系统是生物医学研究中的重要工具。在荧光素酶中,黄素依赖酶的使用最常见。
3.3.1 研究基因表达 Goodman 等[30]早在1999年就利用萤火虫荧光素酶作为报告基因,研究变形链球菌中的基因表达。在变形链球菌中测试了萤火虫荧光素酶作为报告基因的效用。在内源性启动子的控制下,荧光素酶编码序列被强烈表达,而无启动子的版本与背景是无法区分的。荧光素酶在研究基因表达的方向上,一直在不断发展。在2019 年的时候,Shan 等[31]建立了DGKθ 内源性启动子荧光素酶报告基因HepG2 细胞系,用于研究DGKθ 基因的转录调控。2020 年时开发出检测Sox9转录因子的荧光素酶报告基因[32],能定量检测活细胞中的Sox9-SUMOylation水平。
3.3.2 药物的筛选 荧光素酶报告基因具有高敏感性、特异性靶点、高通量的特点,能够进行先导化合物的筛选,使小分子有机化合物替代生物大分子作为药物成为可能,包括糖皮质激素、增值抑制剂、抗疟药物等的筛选。在新型冠状病毒大流行中,荧光素酶作为报告基因也贡献出自己的一份力量,在高通量筛选血清学检测方法和药物开发中发挥着关键作用[33]。
3.3.3 蛋白研究 近年来,随着分子生物学与基因组学的发展,出现了很多新型的基于不同水平的蛋白质的研究方法,其中荧光素酶报告基因也在这一方面逐渐发挥作用。Naylor 等[34]使用Tol2转座子系统生成了一个转基因斑马鱼系,该系使用fabp10a 肝脏特异性启动子过度表达与受体相关蛋白的D3 域融合的纳米荧光素酶分子。使用光度计,通过测量胚胎培养基中的发光强度来量化NL-D3 斑马鱼幼虫中的蛋白尿,以此进行肾功能的评估。
3.3.4 检测热原 Wang 等[35]用含有荧光素酶基因的NF-κB-RE 质粒去转染HL60 细胞,开发了一种新型荧光素酶报告基因检测热原的方法。通过用热原刺激,获得与热原浓度呈剂量依赖性的信号。由于其检测速度快、灵敏度高、操作方式方便、热原谱检测范围广等优点,有望成为检测热原的一种补充方法。
3.4 荧光素酶生物传感器
生物传感器是利用电子组件(换能器)和生物组件来研究生物体的设备。它们通常用于检查生物结构,是有前途的、值得选择性的检测设备,具备作为即时检测工具的巨大潜力。其与分子探针联用使人们能够在分子水平上研究生命系统中的生物学和病理学过程,从而将化学和生物学与医学联系起来。荧光素酶作为一种生物传感器,逐渐用于各方各面,并发挥着不可或缺的作用。
3.4.1 评估蛋白酶活性 Zhou等[36]研究了4种基于荧光素酶的生物传感器,其中包含被HAV 3Cpro或点状DnaE内含肽切割的NEMO序列(PVLKAQ↓ADIYKA),以监测人胚肾细胞(HEK)中HAV 3Cpro的活性。数据表明,开发的荧光素酶生物传感器可快速、灵敏和有效的评估HAV 3Cpro的活性。
3.4.2 检测金属离子 将生物发光用于重金属检测的生物传感器并不常见。多数通过发光用于重金属检测的生物传感器都是发射荧光的,并且依赖于发光的强度进行测量;少数是比率型的,需要依赖于光谱变化来产生信号。但萤火虫荧光素酶可以与汞和砷等金属离子偶联形成响应性启动子[37],并在生物传感器上作为光发射器。其发光光谱对重金属阳离子(例如锌和汞)和pH 非常敏感。结果表明该生物传感器可检测出对低至0.1 mmol/L的重金属,这表明了萤火虫荧光素酶生物传感器作为细胞内金属检测的潜在适用性。
3.4.3 作为示踪剂 de la Fuente等[38]描述了一种来自桡足类动物Metridia lucens的新型荧光素酶(MlLuc),并开发了一种新型生物发光的重组亲和体(MlLuc-aff),MlLuc-aff能够作为示踪剂准确检测乳腺肿瘤细胞中表达的HER2受体,有助于乳腺癌患者的早期诊断和治疗效果的评估。White等[39]开发了一种纳米荧光素酶生物传感器,用于研究内源性趋化因子的分泌以及和受体的结合,以便更好了解它们之间的功能和相互作用。利用CRISPR/Cas9 基因组编辑纳米荧光素酶片段HiBiT,用来标记趋化因子CXCL12。随后通过输出的光信号来定量监测CXCL12 的分泌。由于纳米荧光素酶互补的空间限制,可以监测标记的CXCL12与趋化因子受体或膜糖胺聚糖的结合。这些活细胞检测方法结合了纳米荧光素酶的敏感性和CRISPR/Cas9 基因组编辑功能,可实时、定量和监测低水平的天然分泌蛋白。
4 总结和展望
不同的发光反应在现代检测技术中占据了不同位置,没有任何一种生物发光系统能完全适用于所有检测和应用。在生物成像中,生物发光和基于荧光的方法的应用重叠,前者主要用于需要高动态范围、背景低或深层组织成像的实验。在细菌生物学的毒性测定和研究中,通常选择细菌生物发光系统。而药物筛选又通常采用 D-荧光素依赖性或腔肠素依赖性系统。并且在为特定应用选择荧光素-荧光素酶时,必须考虑热稳定性、最佳pH、蛋白质大小、细胞或细胞外位置、聚集特性、发射波长、强度等因素。基于荧光素酶的不同检测方法之间的比较见表2。

表2 基于荧光素酶的不同检测方法的比较
目前,基于荧光素酶生物发光的检测工具在合成生物学中的潜力只有很少一部分被挖掘出来。就发光生物体的普遍分布、发光反应在实际应用中的重要性以及其在有机化学、代谢组学和遗传学中使用的范围来看,生物发光可探索的领域还有很多。与此同时,随着每年对生物发光的光物理学、遗传学和生态学的研究,新的发光生物和光通信系统以及新的检测方法也变得更有可能。

