质膜膜泡关联蛋白的生物学功能研究进展
郭文惠,雷皓月,潘友卓,张 琦
(1.甘肃中医药大学 第一临床医学院,甘肃 兰州 730000;2.甘肃省人民医院 老年医学科,甘肃 兰州 730000)
内皮细胞是血液与组织之间的关键守门人。在正常条件下,内皮细胞调节组织的发育、稳态和代谢。在病理条件下,它与炎症和肿瘤发生密切相关[1-3]。内皮隔膜是一种约40~80 nm的亚细胞结构,对生命至关重要[4],它们存在于特定血管床的毛细血管和小静脉的内皮细胞中。隔膜是与内皮特异性结构(即窗孔、跨内皮通道、小窝和囊泡-空泡细胞器)相关的薄层蛋白质屏障,在维持血管通透性、血液及组织稳态和免疫功能方面发挥作用[5]。小窝、跨内皮通道和窗孔存在于内皮细胞子集中的亚细胞器,可调节微血管通透性[6]。质膜膜泡关联蛋白(plasmalemma vesicle-associated protein-1,PLVAP)是隔膜已知唯一的分子成分[7]。PLVAP于全身各组织广泛存在,多项研究表明 PLVAP与细胞膜流动性、内皮开窗功能、白细胞迁移以及血管生成功能相关[8-10]。PLVAP的表达和许多疾病有关,如肿瘤、非酒精性脂肪肝病、蛋白丢失性肠病、缺血性脑病及糖尿病视网膜病变[11-14]。PLVAP在这些疾病中表达上调,伴随着促血管生成或促炎反应。因此,PLVAP 除了被认为是一种内皮细胞标记物外,还被认为是一种新的治疗靶点。本文就PLVAP的结构、功能及其在病理生理过程中的作用作一综述。
1 PLVAP的蛋白结构
PLVAP是一种脊椎动物基因,是高度糖基化的Ⅱ型整合膜糖蛋白,这种蛋白质,也称为PV-1、PAL-E和MECA-32抗原[15]。PLVAP相对分子质量为55~65 k,可原位形成二聚体并在生理pH下与肝素结合[15]。在人类中,PLVAP有一个短的(27个氨基酸)细胞内尾巴和一个长的(358个氨基酸的)细胞外C端结构域[15-17]。PLVAP的胞内结构域由两段相同的短氨基酸组成:一个紧邻跨膜区(8个氨基酸),包含一个假定的小窝蛋白-1结合域[18],另一个位于N端(8个氨基酸),可能在PLVAP的生物学中起作用。胞外结构域由4个N-糖基化位点、1个靠近C端的富含脯氨酸的区域和2个大的卷曲螺旋结构域组成。卷曲螺旋结构域的α螺旋的每7个氨基酸都是疏水的,以促进分子间超螺旋的形成[19]。见图1。
PLVAP是以八角形的轮状对称性排列在隔膜中,PLVAP二聚体可形成放射状纤维[18]。PLVAP大部分由其细胞外结构域组成,跨膜结构域占PLVAP总质量的15%,通过跨膜结构域附近的显著糖基化位点防止PLVAP二聚体塌陷[19]。此外,细胞内通过直接结合或细胞骨架连接分子与细胞骨架的连接,进一步稳定膜内PLVAP。
2 PLVAP的蛋白表达模式
PLVAP基因编码于哺乳动物中高度保守的蛋白质家族,PLVAP mRNA在大多数器官和组织中表达,在肺、肾、脾、所有内分泌腺和消化道中水平最高[15],在大血管、心脏、骨骼肌、皮肤、脑和睾丸中的水平适中[19]。遗传谱系显示PLVAP在心内膜的毛细血管和小静脉的内皮细胞中特异性表达,而在淋巴管内皮细胞中不存在。然而,也有研究发现在外周淋巴结的窦淋巴管内皮细胞中证实了PLVAP表达,同时证实了在其他的外周淋巴管中不存在[7]。
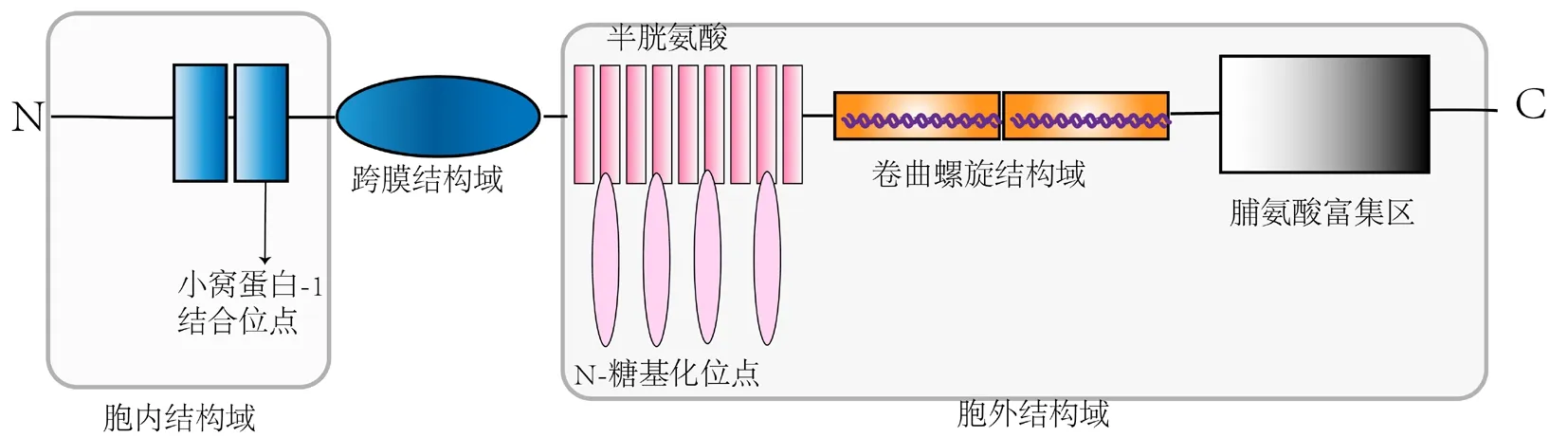
图1 PLVAP的蛋白结构
3 PLVAP的调控
血管内皮生长因子(vascular endothelial growth factor,VEGF)可刺激血管通透性增加和血管生成,是PLVAP的主要调节因子。多项研究表明,VEGF正向调节PLVAP的表达。Strickland等[20]证明VEGF通过激活VEGF受体2增加了人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)上PLVAP的mRNA和蛋白质表达水平,用磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)抑制剂LY294002或p38丝裂原活化的蛋白激酶(p38 mitogen-activatedprotein kinase,P38 MAPK)抑制剂SB203580可导致PLVAP表达水平降低。因此推测VEGF诱导PLVAP的表达可能与PI3K和P38 MAPK信号通路有关。与此相一致,Hofman等[21]研究得出微血管渗漏条件下视网膜内皮细胞上PLVAP表达增加与VEGF有关,提示VEGF可直接或间接诱导PLVAP。然而,关于VEGF调节PLVAP的表达也有争议。有研究表明在小窝蛋白-1缺失的小鼠中肺PLVAP的表达受到负向调控,而相同实验条件下,小窝蛋白-2缺失的小鼠PLVAP的表达未受影响[22]。引起这些结果的原因可能与其他内皮蛋白,如小窝蛋白-1有关。此外,VEGF对PLVAP表达的影响可能因不同器官或者不同物种而异。
肉豆蔻酸佛波醇(phorbol myristate acetate,PMA)是蛋白激酶C的激活剂,PLVAP的表达已被证明受PMA的调节[22]。PMA在原代培养的内皮细胞中可以诱导大量窗孔、跨内皮通道和小窝形成[23]。除此之外,PMA还可诱导PLVAP的表达。有研究用PMA作用于HUVECs,PLVAP mRNA显著增加;然而,当存在蛋白质合成抑制剂环己酰亚胺(cycloheximide,CHX)的情况下,PLVAP mRNA及蛋白质表达没有增加。在下游通路方面,抑制丝裂原活化蛋白激酶激酶1(mitogen-activated proteinkinase kinase 1,MEK1)/细胞外信号调节激酶1/2(extracellular regulated protein kinases 1/2,ERK1/2)抑制PLVAP的上调,而抑制p38和JNK MAP激酶或PI3K和Akt对PMA诱导的PLVAP表达无影响。因此,可推断PMA上调PLVAP是通过MEK1/Erk1/2信号通路来发挥作用[24]。总之,VEGF与其他分泌蛋白协同作用,以MEK1/Erk1/2依赖性方式上调PLVAP,使我们进一步了解内皮隔膜的基本结构PLVAP的起源。见图2。
VEGF通过激活PI3K和P38MAPK信号通路刺激PLVAP的表达。PI3K抑制剂LY294002和P38MAPK抑制剂SB203580降低PLVAP的mRNA和蛋白表达水平。PMA通过激活MEK1和ERK1/2信号通路刺激PLVAP的表达,并诱导窗孔、跨内皮通道和窗孔生成。
在最近的研究中发现,刺激性G蛋白α亚基(stimulatory G-protein α subunit,Gsα)通过环磷酸腺苷cAMP/cAMP反应元件结合蛋白(cyclic-AMP response binding protein,CREB)信号传导刺激PLVAP基因表达[25]。
此外,PLVAP还受血管紧张素Ⅱ[26]、WNT/β-连环蛋白信号[14]、Notch信号[27]、转化生长因子-β、炎症介质如肿瘤坏死因子-β和剪切应力等的调控[28]。
4 PLVAP的生理功能
4.1PLVAP 形成气孔隔膜和窗孔隔膜 PLVAP是气孔隔膜和窗孔隔膜的唯一已知的分子组分,可形成同源二聚体[15,29]。PMA作用于内皮细胞后,PLVAP的表达上调与气孔和窗孔的形成有关,这些气孔和窗孔被证明含有PLVAP[29]。此外,PLVAP基因沉默后会抑制小窝、跨内皮细胞通道和窗孔的隔膜形成[30]。PLVAP基因敲除后导致了气孔隔膜和窗孔隔膜的完全缺失。这些发现提示,内皮细胞中气孔隔膜和窗孔隔膜的形成需要PLVAP。目前,尚不清楚PLVAP是否是隔膜中存在的唯一蛋白质。

图2 PLVAP表达的调控
4.2PLVAP调节血管通透性 PLVAP对于生成跨越内皮细胞小窝颈部区域的辐条状隔膜结构至关重要。Stan等[5]证明了在BALB/c-C57BL/6J-129Sv/J混合背景的小鼠中,敲除PLVAP基因会由于缺乏隔膜而导致小鼠存活率降低。因为隔膜的丧失破坏了窗孔上毛细血管的屏障功能,血浆蛋白大量丢失,从而导致低蛋白血症、高甘油三酯血症和乳糜微粒残留物的血浆浓度增加,最终小鼠由于严重的肠道、肾脏和胰腺水肿而死亡。因此,PLVAP对血管通透性的调节可能由于其屏障功能而起着至关重要的作用。
在连续型血管内皮中,烧瓶状小窝的颈部(脑和骨骼肌除外)被一个5~7nm的隔膜所覆盖[5]。小窝隔膜在小窝的形成、形态和运输中的作用仍然知之甚少[4]。现已知这些隔膜的唯一蛋白质组分是PLVAP,能产生高度有序的寡聚体,负责隔膜的形成[5,29]。有研究发现敲除内皮细胞特异性PLVAP基因小鼠会出现腹腔积液和肺部出血,肺血管外水分含量也明显高于对照组,且观察到肺对液体和白蛋白的内皮通透性增加[31]。Jones等[32]研究表明在敲除PLVAP基因的小鼠中,可观察到小窝隔膜的丢失及肺血管对液体和白蛋白的通透性增加。由于水和蛋白质的渗出而导致动脉压降低,包括肺在内的多个组织的水肿形成。还观察到,在内毒素导致的小鼠急性肺损伤模型中,PLVAP的表达显著减少,因此肺内皮细胞的通透性增加。基于上述研究,我们推测PLVAP的主要功能是通过限制血浆蛋白如白蛋白进入小窝并通过内皮屏障转运的能力来调节肺内皮通透性。这些结果共同表明,PLVAP是小窝隔膜的关键组成部分,是白蛋白摄取的关键限制性屏障,也是肺血管内皮细胞通透性的决定因素。
PLVAP是内皮血管通透性的重要调节因子。在胚胎发生过程中,PLVAP可直接促进血管生成或为毛细血管提供机械支持。在成熟的血管系统中,PLVAP具有关键的把关功能,允许小分子进入,但限制血浆蛋白的通过。
4.3PLVAP在免疫中发挥作用 免疫反应的发展与内皮细胞介导的白细胞迁移到炎症部位有关。抑制PLVAP可减轻体内炎症。在小鼠急性腹膜炎模型中,用PLVAP抗体MECA-32,可使白细胞迁移减少约85%,且中性粒细胞、巨噬细胞和淋巴细胞的数量均显著减少。TNFα激活HUVECs,导致PLVAP重新分布到细胞的外周区域。此外,使用抗PLVAP抗体可显著抑制淋巴细胞通过内皮细胞层的迁移,而滚动和黏附不受影响。这些结果表明,PLVAP是一种控制白细胞转运的重要功能分子[10]。
PLVAP是在覆盖远端管道的窦壁淋巴管内皮细胞中合成的一种血管原型内皮蛋白,可调节可溶性淋巴抗原选择性地进入导管和淋巴细胞,通过淋巴窦底部迁移到淋巴结实质。从机制上讲,淋巴窦内皮的过滤功能依赖于PLVAP在内皮通道中形成的隔膜。因此,PLVAP 在淋巴窦中形成了一个物理筛子,可调节淋巴细胞和可溶性抗原的进入。敲除PLVAP基因的小鼠表现出通过窦底的淋巴细胞迁移增加。同样,因PLVAP缺失而隔膜无法形成的情况下,淋巴细胞向外周淋巴结的迁移也会增加[7]。当PLVAP形成的隔膜与抗体相互作用时,在窦-皮层界面处禁止淋巴细胞进入淋巴结。这些结果表明,淋巴细胞和抗原选择性进入淋巴结需要PLVAP,且淋巴细胞通过淋巴结窦-皮质界面的迁移是由PLVAP介导的[7]。
综上,PLVAP通过促进炎症部位的白细胞渗出、控制外周淋巴结形态和可溶性抗原进入淋巴结导管而在免疫中发挥作用[33]。
5 PLVAP与疾病
5.1肿瘤 关于癌组织,首次在恶性胶质瘤微血管中观察到PLVAP与窗孔增加、灌注不良和高渗透性有关[34]。PLVAP通常在成人肺、肾和内分泌组织中表达,但在中枢神经系统中被抑制,并与血脑屏障的完整性有关。Carson-Walte等[35]研究表明,PLVAP在多形性胶质母细胞瘤患者的内皮细胞中显著上调,但在颞叶癫痫患者(非肿瘤对照)中表达降低,且发现在HUVECs上PLVAP表达是上调的,证实了中枢神经系统恶性肿瘤和PLVAP表达之间的直接联系[36]。此外,发现了VEGF和肝细胞生长因子可诱导PLVAP表达,这表明神经胶质瘤分泌这些生长因子可能会增加PLVAP的表达。Wang等[37]研究发现与非肿瘤组织相比,胆管癌组织中的PLVAP表达水平显著更高。另外,熊志勇等[38]研究了肝癌组织及癌旁组织中PLVAP的表达水平,结果显示肝癌组织中PLVAP明显高于癌旁组织。因此,证明了PLVAP表达水平与肝癌的发生发展密切相关。除上述疾病,在近年来的研究中发现,PLVAP与结直肠癌[39]、胰腺癌[40]、黑色素瘤[41]均相关。PLVAP在肿瘤中广泛表达,原因可能是PLVAP通过VEGF促进了血管生长。
5.2中枢神经系统疾病 血脑屏障完整性是维持神经元功能所需微环境的关键[42]。血脑屏障的缺陷会导致神经系统疾病。Laksitorini等[14]研究证明将乙醇作用于永生化人脑微血管内皮细胞,可导致Wnt/β-连环蛋白信号的下调、紧密连接蛋白表达的减少和PLVAP的上调。而Wnt/β-catenin 信号可以改善脑内皮细胞血脑屏障表型,导致PLVAP下调。在缺血性脑病中,血脑屏障受损导致微血管通透性增加和细胞外积液,从而出现脑缺血、缺氧并最终导致死亡。在急性缺血患者的脑组织中检测到PLVAP表达上调,推测PLVAP可能在缺氧环境下表达[43]。在患有局灶性脑缺血的C57/B6小鼠模型中,可观察到PLVAP染色为阳性,并且5天后检测到PLVAP显著上调。此外,有PLVAP阳性表达的细胞均位于缺血性损伤周围的区域[43]。
5.3肝脏疾病 有研究表明PLVAP与肝窦功能障碍有关。Herrnberger等[44]研究敲除PLVAP基因,细胞窗孔结构内膜、小窝和跨膜通道的形成均受损。通过敲除PLVAP基因的C57BL/6N小鼠研究表明:肝脏 PLVAP的缺乏导致肝脏毛细血管床数量显著减少,肝窦内皮窗孔形成受损,窗孔数量明显减少,小鼠出现明显的高脂血症,肝脏发生广泛的脂肪变性和脂肪性肝炎。Desroches-Castan等[45]研究发现,敲除骨形成发生蛋白9(bone morphogenetic proteins,BMP9)基因的小鼠PLVAP表达下调,窗孔数量显著减少,在肝窦内皮细胞中加入BMP9可以维持PLVAP的水平,控制去窗孔化,从而防止血管周围肝纤维化。以上研究提示 PLVAP在肝窦内皮细胞窗孔调节、基底膜形成、脂质运输及肝窦功能中起重要作用。
5.4蛋白丢失性肠病 蛋白丢失性肠病(protein-Losing enteropathy,PLE)是由于黏膜完整性破坏或淋巴管异常导致胃肠蛋白渗出,其主要特点是低蛋白血症和高甘油三酯血症。已有多例病例报告报道了PLVAP基因突变引起PLE。PLVAP的缺失导致内皮窗孔隔膜的破坏。因此,PLVAP突变导致内皮窗孔隔膜缺失,血浆蛋白渗出过多从而导致蛋白丢失性肠病,最终死亡[46]。
5.5糖尿病黄斑水肿 VEGF等因素诱导的血视网膜屏障(blood-retinal barrier,BRB)特性丧失是糖尿病性黄斑水肿(diabetic macular edema,DME)的重要原因[46]。在之前研究中发现视网膜毛细血管中PLVAP的表达与BRB破坏有关,并且与DME中血管通透性增加相关。DME是糖尿病视网膜病变患者最常见的视力丧失原因[47]。BRB的破坏会导致蛋白和液体异常流入视网膜组织,从而导致中心凹增厚和视力丧失。VEGF-A是血管通透性和血管生成的有效诱导剂,是这一过程中的主要介体[48-49]。为了模拟DME体内的病理生理,用VEGF刺激牛视网膜血管内皮细胞,小窝蛋白-1和PLVAP mRNA表达水平增加[50]。此外,以细胞为基础的酶联免疫吸附试验检测到,VEGF作用于牛视网膜血管内皮细胞72h后PLVAP含量显著增加[51]。Wisniewska-Kruk等[52]研究使用慢病毒转染的shRAN或siRNA来抑制小鼠PLVAP的表达,会导致体内和体外VEGF诱导的荧光示踪剂BRB通透性的降低。PLVAP在正常BRB中表达很低,但高糖和VEGF可诱导其表达,导致通透性会增加。根据以上研究表明,PLVAP在调节BRB的通透性方面发挥重要作用。见表1。

表1 PLVAP与相关疾病
6 PLVAP作为治疗靶点
由于PLVAP可促进癌症中的血管生长,因此它被认为是癌症治疗的新靶点[35]。PLVAP与多种肿瘤的血管生成有关,体内PLVAP靶向治疗已被证明对肝细胞癌和胰腺癌有效[40,53]。PLVAP被鉴定为在肝细胞癌血管内皮细胞中特异性表达且在非肿瘤肝组织中不表达的基因,将人组织因子(human tissue factor,TF)胞外结构域的重组单克隆抗PLVAP抗原结合片段(antigen-binding fragment,Fab)输注到主要的肿瘤供血动脉中,可诱导肿瘤血管血栓形成和广泛的肿瘤坏死。这项研究的结果表明,抗PLVAP Fab-TF可用于治疗目前使用经导管动脉化疗栓塞的肝细胞癌病例,并可能避免化疗栓塞乳剂黏度高的缺点,从而改善治疗效果。抗PLVAP Fab-TF 可能成为晚期肝脏疾病和肝功能受损患者的可行治疗剂[53]。Wang等[37]研究发现胆管癌细胞中PLVAP表达上调,且增加了内皮细胞的血管生成,可能与PI3K/蛋白激酶Bα,(protein kinase B α,Akt)/细胞骨架相关膜蛋白4(cytoskeleton-associated membrane protein,CKAP4)相关,证明了携带CKAP4和PLVAP过表达的肿瘤患者预后不良。因此,Dickkopf相关蛋白1(dickkopf-related protein 1,DKK1)/CKAP4/PI3K/PLVAP通路增加胆管癌的血管生成,是潜在的抗血管生成靶点。
除了肝癌、胆管癌,抗PLVAP Fab-TF 还可能用于治疗恶性胶质瘤。PLVAP在各类肿瘤中均有表达,因此也可以在这些疾病中被确定为一种可能的治疗靶点。
除了作为肿瘤疾病的治疗靶点,PLVAP疗法作为DME更安全的新型治疗具有巨大潜力[54]。PLVAP在BRB病理状态下的选择性表达,使PLVAP成为预防DME的一种新的有希望的治疗靶点。
以RNA为基础的治疗是新兴的和有前途的一类药物,但技术障碍阻碍了这些药物的广泛应用。脂质纳米粒(lipid nanoparticles,LNPs)作为非常有前景的多种治疗剂载体,已备受关注。因PLVAP维持血管完整性且与小窝蛋白有关联,在肺中高表达,将LNP包裹的mRNA与抗体共价结合,特异性结合PLVAP作为靶向肺组织的手段,以包裹mRNA的非靶向抗体同型LNP作为对照。Li 等[55]研究发现与对照LNPs相比,PLVAP靶向LNPs的全身给药显示mRNA向肺部的递送显著增加,并使肺部蛋白质表达提高了40倍。将 mRNA 靶向递送至肺部是治疗肺部疾病的一种有前途的方法。同样的,Marchetti等[56]研究发现在博莱霉素诱导的特发性肺纤维化小鼠模型中,αPV1与前列腺素E2(一种已知的抗纤维化剂)偶联显著降低了胶原蛋白含量和纤维化,而非靶向前列腺素E2抗体偶联物未能减缓纤维化进展。结果表明,PLVAP靶向给药可用于向肺部提供治疗,这种方法可能适用于各种肺部疾病。
除作为上述疾病的治疗靶点,PLVAP在日本脑炎病毒感染的小鼠脑和神经细胞中均显著上调,将PLVAP基因沉默后可致病毒载量减少,表明PLVAP是控制日本脑炎病毒进入和神经元中繁殖的关键细胞受体[57]。关于PLVAP作为疾病的治疗靶点见表2。

表2 PLVAP作为疾病治疗的靶点
7 小结
PLVAP被确定为某些内皮细胞窗孔和小窝相关的隔膜结构成分,由于小窝、跨内皮通道和窗孔都被认为与内皮细胞通透性和(或)跨内皮转运有关,因此PLVAP不仅具有结构重要性,而且还可能参与调节内皮细胞通透性和运输。PLVAP具有血管内皮特异功能,PLVAP基因缺失的小鼠由于严重的肠病和肠道、肾脏和胰腺水肿而过早死亡,这可能是因为小窝横隔膜丢失以及增加了肺血管液体和蛋白质的通透性。PLVAP还在免疫中发挥着重要作用。PLVAP存在于淋巴窦的淋巴管内皮细胞中,形成了一个物理筛子,有助于抗原和淋巴细胞从淋巴窦选择性进入淋巴结实质。
在病理发展过程中,PLVAP参与了肿瘤、肝脏疾病、PLE、DME等多种疾病的发生,可能是因为PLVAP参与对血管屏障的破坏、促进了血管生成,且导致血管通透性增加。且近年来研究发现PLVAP在多种疾病中可作为治疗靶点。但对于PLVAP的产生机制、作用通路等问题还不够明确,需要进一步的研究。随着未来对PLVAP更加深入的研究,PLVAP有望为成为靶向药物提供新的思路。

