特殊临床表现多系统免疫相关不良事件1例
李 阳,默 峰,辛志飞,王 倩,邓新娜
(河北省人民医院 a.肿瘤四科;b.神经外三科;c.胸外科,河北 石家庄 050051)
卡瑞利珠单抗目前已经在多个实体瘤中获批适应症。2021年ELCC大会公布的CameL-sq研究[1]显示出卡瑞利珠单抗联合化疗对鳞状NSCLC患者中的显著获益。免疫检查点抑制剂在抗肿瘤的同时,还可能使活化的T细胞诱发自身免疫相关炎症产生免疫检查点抑制剂治疗相关不良事件(immune-related adverse events,ir AEs),是除疗效外的免疫治疗新的挑战其发生率≤30%[2]。常见有皮肤、胃肠、肝脏及内分泌毒性。本文报道1例甲状腺转移的肺鳞癌患者在使用卡瑞利珠单抗后出现特殊表现免疫相关性肺炎,同时伴有免疫相关性甲状腺功能减退及肝功能损伤。
1 临床资料
患者,男,63岁,体质量指数(BMI)25.39,主因“咳嗽、咳痰,痰中带血2月”于2021年12月21日就诊。入院后完善头颅MRI、PET/CT提示,脑、甲状腺、双肺、淋巴结、左肾上腺及左侧胸膜多发转移(图1)。支气管镜结合免疫组化染色(图2),支持鳞状细胞癌。左侧甲状腺穿刺活检病理(图3)支持鳞状细胞癌。初步诊断:左肺鳞癌IV期(cT4N3M1)。治疗前排除了自身免疫病及免疫治疗禁忌。查甲功六项未见异常。甲状旁腺素:<0.127 pmol/L,完善NGS基因检测未见突变。免疫组化PD-L1表达检测,检测结果阳性。肿瘤细胞阳性比例(TPS)或阳性联合分数(CPS)均为15%。
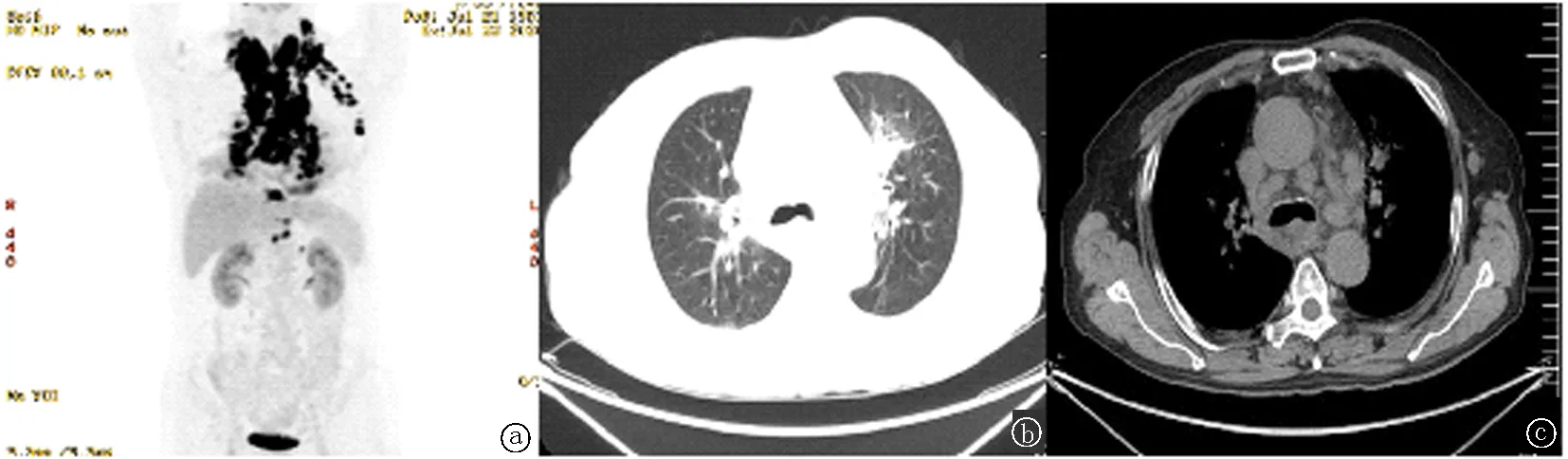
图1 免疫治疗前的影像学表现(2021-12-22) a.免疫治疗前PET/CT;b,c.免疫治疗前肺部CTFig.1 Imaging findings before immunotherapy (2021-12-22) a.Pre-immunotherapy PET/CT;b,c.Pre-immunotherapy CT
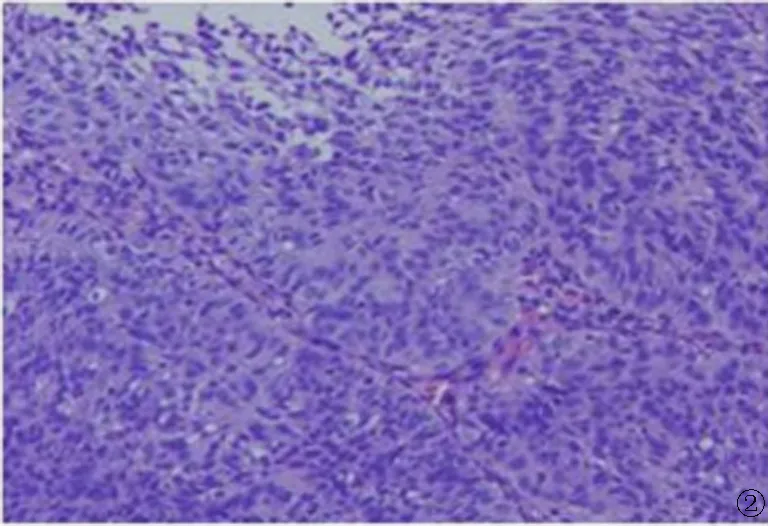
图2 肺病理切片(HE×10)Fig.2 Lung pathological section(HE×10)
患者于2021年12月31日、2022年1月21日应用卡瑞利珠单抗(d1 200 mg 1次/3周)+紫杉醇白蛋白结合型(d2 300 mg)+奈达铂(d2-3 60 mg)联合治疗。2022年1月22日首次给予卡瑞利珠单抗后第23天(D23),患者晨起出现乏力,后突发喘憋,咳大量白色泡沫样痰液。最初考虑急性心力衰竭,查心肌酶、肌钙蛋白、心脏彩色超声均不支持。血气分析正常。甲状腺功能:总T3 (TT3):1.45 nmol/L,总T4(TT4)48.98 nmol/L,游离T3(FT3)3.05 pmol/L,游离T4(FT4)8.99 pmol/L,促甲状腺激素(TSH)21.58 mIU/L。考虑甲状腺功能减退,免疫相关内分泌毒性分级G2,给予左甲状腺素钠片50 μg/d治疗。2022年1月22日下午患者间断剧烈咳嗽,反复咳出大量白色絮状蛋花汤样痰。查降钙素原(PCT)、血沉、血常规均未见异常。痰细菌培养结果:无致病菌生长。C反应蛋白38.23 mg/L;白介素6:38.55 μg/L均增高。血气分析提示低氧血症。查胸部CT示(2022-01-22):双肺多发炎症。考虑免疫性肺炎。给予甲泼尼松龙琥珀酸钠150 mg/d冲击治疗。2022年01月27日(D28)患者剧烈咳嗽,咯大量黄白色豆腐渣样痰(图4)。PCT、血常规均未见异常,C反应蛋白40.25 mg/L。2022年01月28日(D29),患者出现食欲下降,恶心,尿色发黄。查生化全项提示肝功能损伤,考虑药物性肝损伤,免疫相关性不良反应可能性大,免疫相关性肝炎为G2。加用双环醇、还原性谷胱甘肽等保肝治疗。复查胸部CT(2022-01-28):双肺多发炎症,较2022-1-22范围增大。考虑免疫相关性肺炎G3级。2022年02月04日(D36),患者仍有黄白色豆腐渣样痰。复查血常规、血沉、PCT、CRP及真菌D未见异常。支气管镜检查(图5):左主支气管可见少量类豆腐渣样分泌物。(痰)包埋切片(图6):查见少量淋巴细胞及坏死组织。免疫组化染色:CD3(部分+),CD20(部分+),CD4(少量+),CD8(少量+)。特殊染色:PAS(-),PASM(-),抗酸染色:未查见抗酸杆菌。复查胸部CT(2022-02-04):双肺多发炎症,左肺上叶病变较(2022-01-28)范围稍缩小。2022年2月9日(D41),患者咳嗽、喘憋等症状逐渐好转,但仍咯少量黄白豆腐渣样痰,激素减至甲强龙80 mg/d。2022年2月14日(D46),激素减至40 mg/d,复查生化,肝功能恢复正常。患者全程治疗期间均未出现发热,出院。2022年02月19日(D51),复查CT肺内炎症明显减轻,肺内病灶较前缩小。患者一般状况恢复差,仍存在疲乏,未再启动免疫及全身化疗。激素减量至32 mg/d。3周后减至8 mg/d,2022年3月19日(D79)完全停止激素使用。激素停用后,患者复查肿瘤无明显进展。复查甲状腺功能:总T3 (TT3)1.46 nmol/L,总T4(TT4)105.00 nmol/L,游离T3(FT3)3.8 pmol/L,游离T4(FT4)18.51 pmol/L,促甲状腺激素(TSH)11.58 mIU/L。后续患者一般状况恢复差,肿瘤无明显进展,但出现多脏器衰竭死亡(图7~8)。

图4 痰
2 讨 论
免疫检查点抑制剂治疗后可能会有个别患者出现涉及多系统的免疫相关不良反应。出现多系统免疫相关不良反应的发病率、患者的临床特点及具体治疗方式仍不明确。虽然目前免疫相关不良反应发生的确切病理生理机制尚不明确,但可以肯定的是与免疫检查点抑制剂激活了患者免疫系统,产生过度免疫应答有关。有研究认为,免疫检查点抑制剂使巨噬细胞和效应T细胞之间的PD-1/PD-L1信号通路阻断,效应T细胞过度活化可能是引起免疫相关性肺炎发生的原因[3]。Weber等[4]研究发现,经PD-1/PD-L1抑制剂治疗的患者发生免疫相关性不良反应的正常组织中,可以观察到淋巴细胞的浸润和激活。
本例患者为晚期肺鳞癌,存在多发远处转移。肺鳞状细胞癌发生甲状腺转移临床较为罕见,一般以甲状腺包块就诊,发病率仅占甲状腺恶性肿瘤的0.12%,预后较差[5-6]。Chung等[7]研究发现,约59.7%甲状腺转移癌发现时已经出现其他部位转移。该患者除存在甲状腺转移,还同时发现脑、淋巴结、肾上腺及胸膜等转移与文献结论一致。
第二次应用免疫联合化疗后出现甲状腺功能减退及症状较罕见的免疫相关性肺炎,后在治疗过程中出现一过性肝损伤。查阅国内外文献均未见类似症状报道。目前,免疫相关性肺炎报道的临床表现主要为呼吸困难、咳嗽及低热等肺炎常见症状或无明显症状,多在复查肺部CT时发现,中位发病时间2.8月[8]。有研究显示,50%以上的免疫相关性肺炎发生时伴有皮疹、关节炎、甲状腺功能异常等其他免疫相关不良事件[8]。另一项关于非小细胞肺癌免疫相关不良反应的荟萃分析显示,免疫相关性肝炎的发生率仅占1%[9]。此患者应用免疫检查点抑制剂后出现肺炎、甲状腺功能减退,一过性药物性肝损伤,应用激素后症状逐渐好转,影像学有所缓解,仍考虑为卡瑞利珠单抗治疗引发的免疫相关性不良反应。免疫相关性不良反应的发生率和与肿瘤类型有关,联合治疗可能增加免疫相关不良反应的发生机率[10],且治疗后恢复的时间较长[11-12]。在所有免疫相关反应死亡的患者中,免疫相关性肺炎总数的35%,是免疫相关不良反应死亡的第一位[13],多系统免疫相关不良反应可能会进一步增加预后不良机率。此外患者支气管镜检查免疫组化染色提示EGFR(++)。研究显示[14-15]出现肿瘤免疫治疗后超进展的患者中约20%存在EGFR突变或ALK重排EGFR突变或ALK重排可能影响PD-1/PD-L1抑制剂的疗效。虽然也有临床实验结果显示[16]PD-1/PD-L1抑制剂对于治疗晚期 EGFR 突变阳性的非小细胞肺癌有一定疗效,但目前未见EGFR突变与免疫不良反应相关性的研究,该患者免疫组化染色提示EGFR(++),但基因层面未见突变,是否也是提示患者预后差的一个相关因素,仍值得进一步探讨。
糖皮质激素是目前治疗免疫相关性肺炎的首选药物。根据免疫相关不良反应的分级,严重的患者还可加用英夫利昔单抗、吗替麦考酚酯或免疫球蛋白[17]。此外有报道白介素6受体抑制剂托珠单抗联合激素治疗取得较好疗效[18]。但英夫利西单抗存在肝脏毒性,出现免疫相关性肝损害的患者不能加用该药。目前在国内批准上市的应用于肺癌的PD-1/PD-L1抑制剂逐渐增多,随着药物的广泛应用,多系统免疫相关不良事件将逐渐增多,且症状可能存在部分个体化差异。临床若再次出现类似病例易出现误诊、误治。多系统免疫相关性不良事件的发生往往存在单系统损伤较重,很容易错过PD-1/PD-L1抑制剂引起的其他免疫相关不良反应治疗的最佳时机。此外多系统免疫相关性不良事件发生后,免疫检查点抑制剂的再次启动时机仍是我们今后的研究方向。

