达格列净在ox-LDL诱导形成的THP-1源性泡沫细胞焦亡中的作用
龚才伟,赵广建,刘大男,欧航君,赵权威,李 辉
动脉粥样硬化(atherosclerosis,AS)是动脉血管壁脂质聚积的慢性炎症性疾病[1],严重危害人类健康,是心血管疾病致死、致残的主要病因。巨噬细胞是AS斑块的主要组成细胞,既能吞噬脂质形成泡沫细胞,又能分泌多种促炎细胞因子来维持局部炎症反应,进而导致斑块的不稳定[2-3]。细胞焦亡是一种与炎症相关的新型程序性细胞死亡,最初发现于巨噬细胞,其发生机制主要分为依赖于半胱氨酸天冬氨酸蛋白水解酶(cystein-containing aspartate-specific protease,Caspase)-1的经典途径和依赖于Caspase-4/5/11的非经典途径[4]。研究[5]表明,细胞焦亡在AS的发生和发展中起重要作用。目前,临床上用于调脂、稳定斑块的抗AS药物主要是他汀类药物,其不良反应多,规律用药后仍难以有效终止AS的进展。研究[6]已证实,达格列净(dapagliflozin,DAPA)可减轻AS、减少巨噬细胞的浸润,并增强斑块的稳定性,但其作用机制不明。该研究拟通过ox-LDL诱导THP-1源性巨噬细胞构建THP-1源性泡沫细胞焦亡模型,探讨DAPA对THP-1源性泡沫细胞焦亡的调控作用,为DAPA用于防治AS及其相关疾病提供新的理论依据。
1 材料与方法
1.1 材料
1.1.1实验细胞 人急性单核白血病细胞系THP-1细胞购于江苏齐氏生物科技有限公司。
1.1.2实验主要试剂和仪器 RPMI-1640培养基 (产品代码:L210KJ )、胎牛血清 (货号:S660JY )购于上海源培生物科技股份有限公司;人源氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL,批号:YB-002)购于广州奕元公司;佛波酯(phorbol 12-myristate 13-acetate,PMA,批号:P8139)、达格列净(dapagliflozin,DAPA,产品编号:SML2804)购于美国Sigma公司;细胞计数法-8(CCK-8) 试剂盒购于上海东仁化学科技有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO,货号:D8371)、Hoechst 33342/碘化丙啶(ropidium iodide,PI)、油红O试剂盒购于北京索莱宝生物科技有限公司;乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒购于南京建成生物工程研究所;Millex-HV 0.45 μm PVDF膜购于美国Millipore有限公司;核苷酸结合寡聚化结构域样受体蛋白3(nod-like receptor pyrin domain containing 3,NLRP3)、裂解的半胱氨酸天冬氨酸蛋白水解酶-1(cystein-containing aspartate-specific protease-1,Cleaved caspase-1)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)、消皮素D(gasdermin-D,GSDMD)氮端片段(GSDMD-N)、白细胞介素(interleukin,IL)-18、IL-1β抗体购于北京博奥森生物技术有限公司;GAPDH抗体购于武汉博士德生物工程有限公司;山羊抗兔IgG H&L (Alexa Fluor® 488)购于美国Abcam公司;NLRP3、Caspase-1、ASC、GSDMD、IL-1β、IL-18引物由通用生物(安徽)股份有限公司设计并合成;TRIzol RNA提取试剂、RNA逆转录试剂盒和qRT-PCR试剂盒购自南京(诺唯赞)生物科技有限公司;倒置生物显微镜购于日本Olympus公司;多功能酶标仪购于美国Thermo Scientific公司。
1.2 实验方法
1.2.1细胞培养 THP-1为悬浮细胞,将其置于含10%胎牛血清、1%青链霉素的RPMI-1640培养基的培养瓶中,在37 ℃、5%CO2细胞培养箱中静置培养,待细胞密度为2×108/L ~2×109/L时进行传代,传代至第3代后进行铺板,并进行后续药物干预实验。
1.2.2THP-1源性巨噬细胞的制备 取对数生长期的THP-1细胞加入含160 nmol/L PMA、10%胎牛血清和1%青链霉素的RPMI-1640培养液,置于37 ℃、5%CO2培养箱中培养48 h诱导分化为THP-1源性巨噬细胞。
1.2.3THP-1源性泡沫细胞焦亡模型的构建 将获得的THP-1源性巨噬细胞更换新鲜的含有160 nmol/L PMA、10%胎牛血清和1%青链霉素的RPMI-1640培养液,加入终浓度为100 μg/ml的ox-LDL,共同孵育24 h,即可成功构建THP-1源性泡沫细胞焦亡模型用于后续实验。
1.2.4药物干预和实验分组 将细胞密度调整为4×106/L铺于6孔板之后,使用ox-LDL或(和)DAPA对THP-1源性巨噬细胞进行处理,并分为以下3组:① 空白对照(NC)组,正常THP-1细胞培养液培养THP-1源性巨噬细胞24 h;② ox-LDL组,采用终浓度为100 μg/ml的ox-LDL处理THP-1源性巨噬细胞24 h;③ 药物干预(ox-LDL+DAPA)组,根据1.2.6项中THP-1源性巨噬细胞活性最好的DAPA浓度进行干预实验,用该浓度DAPA预处理THP-1源性巨噬细胞2 h,再加入ox-LDL(100 μg/ml)后培养细胞24 h。
1.2.5以油红O法检测THP-1源性巨噬细胞泡沫化水平 泡沫细胞建模结束后,移除细胞培养基,用PBS洗2次,加油红O固定液固定30 min;弃去固定液,用PBS冼2次;加入60%异丙醇浸冼30 s;弃去60%异丙醇后加入新配制好的油红O染色液,浸染20 min;弃去染色液,60%异丙醇漂冼30 s,PBS洗5次;加入Mayer苏木精染色液,复染核2 min;弃去染液后PBS洗5次;加入油红O缓冲液1 min后, 弃去油红O缓冲液;加入PBS液覆盖细胞并在显微镜下观察,细胞内脂质为红色,胞核为蓝色。
1.2.6CCK-8法检测DAPA对THP-1源性巨噬细胞活力的影响 将DAPA溶于DMSO,THP-1源性巨噬细胞调整浓度为细胞4×105个/ml悬液,接种于96孔板中每孔100 μl,设5个复孔;分别加入0.2% DMSO和不同浓度的DAPA( 0、1、5、10、50、100、500 μmol/L)预处理2 h,加入100 μg/ml ox-LDL共孵育24 h。每孔加入CCK-8溶液10 μl培养1~4 h,用酶标仪在450 nm波长处测各组的吸光度(absorbance,A)值,计算细胞活力CV。CV=(A实验组-A空白孔)/(A对照组-A空白孔) ×100%。将浓度为0 μmol/L DAPA组对应的A值设置设为100%,其余各组结果均以此为参考,用百分比表示,以未对细胞产生明显毒性的最大浓度作为最佳浓度进行下一步的干预实验。
1.2.7Hoechst 33342/PI双染检测THP-1源性泡沫细胞焦亡 选择6孔板中生长密度为80%~90% THP-1源性泡沫细胞焦亡模型,使用PBS润洗后,依据Hoechst 33342/PI双染试剂盒说明书先后加入1 ml细胞染色缓冲液、5 μl Hoechst 33342染色液、5 μl PI染色液,混匀后冰上孵育30 min,再用PBS洗涤1次,置于倒置荧光显微镜下检测荧光,Hoechst 33342为蓝色,PI为红色。
1.2.8THP-1源性泡沫细胞免疫荧光双染 DAPI(蓝色)和Caspase-1(绿色)双染用于评估DAPA对THP-1源性泡沫细胞焦亡中焦亡关键因子Caspase-1表达的影响。首先将THP-1细胞以4×106/L密度铺于6孔板中,将其诱导为THP-1源性巨噬细胞,在焦亡诱导处理之后,用PBS轻轻润洗3次,每次5 min;向每个孔中加入适量的4%多聚甲醛溶液,室温下固定15 min;去掉固定液,加入PBS清洗3次,每次5 min;每个样本浸于0.5%Triton X-100破膜液中,室温孵育15 min进行通透处理;其次予10%山羊血清封闭30 min后,吸净封闭液后,每孔加入适量的Caspase-1一抗4 ℃孵育过夜,次日滴加二抗,37 ℃避光孵育90 min,取出各组细胞爬片,然后用DAPI复染细胞核,避光室温孵育10 min,最后封片和成像。
1.2.9采用LDH释放实验检测LDH活性 LDH活性能够有效地反映细胞膜的完整性与否,常用来评估细胞受损程度。根据LDH活性检测试剂盒的说明书制备细胞样本、标准品,并将制备的标本转移至96孔板中,使用酶标仪于450 nm波长处检测各孔A值并计算细胞中LDH的活性:LDH活性(%)=(A样品-A对照孔)/(A标准品-A对照孔)×100%。
1.2.10Western blot检测NLRP3、Cleaved caspase-1、ASC、GSDMD-N、IL-18、IL-1β蛋白表达 收集培养的各组细胞,经PBS润洗后,加入RIPA裂解液,冰上裂解30 min,将裂解物转移至1.5 ml EP管,于4 ℃,12 000 r/min高速离心10 min,取上清液,加入4倍体积的5×Loading buffer,100 ℃条件下加热10 min,后采用BCA法进行蛋白定量。取等量蛋白上样,经SDS-PAGE电泳分离,转膜至PVDF膜上后,采用5%脱脂牛奶室温下封闭目的条带2 h,其次用TBST洗膜3次,10 min/次;然后分别加入NLRP3、Cleaved caspase-1、ASC、GSDMD-N、IL-18、IL-1β单克隆抗体(1 ∶1 000)或GAPDH一抗(1 ∶10 000),4 ℃冰箱摇床孵育过夜,第2天用TBST洗膜3次,10 min/次,之后加入羊抗兔IgG(1 ∶10 000) 室温摇床孵育2 h,TBST洗膜3次,10 min/次,洗膜后ECL显影用凝胶图像处理器分析图像,GAPDH作为内参照,目的蛋白与其灰度比值表示目的蛋白的相对表达量。
1.2.11qRT-PCR检测NLRP3、Caspase-1、ASC、GSDMD、IL-18、IL-1βmRNA表达 用TRIzol试剂从细胞样本中提取总RNA,并将其逆转录为cDNA。使用SYBR qPCR Master Mix试剂盒检测qRT-PCR,检测前述焦亡功能因子和内参GAPDHmRNA的表达。以GAPDH为内参,使用2-ΔΔCt法分析mRNA表达的相对倍数变化。每个样品的分析重复3次。本实验所用实时定量PCR目的基因引物序列如表1所示。

表1 实时定量PCR目的基因引物序列
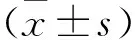
2 结果
2.1 THP-1巨噬细胞的诱导、分化未经PMA诱导分化的THP-1单核细胞呈透亮圆形或类圆形状态,悬浮状生长,细胞表面光滑,无伪足(图1A)。加入PMA诱导分化24 h后则分化为人巨噬细胞,细胞由悬浮状态变为贴壁状态,细胞伸出伪足,呈不规则、贴壁状生长(图1B)。
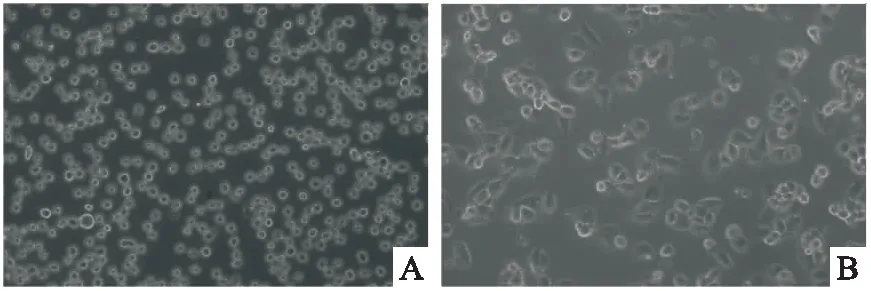
图1 THP-1分化为巨噬细胞 ×200A:THP-1单核细胞;B:THP-1源性巨噬细胞
2.2 CCK-8筛选DAPA的最佳干预浓度THP-1源性巨噬细胞经不同浓度的DAPA干预24 h后,结果如图2所示,与0 μmol/L组相比,溶剂DMSO (0.2%DMSO)组细胞活性无显著变化;除DAPA浓度为10 μmol/L时THP-1源性巨噬细胞活性无显著性变化,其余组随着DAPA浓度升高,细胞活性出现下降趋势;其中,浓度为50、100和500 μmol/L时,细胞活性减低(F=31.67,P<0.05)。因此,10 μmol/L DAPA是不影响THP-1源性巨噬细胞活性的最大浓度,可作为DAPA的最佳干预浓度。
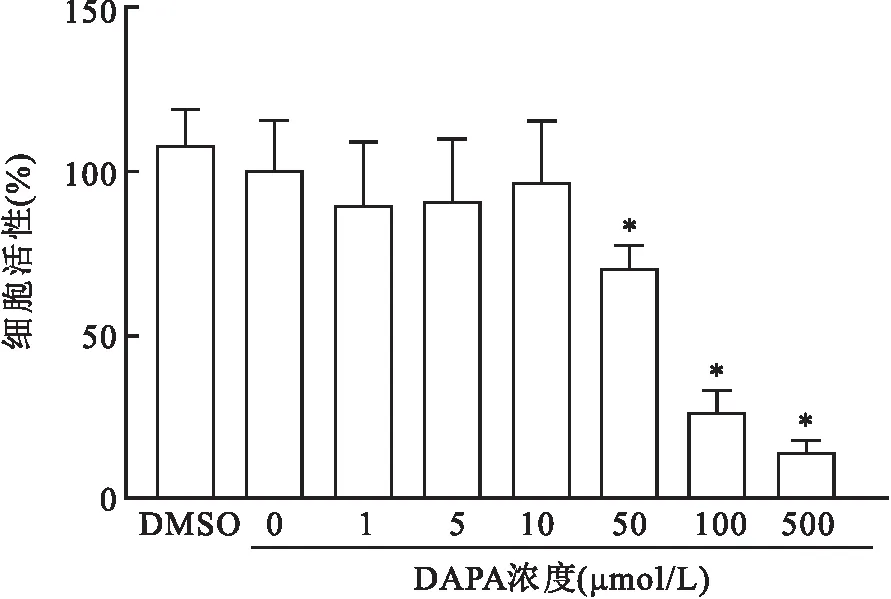
图2 CCK-8检测DAPA干预对THP-1源性巨噬细胞活性的影响与0 μmol/L DAPA组比较:*P<0.05
2.3 油红O染色检测THP-1源性泡沫细胞焦亡模型的构建及DAPA(10 μmol/L)对ox-LDL诱导形成的泡沫细胞泡沫化水平的影响油红O染色结果显示,在NC组中,THP-1源性巨噬细胞胞质内几乎没有或仅有少量脂质沉积,见图3A;与NC组比较,ox-LDL组中THP-1源性巨噬细胞胞质内有显著增多、变大的亮红色脂滴呈典型泡沫细胞形态,说明THP-1源性泡沫细胞焦亡模型的构建成功,见图3B;与ox-LDL组比较,ox-LDL+DAPA(10 μmol/L)组中THP-1源性巨噬细胞胞质内红色脂滴显著减少、变小,提示泡沫细胞生成的数量明显减少,见图3C。说明10 μmol/L的DAPA可有效抑制由ox-LDL诱导的泡沫细胞的形成。
图3 油红O染色检测泡沫细胞焦亡模型的构建及DAPA对泡沫细胞泡沫化水平的影响 ×400A:NC组;B:ox-LDL组;C:ox-LDL+DAPA组
2.4 DAPA对ox-LDL诱导形成的THP-1源性泡沫细胞焦亡的影响
2.4.1qRT-PCR检测DAPA对ox-LDL诱导形成的泡沫细胞焦亡相关蛋白NLRP3、Caspase-1、ASC、GSDMD、IL-18和IL-1βmRNA的表达水平的影响 与NC组相比,ox-LDL组ox-LDL诱导形成的泡沫细胞中焦亡相关蛋白NLRP3、Caspase-1、ASC、GSDMD、IL-18和IL-1βmRNA的表达水平均升高(P<0.05),差异有统计学意义;与ox-LDL组相比,ox-LDL+DAPA组DAPA处理后上述指标水平均降低(P<0.05),差异有统计学意义。见图4。
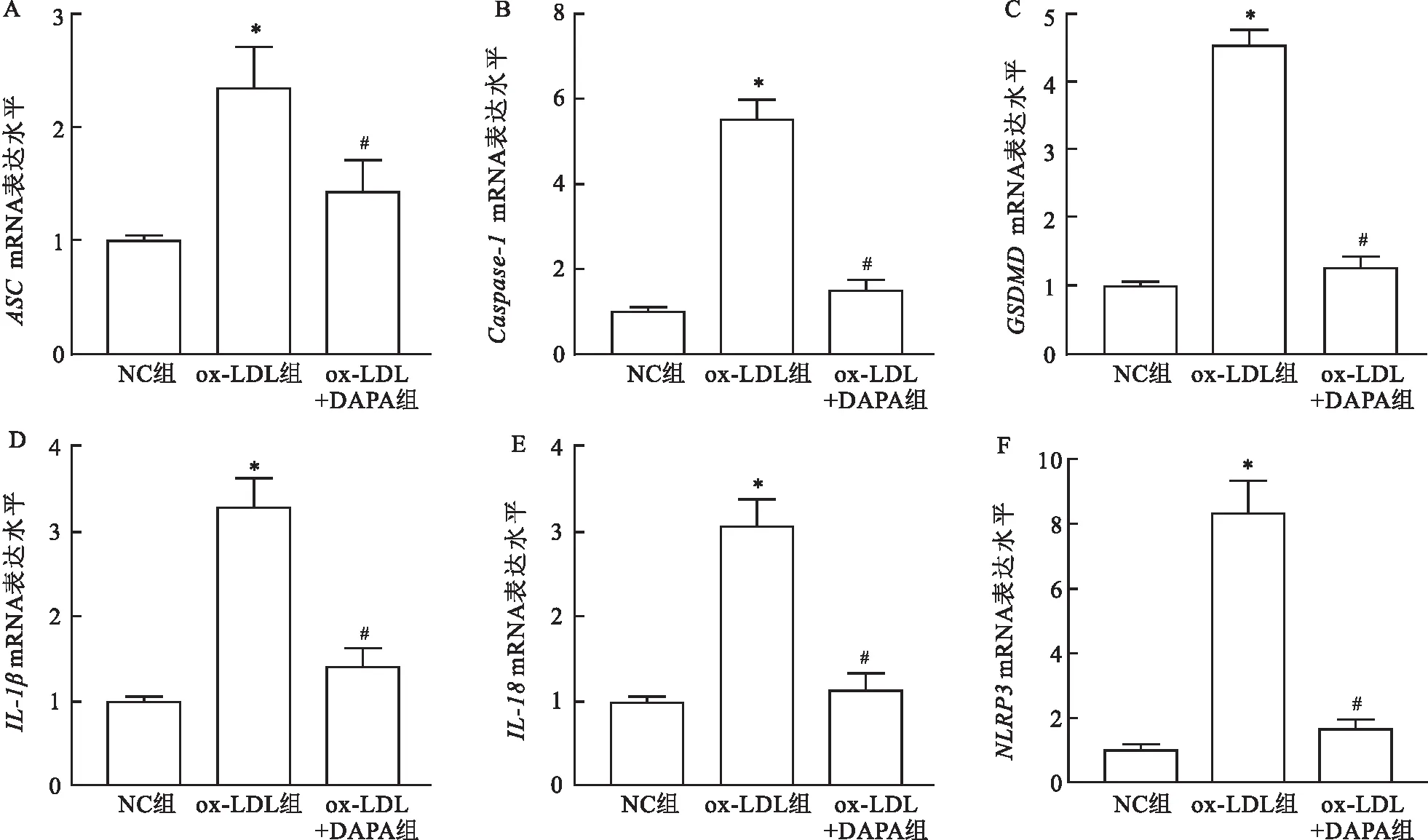
图4 DAPA对各组中NLRP3、Caspase-1、ASC、GSDMD、IL-18、IL-1β mRNA表达水平的影响A:ASC;B:Caspase-1;C:GSDMD;D:IL-1β;E:IL-18;F:NLRP3;与NC组比较:*P<0.05 (n=3);与ox-LDL组比较:#P<0.05(n=3)
2.4.2Western blot检测DAPA对ox-LDL诱导形成的泡沫细胞焦亡相关蛋白NLRP3、Cleaved caspase-1、ASC、GSDMD-N、IL-18和IL-1β蛋白表达水平的影响 与NC组相比,ox-LDL组ox-LDL诱导形成的泡沫细胞中焦亡相关蛋白NLRP3、Cleaved caspase-1、ASC、GSDMD-N、IL-18和IL-1β 蛋白的表达水平均升高(P<0.05),差异有统计学意义。与ox-LDL组相比,ox-LDL+DAPA组DAPA处理后上述指标水平均降低(P<0.05),差异有统计学意义。见图5。
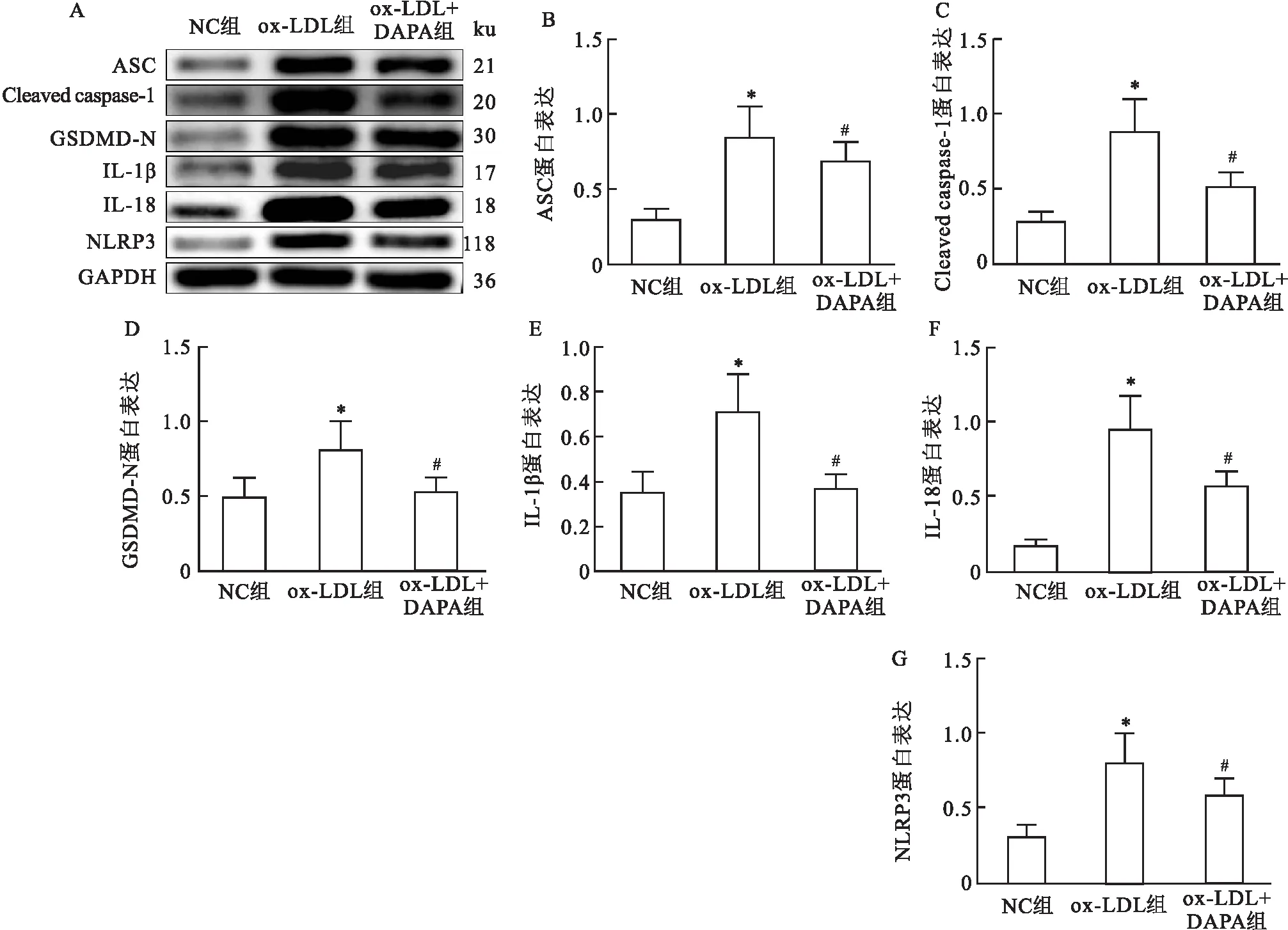
图5 Western blot检测DAPA对各组中NLRP3、Cleaved caspase-1、ASC、GSDMD-N、IL-18、IL-1β蛋白表达水平的影响A:灰带图;B:ASC;C:Cleaved caspase-1;D:GSDMD-N;E:IL-1β;F:IL-18;G:NLRP3;与NC组比较:*P<0.05(n=3);与ox-LDL组比较:#P<0.05(n=3)
2.4.3Hoechst 33342/PI双染和LDH释放试验评估DAPA对THP-1源性泡沫细胞焦亡的影响 Hoechst 33342/PI双染结果及LDH释放试验显示,与NC组相比,ox-LDL组中THP-1源性泡沫细胞PI阳性细胞比例升高且LDH活性升高(P<0.05);与ox-LDL组相比,ox-LDL+DAPA组THP-1源性泡沫细胞PI阳性细胞比例降低(P<0.05)且LDH活性降低。见图6。
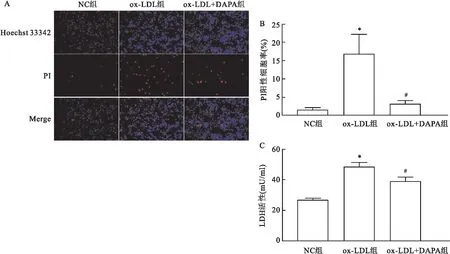
图6 Hoechst 33342/PI双染和LDH释放试验评估DAPA对THP-1源性泡沫细胞焦亡的影响A:Hoechst 33342/PI双染 ×100;B:各组PI阳性细胞数比例;C:各组LDH活性比较;与NC组比较:*P<0.05(n=3);与ox-LDL组比较:#P<0.05(n=3)
2.4.4细胞免疫荧光检测DAPA对泡沫细胞焦亡模型中焦亡关键蛋白Caspase-1表达的影响 与NC组相比,ox-LDL组ox-LDL诱导的泡沫细胞焦亡模型中Caspase-1荧光强度(绿色)明显增强(P<0.05);与ox-LDL组相比,ox-LDL+DAPA组DAPA处理后Caspase-1荧光强度减弱(P<0.05)。以上结果说明DAPA可抑制泡沫细胞焦亡模型中焦亡关键蛋白Caspase-1的表达。见图7。
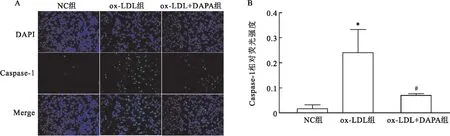
图7 细胞免疫荧光检测DAPA对泡沫细胞焦亡模型中Caspase-1表达的影响A:Caspase-1细胞免疫荧光双染 ×100;B:各组Caspase-1荧光强度;与NC组比较:*P<0.05 (n=3);与ox-LDL组比较:#P<0.05(n=3)
3 讨论
AS是一种进行性病变,是大多数心血管疾病的重要病理基础,脂质代谢不平衡和不适宜的炎症反应共同参与了AS病变的进展,其特征是大动脉中脂质和纤维成分的积聚。巨噬细胞浸润和脂质沉积是粥样斑块形成的关键步骤,泡沫细胞的形成,被广泛认为是AS的关键驱动因素[3]。ox-LDL是巨噬细胞泡沫化过程中胆固醇的主要来源,血管内膜下的巨噬细胞吞噬大量ox-LDL转化为泡沫细胞,促进AS斑块形成[3]。在本研究中,THP-1源性的巨噬细胞用ox-LDL处理后,经油红O染色,结果如图3B所示,细胞胞质内有大量红色脂滴蓄积,细胞体积增大,符合泡沫细胞形态,表明THP-1巨噬细胞源性泡沫细胞模型构建成功。
DAPA是钠-葡萄糖共转运蛋白2抑制剂(sodium-glucose cotransporter 2 inhibitors,SGLT2i)成员之一,其通过选择性地抑制SGLT2来减少肾小管对葡萄糖的重吸收和增加尿糖排出而降低血糖[7]。有研究[8]表明,SGLT2i可通过降低血糖对内皮细胞的“毒性”而发挥抗炎症和抗氧化潜能进而延缓AS。Terasaki et al[9]发现SGLT2i可抑制巨噬细胞源性泡沫细胞的形成,从而发挥抗AS的作用;在本研究中,以DAPA干预ox-LDL诱导的THP-1源性的巨噬细胞后得到了类似的结果:油红O染色结果显示,与ox-LDL组相比,DAPA组巨噬细胞胞质内的红色脂滴明显减少,细胞体积减小。以上研究说明DAPA能够抑制ox-LDL诱导的巨噬细胞形成。
巨噬细胞在AS病变中扮演着重要的角色,巨噬细胞中紊乱的脂质代谢是泡沫细胞产生的主要原因,这些脂质不能清除时,其可诱导巨噬细胞焦亡。细胞焦亡的主要特征之一为由Caspase-1下游的GSDMD家族蛋白介导细胞膜膜孔形成,造成细胞膜的完整性丧失、细胞肿胀、细胞溶解、细胞内的内容物和促炎细胞因子如LDH、IL-18和IL-1β释放到细胞外。因此,检测上清液中的LDH活性可反应细胞的活性情况,检测细胞IL-18和IL-1β的蛋白表达情况可反应炎症情况。既往多项研究[10-11]表明,ox-LDL和胆固醇晶体均能诱导巨噬细胞NLRP3炎症小体的形成并激活Caspase-1,刺激IL-Iβ和IL-18的表达。Xu et al[12]研究表明,在晚期的AS斑块中,巨噬细胞焦亡促进坏死核心的形成和斑块的不稳定,进而诱发急性心血管事件发生。在冠状AS斑块中,NLRP3、ASC、Caspase-1、IL-Iβ和IL-18表达明显增高[13]。NLRP3抑制剂可抑制AS小鼠中巨噬细胞焦亡,下调AS小鼠中巨噬细胞NLRP3、Caspase-1、IL-1β和IL-18的表达[14]。因此,通过抑制巨噬细胞焦亡可能延缓AS的发生和发展。DAPA是国内第一个上市的SGLT2i降糖药,研究[15]表明,DAPA能抑制糖尿病ApoE-/-小鼠中NLRP3、ASC、Caspase-1、IL-1β和IL-18的表达。Liu et al[6]研究中提到,SGLT2i可通过抑制血管炎症、减轻氧化应激和减少泡沫细胞形成等机制改善AS的进展。在本研究中,通过ox-LDL刺激巨噬细胞后显示,THP-1源性泡沫细胞中NLRP3、Cleavedcaspase-1、ASC、GSDMD-N、IL-18、IL-1βmRNA和蛋白表达水平均明显升高,PI阳性细胞数及LDH活性明显增加,予以DAPA干预后,上述焦亡相关蛋白的mRNA和蛋白表达水平、PI阳性细胞数及LDH活性均被明显抑制;细胞免疫荧光结果显示,ox-LDL刺激巨噬细胞后,Caspase-1的荧光强度明显增强,予以DAPA干预后,荧光强度明显减弱。这些结果说明了DAPA抑制了THP-1源性泡沫细胞焦亡。
综上所述,DAPA能有效抑制NLRP3、Caspase-1、ASC、GSDMD、IL-18、IL-1β的表达,进而抑制了THP-1源性泡沫细胞焦亡,并能抑制泡沫细胞的形成。该研究仅从细胞层面验证了DAPA抑制泡沫细胞焦亡的作用,下一步拟进行动物实验研究,为DAPA用于防治AS提供更多的理论依据。

