安罗替尼联合信迪利单抗治疗阑尾黏液性腺癌伴腹腔广泛转移1例
杨海萍 姚庆华
阑尾原发性肿瘤非常罕见,组织学多样,阑尾上皮来源肿瘤组织学分为三类,包括黏液腺癌、肠腺癌和印戒细胞腺癌[1]。阑尾黏液腺癌(mucinous adenocarcinomas of appendix,MAA)更为罕见,占所有胃肠道肿瘤的不到0.5%[2],发病中位年龄为60 岁,迄今尚未发现性别差异[3]。MAA 患者无特异性临床表现,因此发现通常较晚,大多数病例是在阑尾手术后确诊或影像学检查中发现。MAA 可引起腹膜广泛转移,腹膜转移是不良预后因素。MAA 伴腹膜转移的治疗方式包括减瘤手术、腹腔热灌注化疗(HIPEC)和化疗,化疗一般适用于复发转移的患者。本文回顾性分析1 例MAA 伴腹膜广泛转移患者的临床资料。
1 临床资料
患者,男,64 岁,2022 年2 月腹部CT 检查提示“肝包膜下贝壳样改变,腹膜、网膜饼状增厚,腹水,右下腹占位”。胃肠镜检查“胃窦黏膜下隆起外压首选考虑,肠道粘连明显,无法到达回盲部,乙状结肠及直肠未见明显异常”。肿瘤指标CA199>1,968 U/mL。后就诊浙江省肿瘤医院,2022 年2 月28日在B 超引导下行右下腹占位穿刺活检术和腹腔穿刺置管引流术,腹水脱落细胞学未见癌细胞,活检病理提示:(腹膜增厚区)纤维组织内见异型腺体及黏液湖(结合病史、形态,首先考虑转移性或浸润性腺癌)(见图1)。初步诊断“腹腔转移性腺癌,消化道来源首先考虑”。2022 年3 月16 日至2022 年5 月18 日予XELOX 方案化疗3 周期。2022 年6 月6 日患者腹胀症状加重,腹部B 超提示“腹盆腔大量积液”。再次行腹腔穿刺置管引流术,腹水脱落细胞学诊断“少量非典型黏液样细胞,免疫组化:BerEP4(+)、PAX8(-)、CDX-2(+)、CK20(+)、Muc-5A(+)、P16(弱+)、WT-1(部分+)、CR(-)、D2-40(-),结合免疫细胞化学染色首先考虑消化道来源黏液腺癌” 2022 年6 月19 日复查腹部+盆腔增强CT:肝周、腹腔、大网膜多发转移瘤,范围较前增大,腹腔盆腔积液较前增多(见图2)。2022 年6 月27 日腹水脱落细胞学诊断结果“见成团及散在富含黏液的肿瘤细胞”。修正诊断“阑尾黏液性腺癌伴腹盆腔转移”,考虑患者化疗不敏感,2022 年6 月29 日转腹部外科行手术治疗,因术中见腹腔弥漫性胶冻样改变,无法手术完整切除,改行局部肿物切除送病理,术中留置腹腔热灌注引流管。术后常规病理诊断结果:大网膜肿物纤维、脂肪组织内见异型腺体及黏液湖形成。结合病史及形态,首先考虑转移性或浸润性黏液腺癌(见图3)。术后行腹腔顺铂热灌注治疗4 次。于2022 年7 月20 日至2022 年11 月2 日予“安罗替尼10 mg,1 次/d,d1-14+信迪利单抗200 mg,1 次/3 周”靶向联合免疫治疗6 周期,2022 年11 月2 日,复查腹部+盆腔增强CT 提示:“肝脾包膜及腹膜弥漫转移灶,较前相仿,盆腔积液较前相仿”,肿瘤标志物CEA、CA199、CA125 明显下降并趋于稳定状态,根据实体肿瘤疗效评价标准(RECIST1.1)及实体瘤免疫治疗疗效评价标准(iRECIST),疗效评价为SD。

图1 纤维组织中可见异型腺体和黏液湖[HE×20(A),HE×200(B)]

图2 A. 肝包膜切迹样改变,大网膜软组织影;B. 右侧髂窝囊性占位,囊壁不均匀强化,盆腔积液
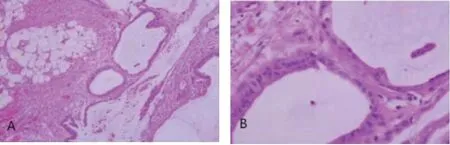
图3 大网膜纤维和脂肪组织可见异型腺体和黏液湖[HE×20(A),HE×200(B)]
2 讨论
MAA 起病隐匿,疾病早期无症状或较少有症状,随着疾病的发展,患者可能会在几个月至几年时间内出现腹痛、腹胀、腹部肿块、腹水,甚至肠梗阻、尿路梗阻和其他症状[3]。治疗MAA 的方法选择取决于肿瘤的具体情况,如肿瘤大小、肿瘤位置、肿瘤组织学、是否穿孔以及临床表现。如肿瘤细胞仅限于黏膜(即原位癌),简单的阑尾切除术也可以达到与右半结肠切除术相同的效果。如果肿瘤细胞已经渗透到黏膜下层或整个黏膜层,并伴有局部淋巴转移,则通常会进行右半结肠切除术和大网膜切除术。如组织学检查显示存在黏液性腹膜癌,患者应接受减瘤手术和腹腔化疗[4]。手术最严重的并发症是自发性或医源性囊肿破裂,并发展为腹膜假黏液瘤,这使治疗和最终结果显著复杂化。一旦术前诊断为MAA,外科医师需要避免医源性囊肿破裂和腹膜播散。前瞻性研究尚未确定全身化疗在AMM 治疗中的作用,全身化疗通常在肿瘤复发后使用,化疗方案以氟尿嘧啶为基础。阑尾黏液性腺癌与黏液性结直肠癌相似,与非黏液性腺癌相比,对化疗的反应率低[5]。
本例患者,最初的右下腹占位穿刺病理结果考虑转移性或浸润性腺癌,初步治疗决策选择以氟尿嘧啶为基础的XELOX 方案全身化疗,结果化疗无效。减瘤术前3 次腹腔积液穿刺引流术,末次2022 年6 月23 日送检的腹水脱落细胞病理学结果中见富含黏液的肿瘤细胞(见图4),免疫组化:BerEP4(+)、PAX8(-)、CDX-2(+)、CK20(+)、Muc-5A(+)、P16(弱+)、WT-1(部分+),CR(-)、D2-40(-),结合免疫细胞化学染色首先考虑消化道来源黏液腺癌。基于患者肠镜检查结果、临床症状、腹部增强CT 检查及腹水细胞学病理结果,修正诊断考虑阑尾黏液性腺癌伴腹盆腔转移,对化疗不敏感,考虑行减瘤手术。术中见腹腔内弥漫性囊肿形成(见图5),手术无法根除,为了避免医源性囊肿破裂和腹膜播散,仅切取大网膜送组织病理学检查明确诊断,最终病理结果诊断大网膜转移性黏液性腺癌。
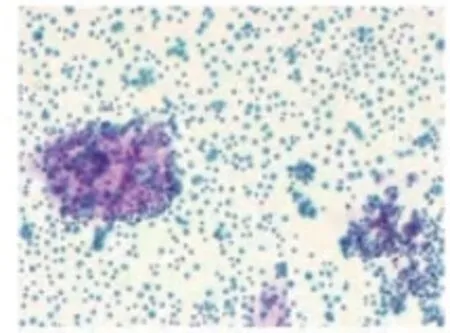
图4 富含黏液的肿瘤细胞
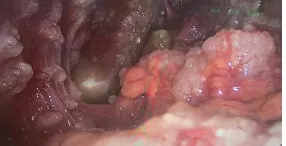
图5 腹腔镜下腹膜弥漫性颗粒样囊性小结节
基于回顾性病例研究,阑尾黏液性腺癌合并腹膜转移的治疗从反复黏液性腹水引流到减瘤手术,20 世纪80 年代,SPRATT[6]等证明,在传统的减瘤手术中加入腹腔内化疗可以改善疾病控制的持续时间。20 世纪90 年代,SUGARBAKER[7]提出减瘤手术联合腹腔热灌注化疗。本例患者,在减瘤手术后给予4 周期的顺铂腹腔内热灌注化疗。腹腔顺铂热灌注化疗治疗结束后开始安罗替尼联合信迪利单抗的靶向联合免疫治疗,疗效评价SD,目前已经历6 周期近4 个月的治疗,患者疾病仍处于稳定状态。
阑尾黏液性肿瘤的诊断在很大程度上取决于病理检查中粘蛋白的存在,CK20 染色呈弥漫性阳性(100%)、MUC5AC(86%)和DPC4(100%)呈阳性。鉴于该疾病的罕见性,分子背景的研究较少,因此,研究假设阑尾黏液性肿瘤遵循与结直肠肿瘤相同的发病途径,并遵循腺瘤-癌序列中公认的遗传进展。公认的致癌途径包括:K-ras 原癌基因的点突变、染色体17p 上的p53 基因的突变和/或缺失、β-连环蛋白基因的突变。另一种致癌途径涉及由核苷酸错配修复基因突变引起的微卫星不稳定性(MSI),包括hMSH2、hMLH1、MSH6、PMS2、GTBP。在一项对30 例阑尾腺癌(其中包括23 例黏液性癌和7 例非黏液性腺癌)进行MSI、P53 过表达和KRAS 突变评估的研究中,所有的癌均是微卫星稳定的,p53 过表达仅出现在30 例患者中的1 例(3%),K-ras 突变存在于20 例癌中的11 例(55%),包括16 例黏液性癌中的8 例(50%)和4例非黏液性癌症中的3 例(75%)[8]。在另一个研究中,共有149 例阑尾腺癌患者接受了以下至少一项的分子测试:KRAS、BRAF、cKIT、EGFR 或PI3K 的激活突变;c-KIT 或COX-2 的蛋白表达;或微卫星不稳定性(MSI)状态,结果K-ras 突变存在于108 例癌中59 例(54.6%),COX-2 表达49 例患者中30 例(61.2%),BRAF 突变50 例患者中2 例(40%),MSI-L在35 例患者中33 例(94.2%),PI3K 突变12 例患者中的2例(16.7%),5 例患者接受cKIT 检测突变率为0,7 例患者接受EGFR 检测突变率为0[9]。这些研究是回顾性系列研究,样本量有限,对阑尾黏液性腺癌亚组遗传改变的研究甚少。
很少有全面的临床研究调查了靶向分子治疗对黏液腺癌组织学患者的影响,但也有一些在黏液性卵巢癌中的报道[10],一项关于卵巢黏液腺癌的研究表明,西妥昔单抗抑制了KRAS 基因野生型肿瘤细胞系的生长,但不能抑制携带KRAS 基因突变的黏液肿瘤细胞的生长[11]。一份关于VEGF表达预测阑尾和结肠黏液腺癌腹膜转移患者生存率的报告支持了抗血管生成剂的使用[12]。已经证明,患有dMMR/MSI-H肿瘤的癌症患者更有可能受益于抗PD-1 治疗,基于黏液性结直肠腺癌有较高的MSI-H 发生率的事实,PD-1 抑制剂是一种可行的治疗方式,尽管黏液性结直肠癌患者亚组缺乏具体数据[13]。第一个关于PD-1 抑制剂联合VEGF 阻断剂治疗MSI-H结直肠癌的研究也报告了90%的疾病控制率和30%的客观缓解率,这表明抗VEGF 可能增强免疫检查点阻断剂的抗肿瘤活性[14]。
阑尾黏液性腺癌基于分子背景治疗策略的相关研究尚未开展,基于上述研究报告,本例患者使用多靶点的受体酪氨酸激酶抑制剂安罗替尼联合免疫抑制剂信迪利单抗。安罗替尼能有效抑制VEGFR、PDGFR、FGFR、c-Kit 等激酶,具有抗肿瘤血管生成和抑制肿瘤生长的作用。信迪利单抗与PD-1受体结合,阻断PD-1 活性抑制肿瘤生长。结局是>4 个月的疾病无进展生存时间,进一步随访正在进行中,希望能给其他晚期阑尾黏液性腺癌患者的治疗方案选择提供参考,然而该联合治疗模式的疗效仍需大样本的临床研究得以证实。

