哺乳动物细胞ACBD3敲低对铁死亡的影响
邱 荣, 马山川, 钱 影,曹新旺
铁死亡是一种可调控细胞死亡形式,与发育、衰老、免疫和癌症等生理病理过程密切相关[1]。铁死亡是由组成细胞膜的多不饱和脂肪酸在铁离子和活性氧(reactive oxygen species, ROS)的作用下生成脂质过氧化物,这种脂质过氧化物的积累将破坏细胞膜的完整性,进而导致铁死亡的发生。因此,铁死亡是脂质过氧化反应驱动,细胞内氧化还原稳态失衡的结果[2]。迄今为止,文献中报道的诱导细胞发生铁死亡的方式包括:抑制抗氧化系统XC-;抑制/降解/失活谷胱甘肽过氧化物酶4(GPX4);消耗还原型辅酶Q10;过氧化物、铁或多不饱和脂肪酸过载等方式[2]。铁死亡除了可导致细胞死亡外,在一定程度上还可以消除机体内癌细胞、炎症细胞或活化的成纤维细胞,因此,阐明铁死亡发生的分子机制具有重要意义[3]。
ACBD3是一个含有酰基辅酶A结合结构域的高尔基体蛋白,又名PAP7 或GCP60,在进化上非常保守,广泛表达于人体多种组织。ACBD3在细胞内参与多种生理病理过程,如类固醇合成、脂代谢、高尔基体形态维持、葡糖神经酰胺运输、病毒入侵、细菌增殖以及肿瘤发生发展等[4]。此外,ACBD3亦可通过与铁离子转运蛋白DMT1相互作用维持细胞内铁稳态[5]。铁离子过载可导致铁死亡的发生,而ACBD3蛋白又参与铁稳态的调控。该研究通过RNA干扰技术降低细胞内ACBD3表达水平,研究其在细胞铁死亡过程中的作用。
1 材料与方法
1.1 实验材料HeLa细胞和HEK293细胞购自中国科学院细胞库(上海);胎牛血清、DMEM培养基、青链霉素、胰蛋白酶-EDTA、嘌呤霉素及Lipofectamin 2000购自美国ThermoFisher公司; ACBD3和β-actin抗体购自武汉Proteintech公司;铁含量检测试剂FerroOrange(F374)和Calcein-AM(C326)和耐光型ROS探针(R253)购自上海同仁化学公司;铁死亡诱导剂RSL3购自美国MCE公司;细胞活力测量试剂盒(g7570)购自美国Promega公司;脂质过氧化检测试剂BODIPY 581/591 C11购自美国Invitrogen公司;化学发光成像系统购自上海天能公司;激光扫描共聚焦显微镜(LSM800)购自德国蔡司公司;酶标仪(Spark)购自瑞士帝肯公司。
1.2 细胞培养HeLa细胞和HEK293细胞培养在含10%FBS和100 μg/ml的青链霉素的DMEM培养基中,设定培养温度为37 ℃,CO2含量为5%。
1.3 构建ACBD3敲低细胞株根据标准设计程序,寻找两条长度为21 bp的人源ACBD3最优靶标序列5′-GCAAAGCATTTCATCCAACTT-3′和5′-CCCAGCTCATAGGTGTTCATA-3′。根据载体pLKO.1 puro(Addgene#8453)双酶切位点来为靶标序列添加酶切接头,然后按照标准的分子克隆方法,将寡核苷酸退火后克隆到载体pLKO.1 puro。进一步将测序正确的质粒与慢病毒包装质粒pMD2.G(Addgene# 12259)以及psPax2(Addgene# 12260)一起共转到HEK293细胞,48 h后收集病毒上清液,用来感染密度为30%~50%的HeLa细胞,感染48 h后用浓度为0.5 μg/ml的嘌呤霉素进行筛选,最终得到ACBD3 敲低的稳定细胞株。ACBD3-shRNA1:(F)C CGGGCAAAGCATTTCATCCAACTTCTCGAGAAGTTG GATGAAATGCTTTGCTTTTTG;(R)AATTCAAAAAG CAAAGCATTTCATCCAACTTCTCGAGAAGTTGGATG AAATGCTTTGC;ACBD3-shRNA2:(F)CCGGCCCAT GAAGAAGGATCATATCCTCGAGGATATGATCCTTCT TCATGGGTTTTTG,(R)AATTCAAA-AACCCATGAA GAAGGATCATATCCTCGAGGATATGATCCTTCTTCA TGGG。
将以上细胞分别分为3组:野生型Hela细胞为对照组;使用shRNA1序列的敲低细胞为ACBD3 sh1组;使用shRNA2序列的敲低细胞为ACBD3 sh2组。
1.4 Western blot检测将3组细胞分别用PBS洗1次,然后用含有蛋白酶抑制剂的细胞裂解液(pH 7.4的50 mmol/L Hepes, 150 mmol/L NaCl, 1 mmol/L EDTA, 1%Triton X-100)在冰上裂解30 min,接着进行SDS-PAGE电泳,转移到PVDF膜上,用相应的一抗和二抗进行孵育,将PVDF膜放在化学发光成像系统中成像,检测目标蛋白条带。
1.5 细胞活力测定在96孔板中分别接种3组细胞 (密度为6×104个/ml),培养过夜。第2天按照40、16、6.4、2.56、1.024 μmol/L共5个浓度梯度加入RSL3,培养24 h后,除去培养基,加入50 μl不含FBS的DMEM,再加入50 μl CellTiter-Glo工作液,避光混匀5 min后,静置5 min,然后用酶标仪测定化学发光值。
1.6 细胞ROS检测在96孔板中接种3组细胞(密度为1×105个/ml),培养过夜,次日除去培养基,用HBSS清洗2次,加入高度敏感的DCFH-DA染料工作液,在培养箱培养30 min后,移去工作液,用HBSS清洗2次,再加入HBSS,然后用倒置荧光显微镜观察。
1.7 细胞中脂质过氧化物检测将密度为1×105细胞/ml 的3组细胞接种于96孔板中,培养过夜,根据实验设计进一步分成6组,分别为野生型细胞、ACBD3 sh1、ACBD3 sh2、野生型细胞+RSL3、ACBD3 sh1+RSL3、ACBD3 sh2+RSL3。次日除去培养基,加入或不加入DMEM 培养基稀释的10 μmol/L RSL3溶液,培养1 h后,清洗细胞2次,添加 BODIPY 581/591 C11工作液,在培养箱内培养30 min后移去培养基,用HBSS清洗细胞2次后,再次加入HBSS,用激光共聚焦显微镜成像。
1.8 细胞游离Fe2+含量测定接种3组细胞于96孔板中,在培养箱中培养过夜,第2天先弃去培养基,再用HBSS溶液洗涤细胞3次,然后加入浓度为1 μmol/L的FerroOrange工作液,在培养箱中培养30 min后,无需清洗,直接用荧光显微镜下对细胞进行观察。
1.9 测定细胞内总铁含量在96孔板中接种3组细胞,培养箱中过夜培养,第2天,移去培养基,用PBS清洗细胞2~3次,每孔加入100 μl浓度为2 μmol/L的Calcein-AM溶液,在培养箱培养15~30 min后弃去培养基,用PBS洗涤细胞2次,后加入HBSS溶液,用荧光显微镜观察细胞。
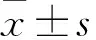
2 结果
2.1 ABCD3敲低对铁死亡诱导剂RSL3作用下细胞活力的影响Western blot分析显示,与对照组细胞相比,用两种含有不同ACBD3 shRNA病毒处理的细胞中ACBD3表达水平降低(P<0.001)。细胞活力分析实验显示,与野生型细胞(对照组)相比,ACBD3敲低组细胞对铁死亡诱导剂RSL3更为敏感,在RSL3浓度为2.56 μmol/L时细胞活力即已下降了90%,细胞活力降低(F=32.231,P<0.001);而野生型细胞在RSL3浓度达到16 μmol/L时细胞活力才明显下降(P<0.001)。两个ACBD3敲低组细胞在不同RSL3浓度下的细胞活力无明显差异。见图1。
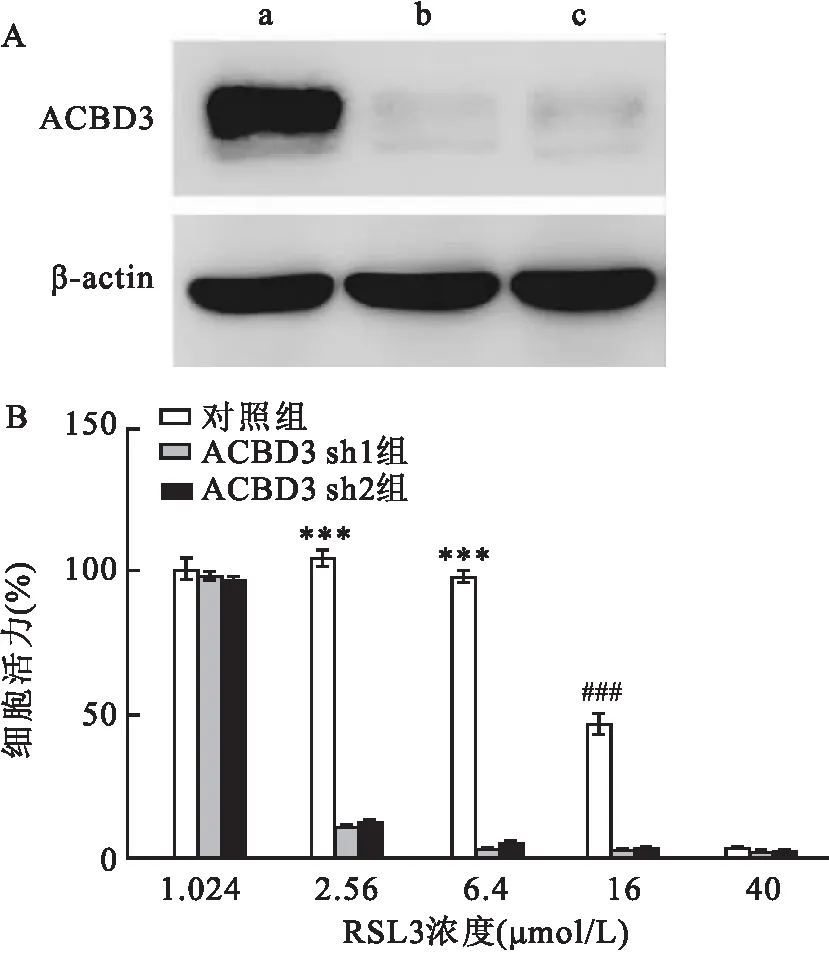
图1 RSL3作用下野生型细胞和ACBD3敲低组细胞细胞活力比较A:Western blot检测对照组和ACBD3敲低组细胞中ACBD3的表达水平;a:对照组;b:ACBD3 sh1组;c:ACBD3 sh2组;B:不同给药浓度下的细胞活力;与RSL3同一给药浓度敲低组比较:***P<0.001;与6.4 μmol/L RSL3浓度下的对照组比较: ###P<0.001
2.2 ACBD3敲低对细胞脂质过氧化水平的影响在野生型细胞和ACBD3敲低组细胞中,分别不加入或加入10 μmol/L RSL3,然后利用BODIPY 581/591 C11检测细胞脂质过氧化。BODIPY 581/591 C11探针分子通过与脂质过氧化时产生的脂质自由基反应检测细胞脂质过氧化水平。未发生反应的探针发出红色荧光,而发生反应后的探针由红色变为绿色,因此,可以利用相对荧光强度(绿色/红色)来表征细胞内脂质过氧化水平改变。结果显示,与野生型细胞相比,ACBD3敲低组细胞脂质过氧化增加(F=25.261,P<0.001)。RSL3处理后,相应组细胞相对荧光强度增强(F=30.337,P<0.001);与野生型细胞相比,ACBD3敲低组细胞的脂质过氧化水平增加(F=28.732,P<0.001)。两不同ACBD3敲低组细胞在RSL3不存在或存在条件下脂质过氧化水平无明显差异。见图2。
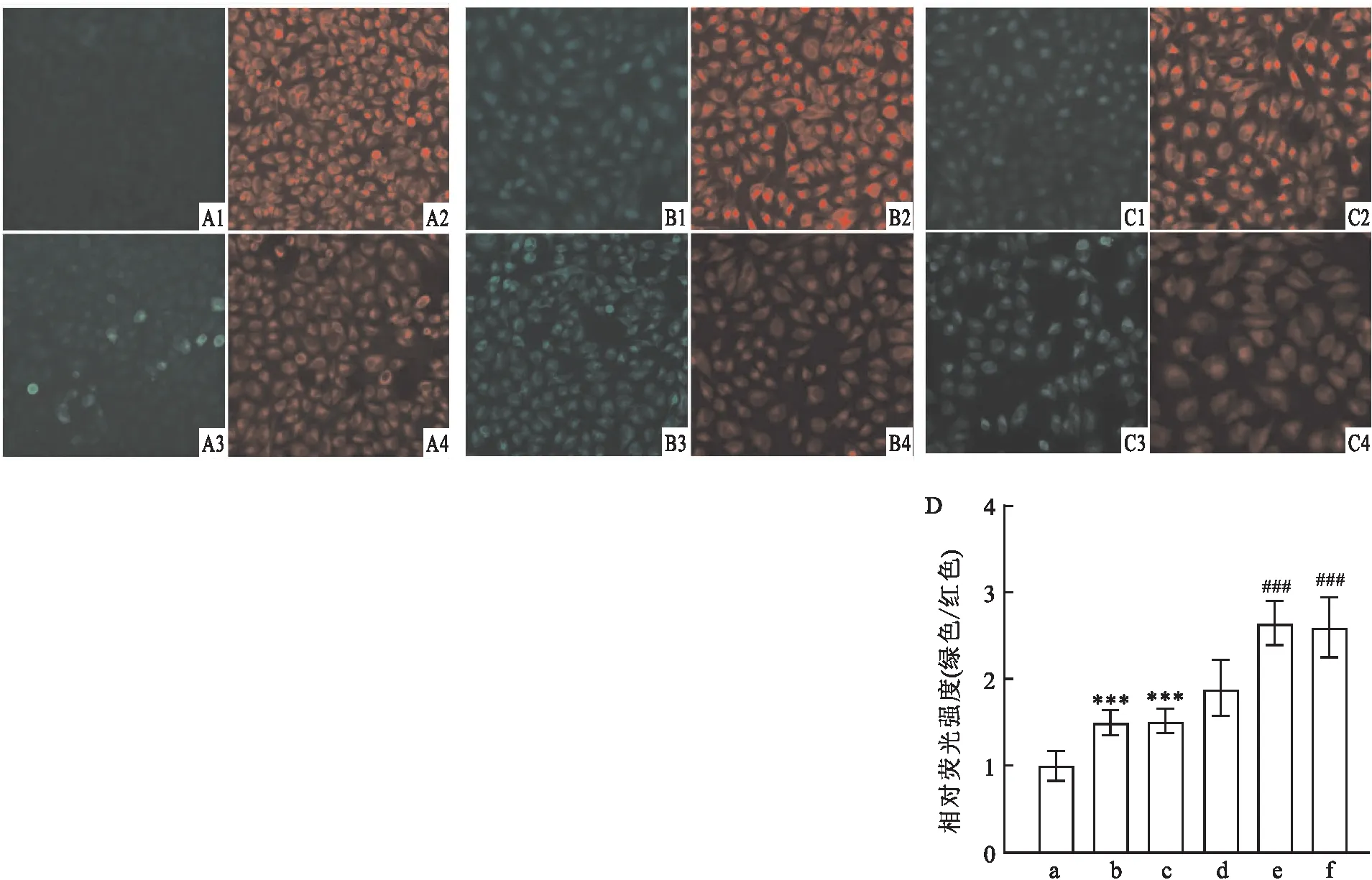
图2 BODIPY 581/591 C11标记野生型细胞和敲低组细胞脂质过氧化水平比较A~C:野生型细胞、ACBD3 sh1细胞、ACBD3 sh2细胞的荧光图像 ×40;1:未使用RSL3处理的绿色荧光图像;2:未使用RSL3处理的红色荧光图像;3:RSL3处理的绿色荧光图像;4:RSL3处理的红色荧光图像;D:各组细胞相对荧光强度统计学分析;a:野生型细胞;b:ACBD3 sh1;c:ACBD3 sh2;d:野生型细胞+RSL3;e:ACBD3 sh1+RSL3;f:ACBD3 sh2+RSL3;与野生型细胞比较:***P<0.001;与野生型细胞+RSL3比较:###P<0.001
2.3 ACBD3敲低对细胞内ROS浓度的影响利用耐光性ROS探针检测野生型细胞和ACBD3敲低组细胞ROS水平。结果表明,与野生型细胞相比,ACBD3敲低组细胞中ROS水平升高(F=33.261,P<0.001),而两个ACBD3敲低组细胞ROS浓度无明显差异。见图3。
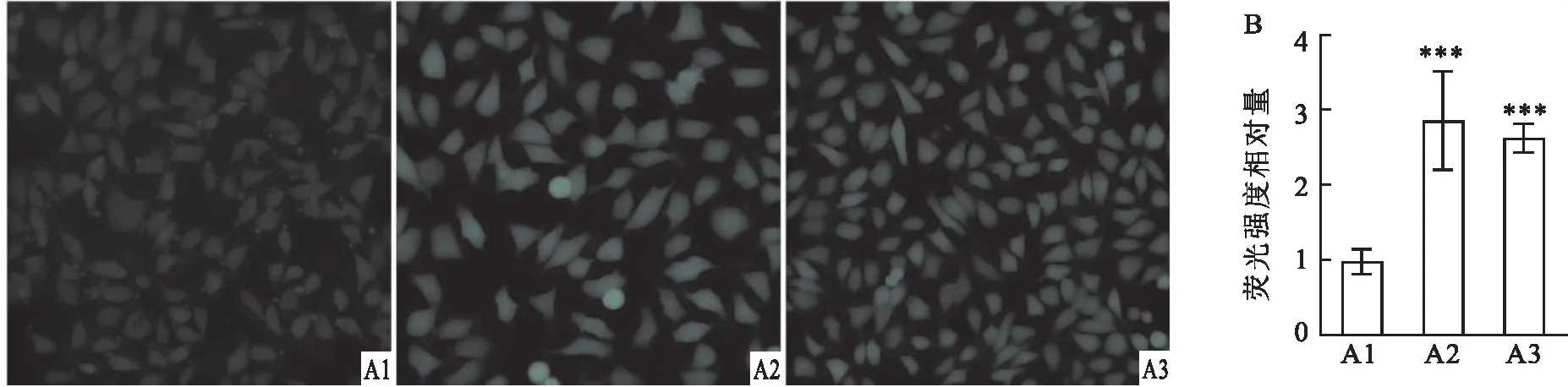
图3 ROS探针标记野生型细胞和ACBD3敲低组细胞ROS水平比较A: ROS探针标记野生型细胞和ACBD3敲低组细胞 ×40;B:各组细胞荧光强度统计学分析;1:对照组;2:ACBD3 sh1组;3:ACBD3 sh2组;与对照组比较:***P<0.001
2.4 ACBD3敲低对细胞内总铁含量和Fe2+水平的影响利用荧光探针Calcein-AM测量细胞中的总铁含量,该探针螯合细胞中铁离子后其荧光将会淬灭。因此,Calcein-AM标记细胞的荧光强度与细胞中总铁含量呈负相关。测量结果表明,与对照组比较,ACBD3敲低组细胞荧光强度增强(F=19.205,P<0.001),但两个ACBD3敲低组细胞间荧光强度差异无统计学意义。因此,与对照组细胞相比,ACBD3敲低组细胞内总铁含量明显下降。
利用FerroOrange探针检测细胞内Fe2+浓度,该探针结合细胞内Fe2+后荧光强度会随铁离子浓度增加。结果显示,与对照组细胞相比,ACBD3敲低组细胞中荧光强度增强(F=26.379,P<0.001),但两个ACBD3敲低组细胞间荧光强度差异无统计学意义。因此,与对照组细胞相比,ACBD3敲低组细胞Fe2+浓度升高。见图4。

图4 野生型细胞与ACBD3敲低组细胞内总铁含量和Fe2+水平比较A:Calcein-AM探针标记对照组和ACBD3敲低组细胞 ×40;B:各组细胞内总铁含量统计学分析;C:FerroOrange探针标记对照组和ACBD3敲低组细胞 ×40;D:各组细胞内Fe2+含量统计学分析;1:对照组;2:ACBD3 sh1组;3:ACBD3 sh2组;与对照组比较:***P<0.001
3 讨论
铁死亡是一种铁依赖的细胞膜氧化损伤进而引发的调节性细胞死亡,与细胞凋亡、坏死和细胞自噬存在较大区别[6]。近年来,多项研究[7-8]表明,铁死亡在肿瘤抑制以及某些癌症治疗过程中发挥重要作用,因此,靶向诱导铁死亡已成为肿瘤研究热点之一。
细胞膜中含有大量磷脂分子,它们由单不饱和脂肪酸和多不饱和脂肪酸组成。在ROS和铁离子存在的条件下,多不饱和脂肪酸可被氧化产生脂质过氧化物,从而引起细胞膜破损,导致细胞铁死亡[1]。在生理条件下,细胞可利用自身的抗氧化系统进行调控,避免细胞膜损伤。因此,测定脂质过氧化物是研究细胞铁死亡的一个重要标准。本研究中,ACBD3敲低组细胞显著增加了对铁死亡诱导剂RSL3的敏感性,在RSL3浓度为2.56 μmol/L时细胞活力显著下降。进一步实验结果表明,ACBD3敲低可使细胞内ROS水平提高、脂质过氧化水平明显增加。
维持细胞铁稳态是细胞进行正常生理功能的必要条件,破坏铁稳态将导致机体发生多种病变[9]。例如,铁过载引发的铁死亡在多种心血管疾病发展过程中有重要作用[10]。Cheah et al[5]报道,ACBD3可与铁离子转运蛋白DMT1相互作用,它们与Ras超家族G蛋白Dexras1一起,维持细胞内铁离子稳态。铁离子的存在是发生铁死亡不可或缺的条件。实验结果表明,ACBD3敲低导致的细胞内Fe2+浓度显著提高,进一步证实敲低ACBD3促进了细胞铁死亡过程,但是,ACBD3敲低导致的细胞内Fe2+浓度升高的的分子机制仍需进一步研究。
ACBD3在亨廷顿舞蹈症等神经退行性疾病患者以及乳腺癌等肿瘤患者中表达量均显著上调[11-12]。神经退行性疾病患者的中枢神经系统及周围神经系统的特定区域可发生明显的细胞铁死亡现象。铁死亡在肿瘤的放射治疗过程中亦具有重要作用[13]。因此,阐明ACBD3在铁死亡过程中的作用机制,合理干预细胞铁死亡进程,可为相关疾病的诊疗提供重要解决方案。

