hUC-MSCs对大鼠膝骨软骨缺损的修复作用
程 刚,张 峰,吴玉娇,袁晓阳,徐 靓,王 康,魏 伟,严尚学
关节软骨受损作为骨关节炎最常见的危险因素之一,通常是由于磨损或损伤而导致[1]。关节软骨作为一种高度分化的组织,自我修复能力有限[2]。软骨缺损大多是无症状的,如果不能及时发现并治疗通常会逐渐加重为骨关节炎[3]。传统的治疗方法包括微骨折、自体软骨细胞移植等。虽然取得了一些成功,但存在一定的局限性阻碍其临床应用[4]。
间充质干细胞(mesenchymal stem cells, MSCs)疗法在许多研究和临床试验中显示出良好的治疗效果[5-6]。MSCs因其多系分化潜能和免疫调节能力而成为软骨再生的可替代细胞来源。MSCs可以从各种组织中分离出来,包括人的脐带[7]等。人脐血源性间充质干细胞(human umbilical cord mesenchymal stem cells, hUC-MSCs)具有细胞采集无创、免疫原性低的优点,提供足够的细胞作为细胞治疗的异体来源[8]。尽管MSCs及其在基于细胞的再生医学中的应用的信息越来越多,但MSCs在软骨修复中的作用和机制仍不清楚[9]。该实验以膝骨软骨缺损大鼠模型为对象,观察关节腔移植hUC-MSCs对软骨修复的作用,为临床治疗关节软骨缺损提供实验依据。
1 材料与方法
1.1 实验动物雄性SPF级10周龄SD大鼠,体质量约280~320 g,购自斯贝福(北京)生物科技有限公司,合格证号:SCXK(京)2019-0100,用于制备关节软骨缺损模型。雄性SPF级SD大鼠,体质量约120 g,安徽省实验动物中心提供,合格证号:SCXK(皖)2017-001,用于制备关节软骨细胞。本实验已通过安徽医科大学临床药理研究所动物实验伦理审查委员会批准(编号:PZ-2020-044)。
1.2 细胞与试剂hUC-MSCs(批号:NCM1912P3)由安徽中盛溯源生物科技有限公司提供,实验前均进行表型鉴定、计数和活力检查。兔抗Ⅰ型胶原(CollagenⅠ, Col Ⅰ)抗体购自美国Affinity公司;兔抗Ⅱ型胶原(Collagen Ⅱ, Col Ⅱ)抗体、兔抗性别决定区域Y相关的高迁移率族框9抗体(SRY-box transcription factor 9, SOX9)购自美国Abcam公司,;兔抗增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)抗体购自美国CST公司;Ⅱ型胶原酶购自美国Sigma公司。
1.3 主要仪器激光共聚焦成像显微镜(型号:Leica TCS SP8;德国Leica公司);玻片扫描仪(型号:Pannoramic MIDI;匈牙利3D公司);高内涵细胞成像系统(型号:ImageXpress Micro 4;美国Molecular Devices公司 )。
1.4 实验方法
1.4.1SD大鼠膝骨软骨缺损模型建立 舒泰(50 mg/kg)麻醉后,大鼠取仰卧位,以膝关节为中心备皮及局部消毒。手术布盖住手术部位,沿髌骨内侧作纵向切口,钝性分离避免出血。向外侧挤压髌骨,将髌骨外侧脱位,暴露膝关节面后,用电钻在股骨表面软骨的滑车槽中造成一个直径2 mm,深度2 mm的缺损。生理盐水冲洗残渣。髌骨复位后闭合关节腔,缝合股内侧肌和皮肤。假手术组大鼠仅打开关节腔即缝合。术后每日青霉素20万单位肌注以防感染,持续3 d。
1.4.2分组及给药 造模后1周将模型大鼠随机分为模型组和hUC-MSCs移植组,每组8只,hUC-MSCs移植组大鼠经麻醉后手术侧关节腔注射2×106个hUC-MSCs/50 μl;假手术组另取8只大鼠行假手术,假手术组及模型组注射50 μl生理盐水作为对照。给药后10周处死大鼠观察组织修复情况。
1.4.3软骨细胞的分离培养 超净台内手术刀片轻削大鼠膝关节软骨,使用无菌眼科剪将关节软骨剪碎成约为1 mm3的碎片,加入0.2%ColⅡ于6.5 cm2小皿中,置于37 ℃培养箱中过夜消化,结束后加入新鲜完全培养基终止消化并吹散混匀,40 μm滤器滤除未消化残渣后离心,加入完全培养基重悬后接种于培养瓶中,48 h后首次换液。待细胞长满后进行传代处理,实验选用第二代软骨细胞进行后续实验。
1.4.4软骨细胞的鉴定 甲苯胺蓝染色和ColⅡ免疫细胞化学染色鉴定软骨细胞。细胞接种于爬片,待细胞贴壁后取出爬片,4%多聚甲醛固定20 min,3%过氧化氢室温下孵育10 min,5%山羊血清封闭10 min,滴加ColⅡ一抗4 ℃过夜孵育。复温后滴加生物素标记的二抗室温孵育30 min。DAB显色,苏木精复染,梯度乙醇脱水,中性树脂封片。倒置相差显微镜观察拍照。软骨细胞固定后用甲苯胺蓝染色5 min,梯度乙醇脱水后中性树脂封片。
1.4.5hUC-MSCs对大鼠软骨细胞的增殖和迁移作用 Transwell小室共培养检测hUC-MSCs对软骨细胞的增殖和迁移作用。增殖实验:将消化后的软骨细胞接种于24孔板,每孔5×104个细胞,Transwell小室插入孔板中,等量hUC-MSCs接种于小室内;分别共培养24、48、72 h后取出,4%多聚甲醛固定20 min,4',6-二脒基-2-苯基吲哚(DAPI)避光孵育5 min后,使用高内涵细胞成像系统观察计数。迁移实验:下室接种5×104个hUC-MSCs,上室接种等量大鼠软骨细胞,上下室均为10%FBS完全培养基环境;共培养20 h后取出小室,加入0.1%结晶紫溶液,染色15 min,PBS清洗,显微镜下观察拍照。
1.4.6大鼠软骨缺损大体形态学观察 关节腔注射药物10周后,麻醉处死大鼠,取缺损侧股骨滑车,去除周围软组织,进行大体形态学观察。采用国际软骨修复协会(the International Cartilage Repair Society, ICRS)的大体评估标准进行评分[10],比较hUC-MSCs关节腔注射对膝关节软骨缺损的修复效果。
1.4.7病理学检查 软骨组织经10%甲醛室温固定后,脱钙、石蜡纵向包埋、切片后分别进行HE染色、番红O-固绿染色和Masson染色,镜下观察组织病理学变化。
1.4.8免疫组织化学检测ColⅠ、ColⅡ、PCNA在软骨组织中的表达水平 切片经烘烤、二甲苯脱蜡、梯度乙醇水化后,分别用Triton X-100通透、枸橼酸热修复抗原、3%过氧化氢内源性阻断和5%山羊血清封闭后,一抗4 ℃孵育过夜,次日复温后加二抗室温孵育30 min,DAB显色和苏木精复染后梯度乙醇脱水,中性树脂封片,波扫仪扫描玻片。
1.4.9免疫荧光检查软骨组织中SOX9表达 切片脱蜡水化后分别Triton X-100通透、枸橼酸热修复抗原、3%过氧化氢内源性阻断、5%山羊血清封闭,一抗4 ℃过夜孵育。次日复温后滴加荧光二抗室温避光孵育2 h,DAPI孵育10 min,PBS清洗后倒置于滴加抗荧光淬灭剂的载玻片上,指甲油固定,激光共聚焦成像显微镜下观察软骨组织中SOX9的表达。
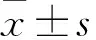
2 结果
2.1 大体观察假手术组动物关节滑车表面整齐,色泽鲜亮;模型组动物存在明显凹陷,低于正常软骨组织高度,边界融合度差,软骨表面修复处存在明显裂纹,软骨透明度较差。hUC-MSCs移植组缺陷处高度与周围正常软骨厚度相近,边界融合度较好,修复的软骨表面较光滑,多已被半透明或白色的修复组织填充(图1)。对修复组织通过ICRS评分标准进行评估,模型组的ICRS评分低于假手术组[(6.25±1.17)vs(12.00±0.00),F=6.05,P<0.01]。hUC-MSCs移植组的ICRS评分为(9.75±1.59),高于模型组的(6.25±1.17)(F=52.24,P<0.01)。
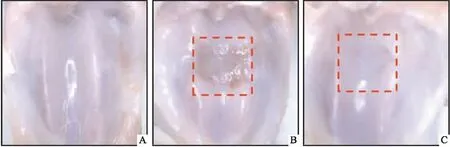
图1 软骨缺损组织再生大体观察(n=8) A:假手术组;B:模型组;C:hUC-MSCs移植组
2.2 hUC-MSCs移植对软骨缺损组织病理的影响对大鼠软骨缺损组织切片进行病理学检查,观察各组大鼠缺损组织的病理改变。HE结果显示,hUC-MSCs移植组关节软骨高度接近周围正常软骨水平,修复组织的整体轮廓与正常软骨相似,细胞形态和排列与周围正常软骨相似。而模型组细胞形态和排列与周围正常软骨不同,缺损部位填充较差(图2 A1~A3)。番红O-固绿染色结果显示,在假手术组中组织染色程度高,红色软骨组织明显。hUC-MSCs移植组与模型组相比显示出番红O的强阳性染色,表明hUC-MSCs移植组修复组织含有更多的蛋白多糖沉积,软骨修复效果较于模型组更完整(图2 B1~B3)。Masson染色结果显示,hUC-MSCs移植组相较于模型组,修复组织中蓝染更明显,胶原纤维含量更丰富,接近于假手术组(图2 C1~C3)。
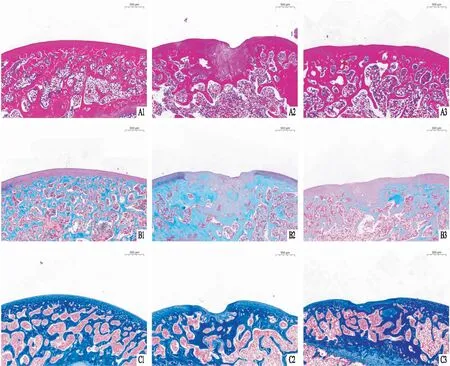
图2 hUC-MSCs移植对软骨缺损组织病理的影响 ×50A:HE染色;B:番红O-固绿染色;C:Masson染色;1:假手术组;2:模型组;3:hUC-MSCs移植组
2.3 hUC-MSCs对软骨缺损组织ColⅠ、Col Ⅱ和PCNA表达的影响进行免疫组织化学染色以进一步表征软骨缺损中的修复组织。免疫组化结果显示,各组组织中Col Ⅰ、Col Ⅱ的表达水平差异有统计学意义(F=79.25,F=65.03,P<0.01)。与假手术组相比,模型组Col Ⅱ蛋白表达水平降低(P<0.01),而ColⅠ蛋白表达水平升高(P<0.01)。与模型组比较,hUC-MSCs移植可升高Col Ⅱ的表达(P<0.01),降低ColⅠ的表达水平(P<0.01),但与假手术组的天然软骨相比仍有差距(P<0.01)(如图3A1~B3)。免疫组化结果显示,各组组织中PCNA的表达水平差异有统计学意义(F=57.60,P<0.01)。与假手术组相比,模型组中PCNA阳性细胞数量增加(P<0.05)。与模型组比较,hUC-MSCs移植组中PCNA阳性细胞显著增多(P<0.01),见图3 C1~C3。
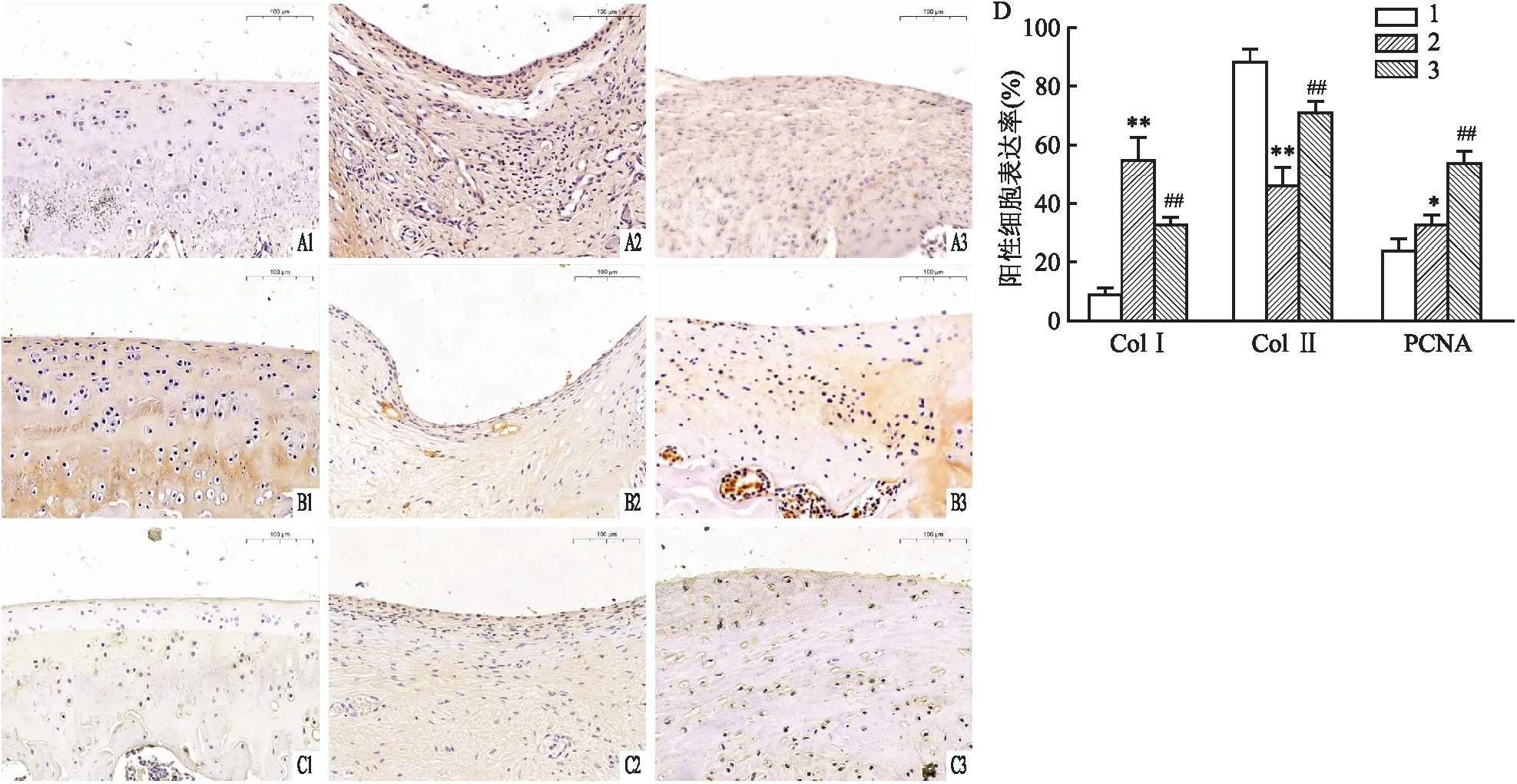
图3 hUC-MSCs对缺损组织Col Ⅰ、Col Ⅱ和PCNA表达的影响 ×400A:Col Ⅰ染色;B:Col Ⅱ染色;C:PCNA染色;D:免疫组化阳性细胞表达率统计图;1:假手术组;2:模型组;3:hUC-MSCs移植组;与假手术组比较:*P<0.05,**P<0.01;与模型组比较:##P<0.01
2.4 hUC-MSCs对软骨缺损组织中SOX9表达的影响免疫荧光检查结果显示,各组组织中SOX9表达水平差异有统计学意义(F=71.27,P<0.01)。假手术组中SOX9主要在细胞核内表达,模型组中SOX9则主要分散在核周围,表达水平低于假手术组,而hUC-MSCs移植组SOX9表达水平高于模型组(P<0.01),表明hUC-MSCs移植可促进SOX9入核增加。见图4。
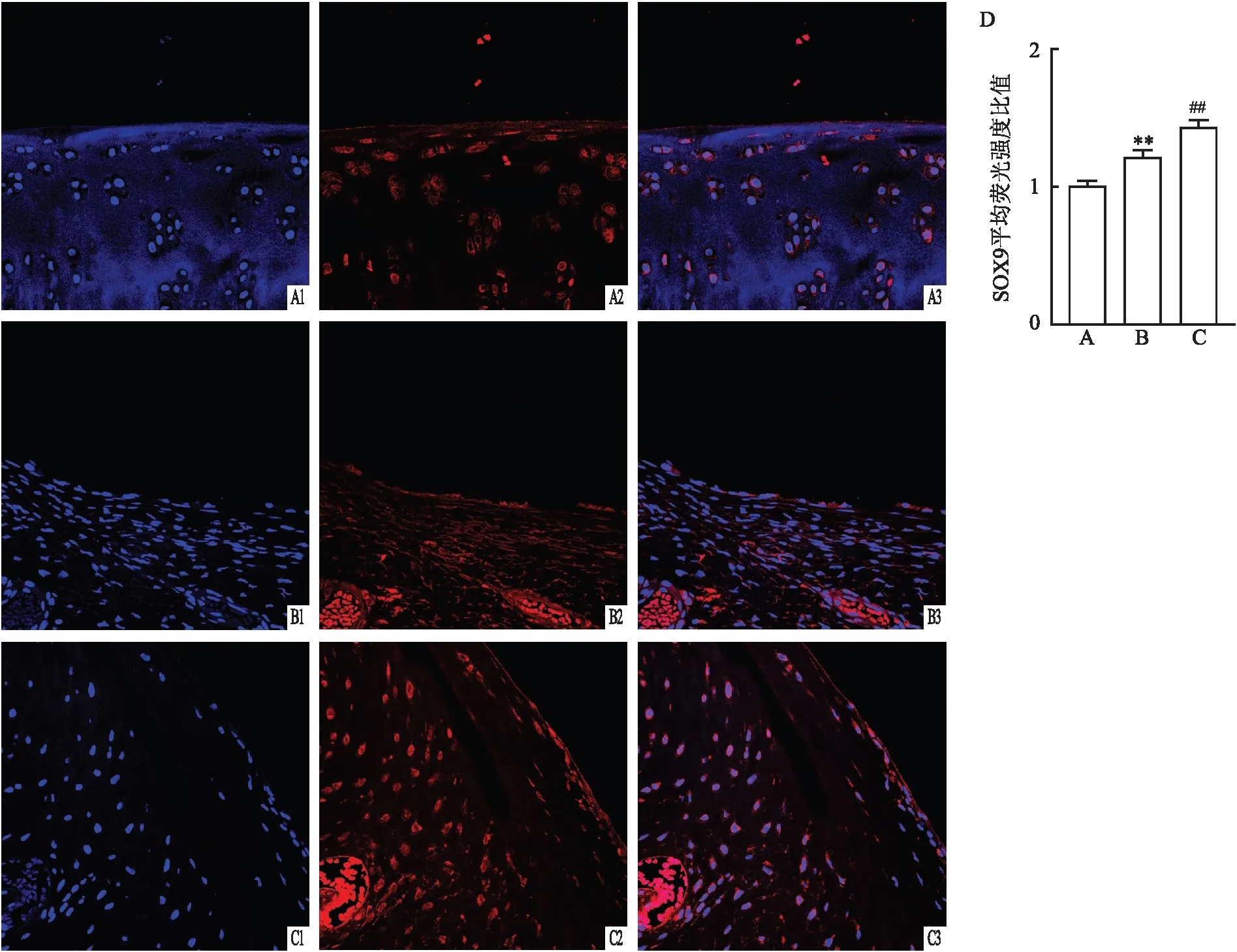
图4 hUC-MSCs对软骨缺损组织中SOX9表达的影响 ×400A:假手术组;B:模型组;C:hUC-MSCs移植组;D:SOX9表达统计图;1:DAPI染色;2:SOX9染色;3:染色合并图;与假手术组比较:**P<0.01;与模型组比较:##P<0.01
2.5 软骨细胞形态学观察及鉴定经胶原酶消化分离得到的原代软骨细胞形态贴壁后成卵圆形或多角形,细胞可见成簇状。软骨细胞经甲苯胺蓝染色后可见细胞内蓝色颗粒,Col Ⅱ染色后,细胞胞质呈褐色阳染,阳性细胞率约为97%,见图5。
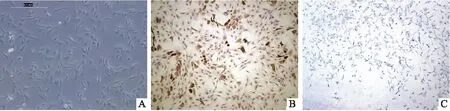
图5 大鼠软骨细胞形态及鉴定 ×100A:大鼠软骨细胞形态;B:Col Ⅱ染色;C:甲苯胺蓝染色
2.6 hUC-MSCs体外共培养对软骨细胞增殖的影响体外以hUC-MSCs和软骨细胞分别为1 ∶1、1 ∶5、1 ∶10的比例进行共培养,结果显示,1 ∶1共培养可显著促进软骨细胞增殖且增殖效果最好(t=16.37,P<0.01),后续选用1 ∶1进行实验(图6 D)。以1 ∶1的比例进行共培养以检测24、48、72 h不同时间hUC-MSCs对软骨细胞增殖能力的影响,DAPI染色结果显示,共培养条件下hUC-MSCs在不同时间对软骨细胞的增殖作用都有所增强,且72 h下增殖效果最明显(t=8.11,P<0.01)(图6 E)。
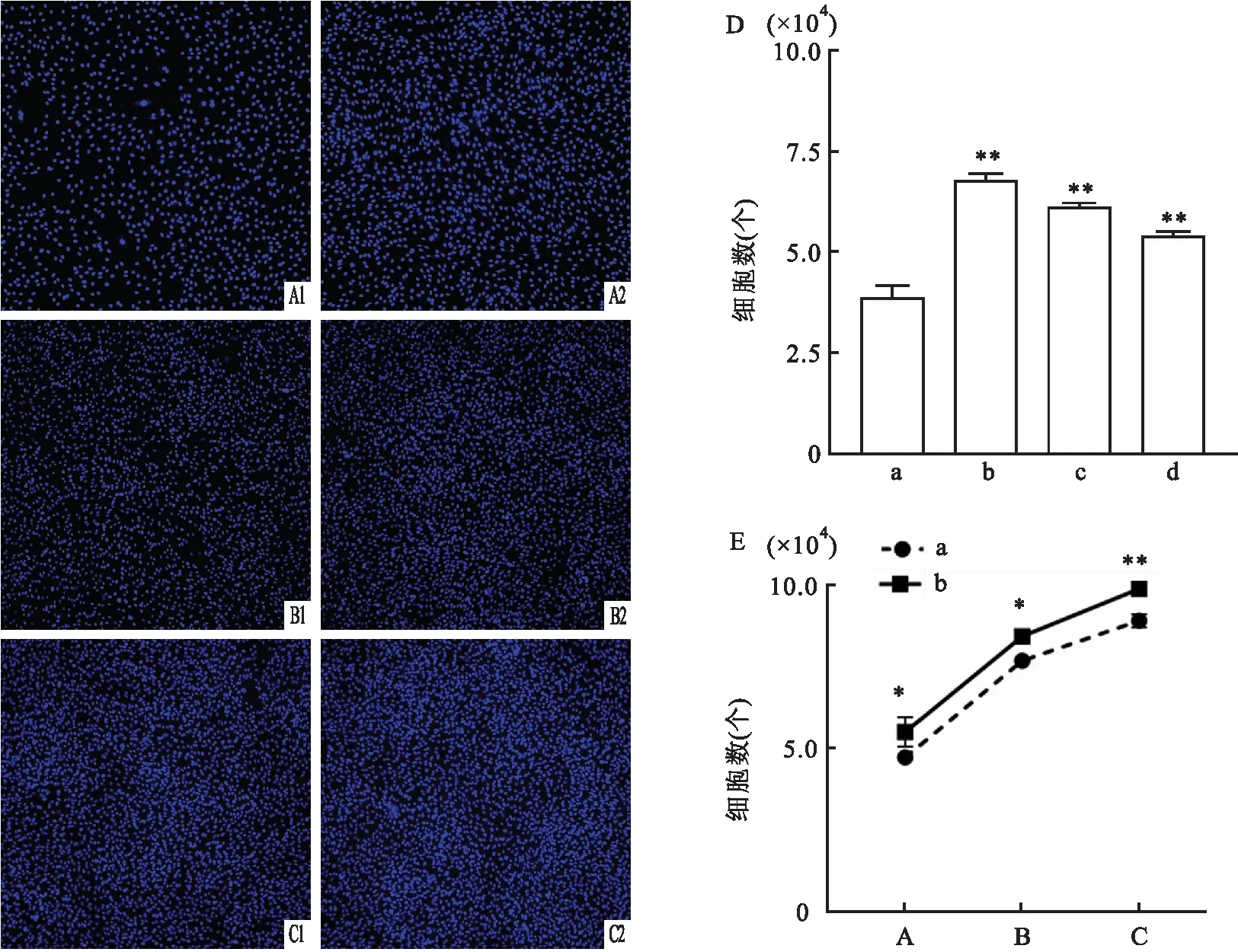
图6 hUC-MSCs体外共培养对软骨细胞增殖的影响(n=3) ×10A:24 h组;B:48 h组;C:72 h组;D:不同共培养比例对软骨细胞增殖能力影响统计图;E:不同共培养时间对软骨细胞增殖能力影响统计图;1:对照组;2:共培养(1 ∶1)组;a:对照组;b:共培养(1 ∶1)组;c:共培养(1 ∶5)组;d:共培养(1 ∶10)组;与对照组比较:*P<0.05,**P<0.01
2.7 hUC-MSCs体外共培养对软骨细胞迁移的影响Transwell小室检测hUC-MSCs对软骨细胞迁移的影响,结晶紫染色后显微镜下观察可见,与对照组相比,软骨细胞迁移明显增多,通过对迁移细胞计数,统计作图分析可得hUC-MSCs共培养后软骨细胞的迁移能力增强,差异有统计学意义(t=11.37,P<0.01)。见图7。
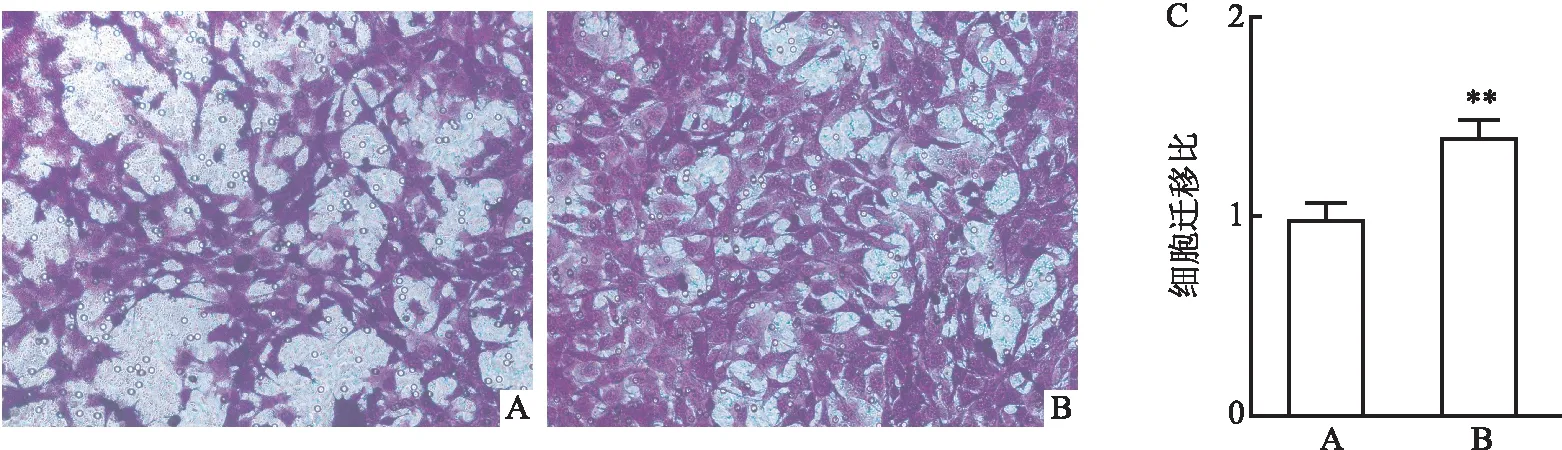
图7 hUC-MSCs体外共培养对软骨细胞迁移的影响(n=3) ×200A:对照组;B:共培养组;C:细胞迁移统计图;与对照组比较:**P<0.01
3 讨论
正常情况下关节软骨细胞处于相对静息状态,当软骨发生损伤时,软骨细胞大量丢失,软骨基质发生降解[10]。关节软骨损伤进一步加重发生退行性变化,特征表现为蛋白多糖含量减少和胶原基质降解[11]。目前,临床上对软骨缺损治疗尚无有效的手段,再生医学的最新进展启发人们可以利用宿主的先天再生潜力来进行自我修复[12]。近年来,外源性植入MSCs,可通过旁分泌作用调节局部微环境以刺激宿主的先天再生活动,取得了一定的治疗效果,但是其作用和相关机制仍不明确。在本研究中,hUC-MSCs膝关节腔注射10周可较完整地修复软骨缺损部位,且缺损部位关节面较模型组光滑透明,无明显裂纹,细胞形态和排列与周围正常关节软骨组织相似,番红染色显示的软骨(红色)厚度明显增加,软骨基质(蓝色)填充明显增多,ICRS评分显著升高,提示hUC-MSCs移植对大鼠膝关节软骨缺损具有明显的修复作用。
ColⅠ和Col Ⅱ分别作为纤维软骨和透明软骨的主要标志物,可反应软骨修复的程度和类型。免疫组化结果显示,hUC-MSCs移植后ColⅠ表达降低,Col Ⅱ表达上升,提示hUC-MSCs移植修复的是透明软骨而非纤维软骨。由于软骨无血管的特殊结构,以及软骨细胞周围致密的细胞外基质阻碍软骨细胞运动,因此促进软骨细胞的增殖和体内软骨细胞的迁移对软骨修复十分必要[13]。本研究中免疫组化结果显示,hUC-MSCs移植组修复组织中PCNA阳性细胞数明显增加,且hUC-MSCs体外共培养可促进软骨细胞增殖与迁移,表明hUC-MSCs在体内外均可增加软骨细胞迁移和增殖,这可能与hUC-MSCs通过旁分泌的方式促进靶细胞的增殖、增强募集从而增加软骨细胞的数量有关[14]。有研究[15]表明,SOX9是激活软骨细胞的特异性因子,作为软骨形成的主要调节因子是软骨形成所必需的,表达于正常软骨细胞中。在本研究中免疫荧光结果显示,hUC-MSCs移植后修复组织中SOX9的表达可显著提高,且SOX9入核增加,表明hUC-MSCs可促进软骨细胞SOX9的表达及入核,加速软骨再生。
综上所述,关节腔移植hUC-MSCs对大鼠膝关节软骨缺损具有明显的修复作用,其修复机制可能与保护软骨基质和促进软骨细胞增殖迁移有关。hUC-MSCs移植或可作为软骨缺损再生的新途径。

