早期抑制TLR4对新生大鼠HIBD后青春期脑海马免疫功能的影响
黄晓丽,欧阳志翠,吴祥宏,李 燕,黄 赟,刘国琼,陆诗微,唐 振
新生儿缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)是新生儿期严重的神经损伤性疾病,存活者可遗患脑瘫、癫痫等远期神经功能障碍。HIBD发病机制复杂,涉及能量衰竭、自由基产生、离子失衡、兴奋性神经递质累积、氧化应激反应等多个方面[1]。神经免疫功能紊乱是参与HIBD发病的重要机制之一,各种免疫细胞激活及免疫因子异常释放参与HIBD急性神经细胞死亡及远期神经功能损伤。Toll样受体4(Toll-like receptor 4,TLR4)是一种广泛分布于神经细胞膜表面的重要模式识别受体,脑组织发生缺血、创伤等损伤后,TLR4 表达上调并通过多条信号通路放大神经炎症联级,介导急慢性脑损伤的形成[2-3]。前期研究[4]表明缺氧缺血(hypoxic-ischemia,HI)后24h,脑海马TLR4表达升高,早期抑制TLR4表达能减轻新生大鼠HI后脑海马神经元缺失,并从行为学上改善大鼠青春期脑损伤预后,然而TLR4介导何种神经免疫机制参与HIBD目前并不清楚。
该研究通过早期抑制TLR4探讨其调控新生大鼠HIBD模型脑海马内各种免疫细胞活化及免疫因子表达情况,以揭示TLR4介导HIBD脑海马损伤的神经免疫机制,为开发HIBD免疫调节治疗方法提供理论依据。
1 材料与方法
1.1 动物模型建立本研究经桂林医学院伦理委员会批准(NO:GLMC202103095)。生后7 d体质量在13~19 g的Sprague Dawley大鼠按照Rice方法建立HIBD模型[5],新生大鼠经七氟烷(4%诱导,2%维持)吸入麻醉后固定,触摸左颈总动脉波动位置,切开皮肤,显微镜下分离肌肉及神经,暴露左颈总动脉,5-0缝合线双结扎后中间处离断颈总动脉,缝合皮肤,麻醉时间不超过5 min。待幼仔麻醉苏醒后放回母鼠窝内,1 h后将幼仔放入恒温37.0 ℃水浴缺氧箱(自制)中,接8%O2/92%N2混合气体1.5 L/min,维持氧浓度(8.0%±0.1%),无水氯化钙吸收动物呼出CO2,缺氧2 h后放入母鼠处。Control组大鼠仅给予切开皮肤分离并暴露颈总动脉,既不给予结扎,也不给予缺氧。
1.2 分组与给药新生大鼠按体质量随机区组分成:对照(Control)组、HI组、HI+TLR4抑制剂TAK-242组(TAK-242组)。TAK-242用1%二甲基亚砜(DMSO)溶解,终浓度为0.1 mg/ml。结合课题组预实验确定TAK-242用药剂量为0.5mg/kg,于缺氧缺血前30 min腹腔内单次注射。Control组和HI组相同时间腹腔注射等体积生理盐水。
1.3 主要试剂TAK-242购自美国MCE公司;兔抗大鼠TLR4抗体(1 ∶200)、兔抗大鼠ICAM-1抗体(1 ∶200)、兔抗大鼠Iba-1抗体(1 ∶200)、兔抗大鼠GFAP抗体(1 ∶200)、兔抗大鼠MPO抗体(1 ∶200)、兔抗大鼠CD3抗体(1 ∶200)、兔抗大鼠IL-1β抗体(1 ∶1 000)、兔抗大鼠IL-10抗体(1 ∶1 000)及兔抗大鼠β-actin抗体(1 ∶5 000)购自英国Abcam公司;兔抗大鼠TNF-α抗体(1 ∶1 000)购自美国Santa Cruz公司;兔抗大鼠C3a抗体(1 ∶200)购自武汉 ABclonal公司;兔抗大鼠CD161抗体(1 ∶200)购自英国Serotec公司。
1.4 免疫组化及免疫荧光大鼠戊巴比妥(40 mg/kg)腹腔注射麻醉,心脏灌注后留取脑组织4%多聚甲醛中固定,石蜡包埋后切取5 μm切片先后浸入二甲苯和乙醇梯度中脱蜡水化,然后放入煮沸的柠檬酸(pH 6.0)抗原修复20 min后3%H2O2中浸泡10 min,5%山羊血清室温封闭30 min,特异性一抗4 ℃孵育过夜,次日取出玻片,PBS洗涤后相应二抗室温孵育30 min。二氨基联苯胺(DAB)显色后光学显微镜下观察并采集图片,Image Pro Plus 6.0系统分析阳性区域的百分比。
用于免疫荧光检测的5 μm切片经抗原修复后浸入0.5%Triton X-100中30 min,PBS洗涤后5%BSA封闭30 min。加入特异性一抗并在4 ℃下孵育过夜。次日取出切片洗涤后加入相应的荧光二抗避光室温孵育60 min。DAPI复染后抗荧光猝灭剂和中性树脂封片。暗室中荧光显微镜观察并采图。Image Pro Plus 6.0系统计数海马CA1区阳性细胞数量。
1.5 Western blot实验BCA蛋白质分析试剂盒测定脑海马蛋白质浓度,制备12%十二烷基硫酸钠聚丙烯酰胺凝胶,每孔加入蛋白质(30 μg),80 V恒压分离20~30 min后110 V继续电泳60~90 min,恒流转膜1 h将蛋白移到PVDF膜上。封闭后将膜与特异性一抗体4 ℃孵育过夜。次日PBS洗涤后,相应二抗室温下孵育1 h,ECL化学发光显影后ChemStudio成像系统读取胶片并采集图片。Image J软件读取图片吸光度值。
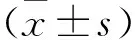
2 结果
2.1 TAK-242早期处理对HIBD后脑海马区TLR4表达影响免疫组化显示HI后3 d各组大鼠脑海马组织中TLR4呈黄褐色阳性表达,主要定位表达在神经细胞胞膜;HI组左侧脑海马CA1、CA3及DG区TLR4表达较Control组升高(P<0.01或P<0.05),而TAK-242组左侧海马CA1、CA3及DG区TLR4表达较HI组降低(P<0.05)。见图1。
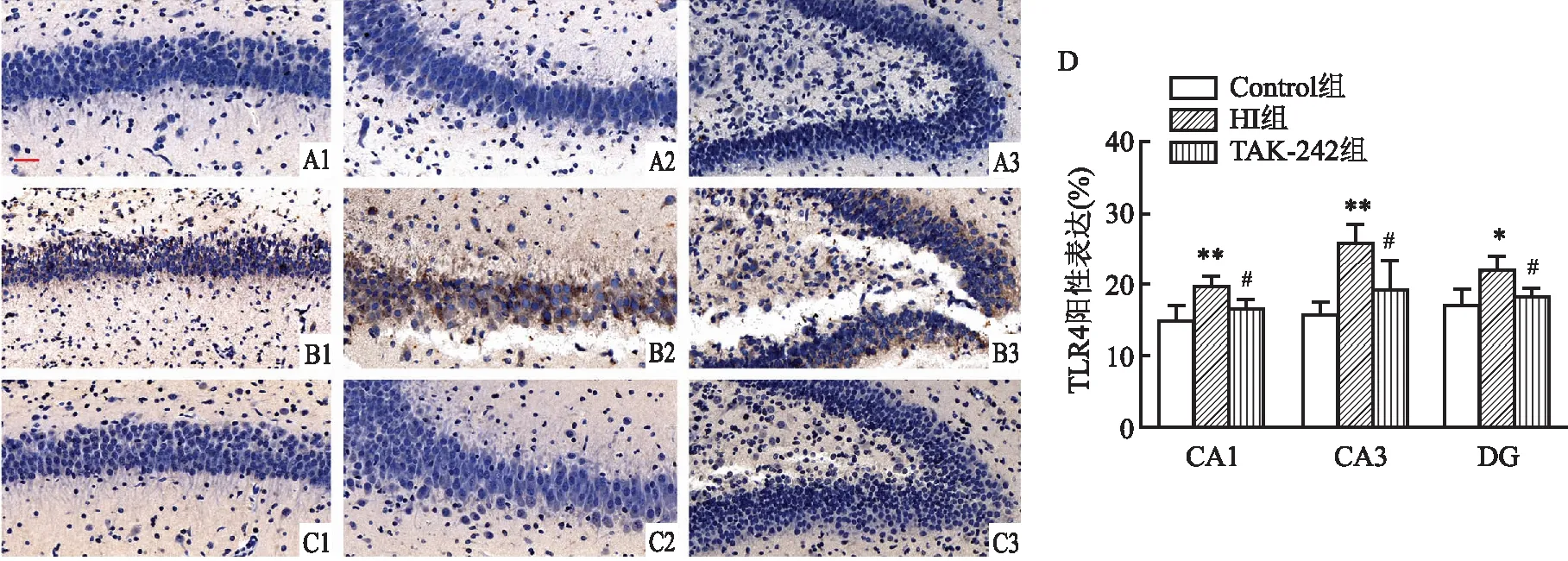
图1 HI后3 d各组大鼠海马不同区域TLR4免疫组化图 ×400A:Control组;B:HI组;C:TAK-242组;1:CA1区;2:CA3区;3:DG区;D:HI后3 d各组大鼠海马TLR4相对表达直方图(n=3);与Control组比较:*P<0.05,**P<0.01;与HI组比较:#P<0.05
2.2 早期抑制TLR4对HIBD后新生大鼠青春期脑海马Iba-1+小胶质细胞及GFAP+星形胶质细胞的影响HI后21 d HI组左侧脑海马CA1区GFAP+细胞数量较Control组增多(P<0.01),TAK-242组左侧脑海马CA1区GFAP+细胞数量较HI组减低(P<0.05)然而各组左侧脑海马CA1区Iba-1+细胞数量差异无统计学意义(F=1.301,P=0.331)。见图2。
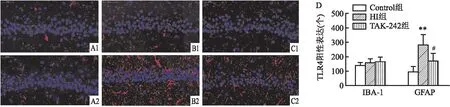
图2 HI后21 d各组大鼠海马CA1区Iba-1+细胞及GFAP+细胞免疫荧光图 ×400A:Control组;B:HI组;C:TAK-242组;1:Iba-1+细胞;2:GFAP+细胞;D:各组大鼠海马CA1区Iba-1+细胞数量及GFAP+细胞数量比较;n=3~4;与Control组比较:**P<0.01;与HI组比较:#P<0.05
2.3 早期抑制TLR4对HIBD后新生大鼠青春期脑海马CA1区MPO+中性粒细胞、CD161+自然杀伤细胞及CD3+T细胞的影响HI后21 d HI组左侧脑海马CA1区CD3+T细胞数量较Control组增多(P<0.05);尽管TAK-242组左侧脑海马CA1区CD3+T细胞数量较HI组减低,但差异无统计学意义;各组大鼠左侧脑海马CA1区MPO+中性粒细胞数量及CD161+自然杀伤细胞数量差异无统计学意义(FMPO+细胞=1.279,P=0.336;FCD161+细胞=1.612,P=0.266)。见图3。
图3 HI后21 d各组大鼠海马CA1区MPO+细胞、CD161+细胞及CD3+细胞免疫荧光图及其直方图 ×400A:Control组;B:HI组;C:TAK-242组;1:MPO;2:CD161;3:CD3;D:各组大鼠海马CA1区MPO+、CD161+及CD3+细胞数量比较;n=3~4;与Control组比较:**P<0.01
2.4 早期抑制TLR4对HIBD后新生大鼠青春期脑海马CA1区黏附因子ICAM-1及补体C3a表达的影响HI后21 d HI组左侧脑海马CA1区ICAM-1表达平均吸光度值较Control组增高(P<0.05),但TAK-242不能降低HI后左侧脑海马CA1区ICAM-1表达水平增加(P>0.05)。各组大鼠左侧脑海马CA1区C3a表达平均吸光度值差异并无统计学意义(F=1.274,P=0.337)(图4A、B)。
2.5 早期抑制TLR4对HIBD后新生大鼠青春期脑海马TNF-α、IL-1β及IL-10表达的影响HI后21 d HI组左侧脑海马TNF-α及IL-1β表达较Control组增高,TAK-242组TNF-α及IL-1β表达较HI组降低,但差异无统计学意义;HI后21 d HI组左侧脑海马IL-10表达较Control组降低,TAK-242组IL-10表达较HI组上升,但差异无统计学意义。见图5。
3 讨论
小胶质细胞及星形胶质细胞是中枢神经系统常驻的免疫细胞,它们的数量和功能状态代表脑内神经免疫应答状态。脑损伤发生可诱导小胶质细胞持续活化,Loane et al[6]在小鼠脑创伤模型中发现,脑损伤1年后皮质中仍能观察到持续的小胶质细胞激活,并伴有炎症因子和氧化应激的标志物升高,这些与病灶扩张、海马神经退行性变和髓鞘丧失相关。尽管本研究并未在统计学上发现HIBD后21 d各组大鼠脑海马CA1区小胶质细胞有差异,但HI组小胶质细胞数量较Control组高[(161.3±22.7)/fieldvs(143.3±17.7)/field];反应性星形胶质细胞形成是HI诱导星形胶质细胞活化的重要形式,40%HIBD婴儿脑白质内存在反应性星形胶质细胞[7],本研究亦显示HI后21 d HI组脑海马星形胶质细胞数量仍高于对照组。TLR4定位表达于星形胶质细胞表面,并在其活化过程中发挥重要作用。LPS诱导的P14小鼠癫痫模型中发现,星形胶质细胞表面TLR4被激活并介导神经突触改变而诱发小鼠持续癫痫,TLR4阻断后星形胶质细胞活化下降,脑损伤减轻[8]。本研究证实抑制TLR4能够降低新生儿脑海马HIBD后21 d星形胶质细胞激活,这可能是改善新生儿HIBD神经损伤的一种方法。
损伤激活的外周免疫细胞通过破坏的血脑屏障进入脑内,与常驻免疫细胞一起参与脑损伤形成。中性粒细胞参与成人脑卒中后损伤形成,且与脑卒中后行为障碍相关。HI暴露的新生儿大脑中性粒细胞亦可迅速在脑组织中累积,参与HI所致神经损伤[9]。不同于中性粒细胞,新生儿HI后3~7 d T淋巴细胞才出现在损伤部位,并可长时间持续存在[10]。本研究亦发现HI后21 d CD3+T淋巴细胞在脑海马内明显升高,这些结果提示T淋巴细胞更可能参与HI后的慢性免疫炎症反应;成年脑缺血模型中发现HI后脑组织内有NK细胞浸润,且独立于T细胞参与脑损伤形成,尽管新生儿外周NK细胞功能不成熟,神经毒性作用弱,然而早期脾脏切除降低外周NK细胞水平仍对HIBD有神经保护作用[11]。TLR4是炎症细胞激活的重要受体,在脑卒中及脓毒血症发病过程中通过激活中性粒细胞、T淋巴细胞及NK细胞诱导脑损伤[12],课题组前期研究[13]亦发现早期抑制TLR4能够抑制HIBD后24 h及7 d时间点中性粒细胞,T淋巴细胞及NK细胞激活,然而本研究并未发现早期抑制TLR4能改善新生大鼠HIBD后青春期脑内海马组织中性粒细胞、T淋巴细胞及NK细胞数量改变,提示TLR4可能未参与新生儿HIBD远期脑损伤后中性粒细胞、T淋巴细胞及NK细胞激活。
TNF-α、IL-1β是两种重要的促炎细胞因子,脑损伤后短期内表达水平增加,与脑损伤的严重程度呈正相关,同时损伤诱导脑组织中免疫细胞的激活可影响抑炎因子如IL-10分泌。本研究并未发现新生大鼠HIBD后21 d海马区TNF-α、IL-1β及IL-10表达异常,需进一步动态观察免疫因子变化以明确其在HIBD中的作用。脑缺血或出血后,内皮细胞被激活并表达ICAM-1,形成黏附表面以降低免疫细胞运动并使其聚集在脑损伤部位。病毒性脑炎模型中,TLR4mut小鼠较TLR4WT小鼠表达更低水平ICAM-1,同时血脑屏障功能障碍得到改善[14]。本研究结果显示HIBD后21 d海马CA1区ICAM-1表达仍有升高,提示ICAM-1可能参与HIBD慢性损伤,TLR4早期干预并不能改善新生大鼠HIBD后青春期脑海马ICAM-1表达。补体C3是血清中含量最高的补体成分,在补体经典激活途径和旁路激活途径中均发挥重要作用。Jarlestedt et al[15]研究表明C3a基因缺陷小鼠HIBD较对照组严重,而早期给予外源性C3a治疗可以降低HIBD损伤。本研究结果未显示HI后21 d脑海马CA1区C3a表达异常,提示补体C3a并未参与TLR4通路介导的新生大鼠HIBD远期损伤。
该研究揭示TLR4能够介导新生大鼠HIBD后青春期脑海马星形胶质细胞激活,这为改善新生儿HIBD慢性损伤提供了一种免疫治疗的理论基础;然而TLR4介导HIBD后星形胶质细胞激活机制并不清楚,同时是否存在其他免疫机制参与HIBD远期脑损伤,这些有待进一步研究。

