厌氧处理条件下紫娟茶化学成分的变化及其对体外ACE活性的影响
杨高中,施江,张悦,彭群华,林智*,吕海鹏*
厌氧处理条件下紫娟茶化学成分的变化及其对体外ACE活性的影响
杨高中1,2,施江1,张悦1,彭群华1,林智1*,吕海鹏1*
1. 中国农业科学院茶叶研究所/农业农村部特种经济动植物生物学与遗传育种重点实验室,浙江 杭州 310008;2. 中国农业科学院研究生院,北京 100081
以紫娟茶树鲜叶为研究对象,对厌氧处理后制备的冻干样、绿茶、红茶、白茶等茶样中主要非挥发性成分(包括儿茶素、氨基酸、花青素等)进行测定,并采用高效液相色谱法评估其体外血管紧张素转换酶(Angiotensin-converting enzyme,ACE)抑制活性;此外,尝试通过分子对接模拟试验研究茶叶中主要化学成分和ACE之间潜在的互作机制。结果表明,经厌氧处理后的冻干样中-氨基丁酸(-aminobutyric acid,GABA)含量增加至1.72 mg·g-1,显著高于未厌氧处理茶样的0.04 mg·g-1(<0.05)。厌氧处理后不同的加工工艺对茶样中的氨基酸和多酚类化合物的组成及含量影响较大;采用白茶工艺能提高茶样中氨基酸组分含量,而冻干工艺能最大程度保留茶样中多酚类化合物含量。紫娟茶树鲜叶样品经厌氧处理后,体外ACE抑制活性显著增强(<0.05);厌氧处理后采用冷冻干燥工艺所制样品的ACE抑制活性最强,显著高于采用绿茶、白茶和红茶加工工艺制作的样品(<0.05)。此外,分子对接模拟试验发现,茶叶中的主要化学成分与ACE的相互作用强度与其分子结构中的亲水基团和芳香环结构有关。研究结果有助于揭示厌氧处理对紫娟茶ACE抑制活性的影响,为开发具有潜在治疗高血压等特殊功能型紫娟茶产品提供理论依据。
茶;-氨基丁酸;厌氧处理;加工工艺;血管紧张素转换酶
高血压是心血管疾病和过早死亡的一个重要的可改变的风险因素。从1990年到2019年,全球30~79岁的高血压人群几乎翻了一番[1]。血管紧张素转换酶(Angiotensin-converting enzyme,ACE)是肾素-血管紧张素系统中的一个关键酶,负责通过血管收缩调节血管张力,其失调可能导致高血压和心脑血管疾病[2]。抑制ACE可以有效降低血压,减少血栓形成和心血管疾病的风险,长期以来,抑制剂对ACE的体外抑制活性被作为筛选天然ACE抑制剂的重要因素[3]。
近年来,紫芽茶以其特殊的风味品质和保健功能引起了大家广泛关注[4]。与传统的绿叶茶相比,紫叶茶具有较多的生物活性成分[5],其中许多是潜在的天然ACE抑制剂,包括表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)[6]、表没食子儿茶素-3--(3"--甲基)没食子酸酯[Epigallocatechin 3--(3"--methyl) gallate,EGCG3"Me][7]、原花青素[8]和花青素[9]等,它们通过体外模型被证实具有显著的ACE抑制活性。紫娟(var.)是云南省农业科学院茶叶研究所从云南大叶群体种中选育而来,是我国最具代表性的紫芽茶品种之一。此前有报道称,在动物研究中,紫娟茶比云南大叶种茶树鲜叶制成的茶样具有更强的降血压效果[10]。值得注意的是,-氨基丁酸(-aminobutyric acid,GABA)被认为是一种重要的生物活性物质,可能在预防心血管疾病,特别是降低血压方面发挥有益的作用[11]。厌氧处理已被证实是提高茶叶产品中GABA含量的有效方法[12-13]。因此,推测经过厌氧处理后,通过增加紫娟茶中的GABA含量,可以提高其ACE抑制活性,有望开发出一些具有治疗高血压的紫娟茶产品,满足不同茶叶消费者对健康食品的特殊需求。
本研究以紫娟茶树鲜叶为研究对象,对厌氧处理后制备的冻干样、绿茶、红茶、白茶等茶样中主要非挥发性成分(儿茶素、氨基酸、花青素等)进行测定,并采用高效液相色谱法评估其体外ACE抑制活性[14-15];尝试通过分子对接模拟试验研究茶叶中主要化学成分(如儿茶素、茶黄素、花青素、GABA等)和ACE之间潜在的互作机制,旨在阐明厌氧处理后不同加工工艺对紫娟茶体外ACE抑制活性的影响,为开发具有潜在降血压的特殊紫娟茶产品提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品制备方法
紫娟茶树鲜叶(采摘标准为一芽三叶)于2022年6月8日采摘自中国农业科学院茶叶研究所嵊州基地。样品的制备流程及详细工艺参数如图1所示,将1 kg鲜叶摊放处理8 h后,立即在液氮中预冻处理,随后使用真空冷冻干燥机进行冷冻干燥,标记为对照组。此外,将5 kg鲜叶分装入塑料袋,并进行真空处理8 h。随后各取出1 kg鲜叶分别采用真空冷冻冻干以及白茶和绿茶加工工艺制备茶样,剩余2 kg鲜叶采用红茶加工工艺制备红茶样。使用研磨机将所有样品研磨成粉末,并保存在–20 ℃冰箱待进一步分析。
1.1.2 主要试剂
儿茶素(Catechin,C)、表儿茶素(Epicatechin,EC)、儿茶素没食子酸酯(Catechingallate,CG)、表儿茶素没食子酸酯(Epicatechingallate,ECG)、没食子儿茶素(Gallocatechin,GC)、表没食子儿茶素(Epigallocatechin,EGC)、没食子儿茶素没食子酸酯(Gallocatechingallate,GCG)、EGCG、EGCG3''Me(98.0%)、茶黄素(Theaflavin,TF)、茶黄素-3-没食子酸酯(Theaflavin-3-gallate,TF3G)、茶黄素-3'-没食子酸酯(Theaflavin-3'-gallate,TF3'G)、茶黄素-3,3'-双没食子酸酯(Theaflavin-3,3'-digallate,TFDG)、马尿酰-组氨酰-亮氨酸(Hippuryl-histidyl-leucine,HHL)(BR,98.0%)、马尿酸(>98.0%)、硼酸-硼砂缓冲液(pH 8.3)购自上海源叶生物技术有限公司。天冬氨酸、苏氨酸、丝氨酸、天冬氨酸、谷氨酸、脯氨酸、甘氨酸、丙氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、酪氨酸、苯基丙氨酸、组氨酸、色氨酸、精氨酸、胱氨酸、赖氨酸、没食子酸(Gallic acid,GA)、GABA(纯度为95.0%~99.0%)、GABA(97.0%)和ACE(≥2.0 units·mg-1)购自上海Sigma-Aldrich公司。-茶氨酸(>99.0%)和甲酸(>98.0%)购自北京百灵威科技有限公司。茚三酮(固体)和柠檬酸锂盐缓冲液(pH分别为2.9、4.2、8.0)购自杭州津本科学仪器有限公司。磷酸(85%~90%)、氯化钾和三氟乙酸(≥98.0%)购自上海麦克林生化科技有限公司。乙腈和甲醇(色谱纯)购自德国默克公司。纯净水购自杭州娃哈哈集团有限公司。
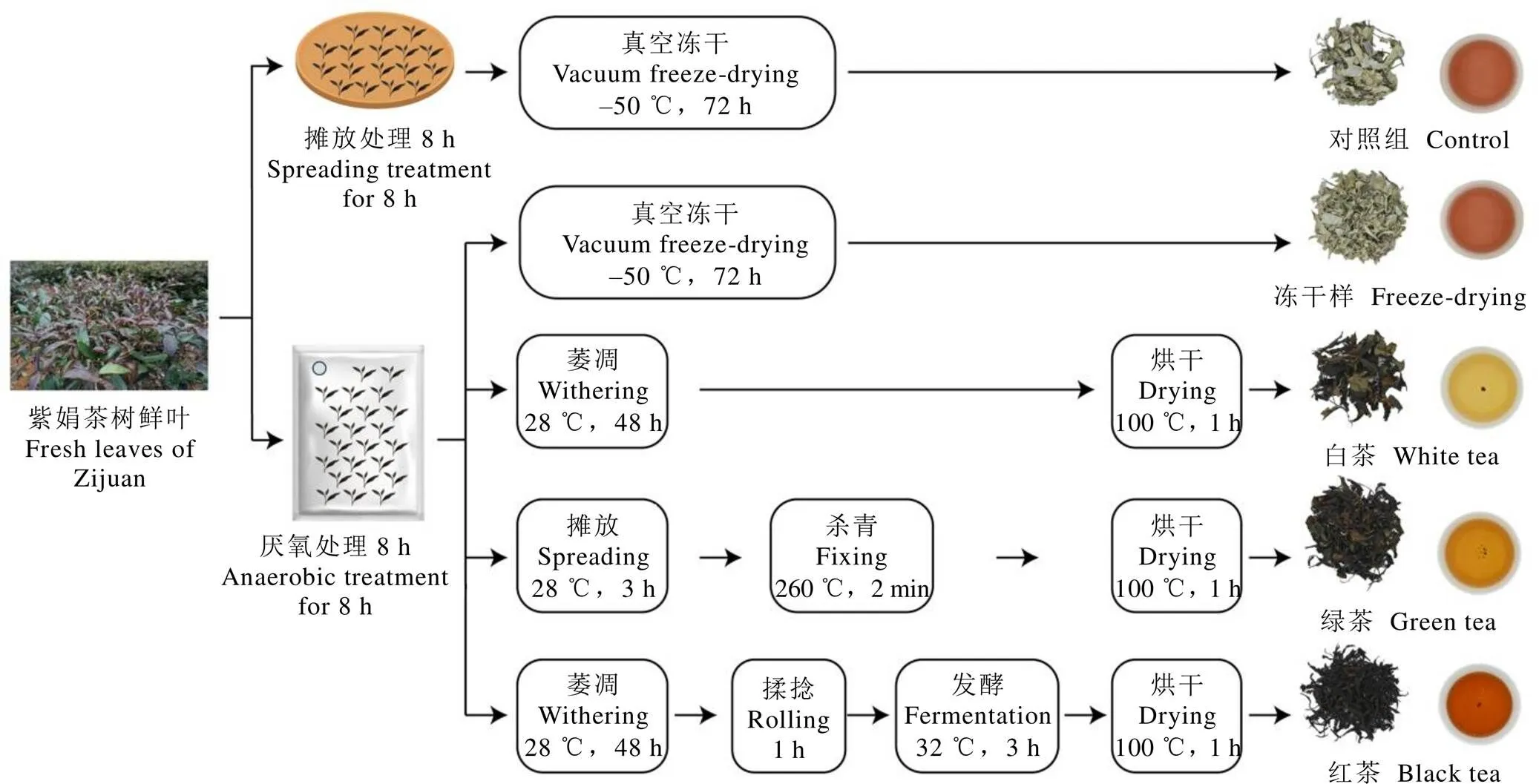
图1 不同工艺紫娟茶叶加工流程图
1.2 仪器与设备
杀青机、揉捻机、烘焙提香机购于福建省安溪佳友机械有限公司,智能人工气候室购于宁波普朗特仪器有限公司,电子天平(AB107-S型)购于瑞士Mettler Toledo公司,真空冷冻干燥机(FD5-10B型)购于美国GOLD-SIM公司,研磨机购于德国IKA公司,电热恒温水浴锅(DK-S11型)购于上海森信实验仪器有限公司,离心机(Centrifuge 5810 R型)购于德国Eppendorf公司,分光光度计(UV-3600型)、高效液相色谱系统(LC-20A型)配备WondaSil C18柱(250 mm×4.6 mm,5 μm)购于日本岛津公司,超高效液相色谱系统(Acquity H-Class)配备Acquity UPLC BEH C18柱(100 mm×2.1 mm,1.7 μm)购于英国Waters公司,氨基酸分析仪(S-433D型)配备Sykam阳离子LCAK07/Li柱(4.6 mm×150 mm)购于德国Sykam公司。
1.3 方法
1.3.1 茶多酚和茶黄素分析检测方法
茶样中茶多酚含量的测定参考GB/T 8313—2018《茶叶中茶多酚和儿茶素类含量的检测方法》进行;4种茶黄素类成分的含量测定参考GB/T 30483—2013《茶叶中茶黄素的测定-高效液相色谱法》进行。
1.3.2 氨基酸分析检测方法
茶样中氨基酸含量的测定参考Yang等[16]的方法并稍作修改,采用氨基酸分析仪进行定性定量。称取100 mg的茶粉,加入10 mL的沸水并在100 ℃下提取15 min,每间隔5 min摇匀1次。冷却后,将混合溶液在离心机中以8 000 r·min-1离心10 min。将上清液用0.45 μm的膜过滤,并储存在4 ℃下进行氨基酸分析。氨基酸在Na+型磺酸基强酸性阳离子交换树脂上分离。流动相由pH为2.9、4.2、8.0的柠檬酸锂盐缓冲液组成,流速为0.45 mL·min-1。茚三酮流速为0.25 mL·min-1,反应器温度130 ℃,进样量为10 μL,柱温设定为40 ℃,检测波长设定为570 nm和440 nm。采用外标法对茶样中的氨基酸成分进行定量。
1.3.3 儿茶素、咖啡碱、GA含量分析检测方法
茶样中儿茶素、咖啡碱、GA含量的测定参考Yang等[16]的方法并稍作修改,采用UPLC配备Acquity UPLC BEH C18柱进行定性定量。称取0.2 g茶粉,加入10 mL预热的70%甲醇水溶液(∶),70 ℃水浴30 min,每间隔5 min混匀1次。待冷却后4 000 r·min-1离心5 min,用纯净水稀释10倍后,过0.22 μm尼龙膜装入进样瓶待测。柱温35 ℃,进样量5 μL,检测波长280 nm,流速0.35 mL·min-1。溶剂A为含0.1%(∶)甲酸的水溶液,溶剂B为纯甲醇。线性梯度洗脱曲线如下:0 min,3% B相;3.0 min,8% B相;7.5 min,20% B相;11.0 min,20% B相;13.0 min,60% B相;14.5 min,60% B相;15.0 min,3% B相;19.0 min,3% B相。儿茶素和咖啡碱的含量采用外标法测定。
1.3.4 花青素分析检测方法
待测茶样提取同1.3.1章节。茶样中花青素总量通过pH示差法测定[17]。pH=1.0的缓冲液为0.2 mol·L-1盐酸-氯化钾缓冲液,pH=4.5的缓冲液为0.4 mol·L-1乙酸钠。样品的稀释通过限制待测样品在520 nm处的吸光度在0.2~0.8来确定。所有样品分别用pH=1.0和pH=4.5缓冲液稀释4倍。静置50 min后用分光光度计分别在520 nm和700 nm处测量吸光度。总花青素含量(TAC;每克提取物中矢车菊素-3--葡萄糖苷当量的毫克数)按以下公式计算:
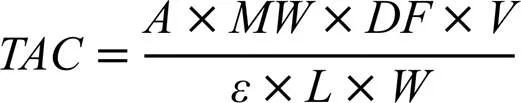
式中,为吸光度值,为稀释系数,为最终体积(mL),为茶叶样品的质量(g),为矢车菊素-3--葡萄糖苷的分子量(449.2 g·mol-1)。为光程(cm),为矢车菊素-3--葡萄糖苷在520 nm处的摩尔消光系数(2.69×104L·mol-1·cm-1)。比吸光度定义为:
=(1–2)–(3–4)
式中,1为样品采用pH=1.0的缓冲液稀释后在520 nm处测定的吸光度,2为样品采用pH=1.0的缓冲液稀释后在700 nm处测定的吸光度,3为样品采用pH=4.5的缓冲液稀释后在520 nm处测定的吸光度,4为样品采用pH=4.5的缓冲液稀释后在700 nm处测定的吸光度。
1.3.5 ACE抑制活性分析方法
采用HPLC方法检测不同加工工艺茶样的ACE抑制活性强度,参考文献[14-15]方法并稍加修改。称取100 mg的茶粉加入10 mL的100 ℃沸水提取,沸水浴提取15 min,每间隔5 min涡旋1次。冷却后,样品在冷冻离心机中以8 000 r·min-1离心10 min。将上清液通过0.45 μm的膜过滤并储存在4 ℃待测。
以HHL作为ACE的反应底物。将0.25 units的ACE固体溶于2.5 mL的0.2 mol·L-1硼酸-硼砂缓冲溶液(0.2 mol·L-1NaCl,pH 8.3)配制成ACE溶液,称取29.1 mg的HHL固体溶于15 mL的0.2 mol·L-1硼酸-硼砂缓冲溶液(0.2 mol·L-1NaCl,pH 8.3)配制成HHL溶液(5 mmol·L-1)。将20 μL的ACE溶液与50 μL不同质量浓度(0.5、1、2、4、8 mg·mL-1)的茶叶样品分别混合,在37 ℃水浴锅中孵育10 min,随后加入100 μL的HHL(5 mmol·L-1),漩涡摇匀后立即在37 ℃下酶促反应60 min,最后加入300 μL的1.0 mol·L-1盐酸终止反应。体系溶液采用0.45 μm水系滤膜过滤后进行HPLC检测分析马尿酸的含量。检测波长为228 nm,柱温为35 ℃,进样量为10 μL,流速为1 mL·min-1,流动相A为超纯水(含0.1%三氟乙酸),B相为纯乙腈,洗脱条件为75%的A相和25%的B相等度洗脱。为了避免样品颜色可能产生的影响,以加入样品但不加ACE溶液作为样品空白组(表1)。
ACE抑制活性根据以下公式计算:
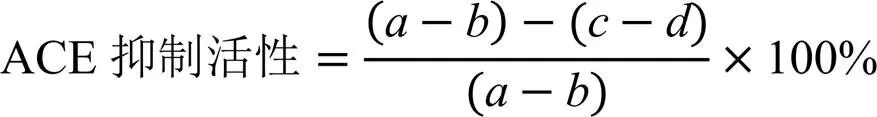
式中,为对照组马尿酸的峰面积,为空白组马尿酸的峰面积;为样品组马尿酸的峰面积;为样品空白组马尿酸的峰面积。
1.3.6 分子对接分析方法
为了在分子水平上模拟化合物和ACE之间的相互作用,使用AutodockVina 1.2.3(Scripps Research Institute,La Jolla,CA,USA)进行分子对接模拟[18]。从蛋白质数据库(http://www.rcsb.org)获得人类ACE-利辛普利复合物(蛋白质ID:1O86)的三维晶体结构,作为对接过程中的受体。茶黄素和儿茶素等对接配体的三维结构从美国国家医学图书馆(https://pubchem.ncbi.nlm.nih.gov)获得,使用ChemBio3DUltra 14.0软件(Cambridge Soft,Cambridge,MA,USA)进行能量最小化。在对接之前,除去1O86中的所有杂分子和水,但保留锌原子和甘氨酸,并添加极性氢。以锌原子坐标为中心(x:43.821,y:38.240,z:46.712),对接网格大小为22.5 Å × 22.5 Å × 22.5 Å,网格间距为0.375 Å。配体和ACE模型之间的分子对接采用AutodockVina 1.2.3软件进行。使用拉马克遗传算法,运行64次。
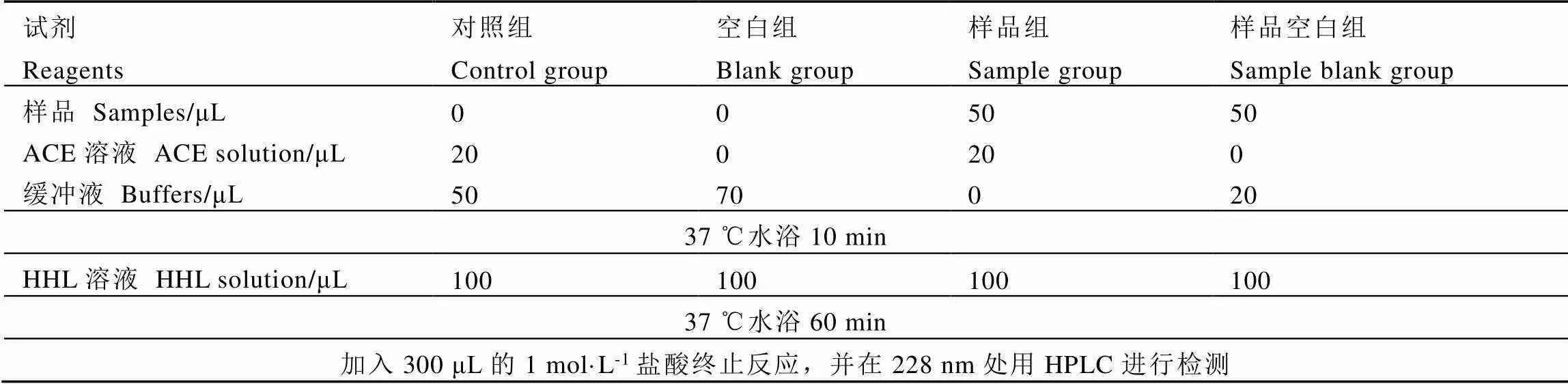
表1 体外ACE抑制率测定方法
通过比较化合物的对接姿势中的结合能值,根据活性口袋中的最低结合能确定最佳构象,所有的对接都重复3次。配体和ACE模型之间的结合力类型通过在线网站(https://plip-tool.biotec.tu-dresden.de/plip-web/plip/index)分析。采用PyMOL 2.5.4软件(DeLano Scientific LLC,CA,USA)分析蛋白质-配体之间的相互作用并可视化作图。
1.4 数据处理
采用GraphPad Prism 9软件(GraphPad Software,San Diego,USA)进行单因素方差分析(ANOVA)并计算IC50值,IC50值被定义为抑制一半ACE活性所需的抑制剂的浓度,通过ACE抑制率和抑制剂浓度的非线性曲线拟合计算。使用TBtools软件进行热图分析。
2 结果与分析
2.1 厌氧处理后茶叶中氨基酸组成及含量分析
紫娟茶树鲜叶经厌氧处理后采用不同加工工艺制备的茶叶样品中氨基酸组成及含量如图2所示。经厌氧处理后的冻干样中GABA含量显著增加至1.72 mg·g-1(<0.05),而未厌氧的常规冻干茶样中仅为0.04 mg·g-1。不同加工工艺制备的绿茶、白茶和红茶样品中,绿茶样的GABA含量最高(1.68 mg·g-1),其次为白茶样(1.58 mg·g-1),红茶样最低(1.23 mg·g-1)。据报道,采用中茶108茶树品种鲜叶经厌氧处理制备的绿茶和白茶的GABA含量分别为2.21、1.08 mg·g-1,而制备的红茶的GABA含量最低,仅为0.86 mg·g-1[18],这与本研究结果基本一致,表明茶鲜叶厌氧处理后采用绿茶加工工艺,有望获得富含GABA的特殊功能型茶产品。此外,茶叶中其他一些氨基酸组分也发生了显著变化,例如谷氨酸含量在常规冻干样(对照)中含量最高(0.83 mg·g-1),而在厌氧冻干样中显著下降至0.06 mg·g-1(<0.05),与厌氧冻干样相比,厌氧处理后制备的绿茶、红茶和白茶样中含量均显著增加,尤其是白茶样中,其含量增加至0.52 mg·g-1(<0.05)。结果表明在厌氧处理结束后,谷氨酸等作为GABA合成前体的氨基酸能够通过其他途径进行补充,在天冬氨酸和谷氨酰胺也观察到相似的变化规律。不同茶样中氨基酸总量也存在显著差异,常规冻干茶样的显著高于厌氧冻干茶样(<0.05),鲜叶经厌氧处理后加工成成品茶,白茶中的最高(18.47 mg·g-1),而红茶中的最低(11.46 mg·g-1),其原因是萎凋过程中蛋白质水解形成大量游离氨基酸[19],而红茶在发酵过程中氨基酸成分转化为挥发性成分导致含量显著降低[20]。
2.2 厌氧处理后茶叶中多酚类及咖啡碱含量分析
不同加工工艺对紫娟茶样中多酚类和咖啡碱含量的影响如表2所示。采用冻干处理能最大限度保留紫娟茶样中类黄酮成分,而加工成绿茶、红茶和白茶产品后,类黄酮成分含量呈现出不同程度下降。茶鲜叶经8 h厌氧处理后,冻干样的EC、ECG及GCG含量均显著高于常规冻干茶样(<0.05)。通常,采用绿茶和白茶加工工艺能较好地保留茶鲜叶中茶多酚成分,而红茶因发酵促进了茶多酚氧化形成聚合物如茶黄素类(主要包括TF、TF3G、TF3'G、TFDG 4种)和茶红素类等,从而导致其含量显著下降[19]。然而,相较于厌氧处理冻干茶样,绿茶样和白茶样的绝大部分儿茶素组分以及茶多酚含量均显著下降。在厌氧处理后,绿茶摊放和白茶萎凋过程观察到部分叶片黄变或红梗,结合绿茶样和白茶样中的茶黄素总量较高(分别为7.01 mg·g-1和6.67 mg·g-1),均显著高于冻干样中的茶黄素总量,推断可能是由于茶鲜叶直接放入真空袋进行抽真空处理导致部分叶片出现机械损伤,因此在摊放和萎凋过程中叶片中部分茶多酚成分发生了酶促氧化生成茶黄素和茶红素等茶色素类成分。其中,相较于厌氧冻干样,绿茶和白茶的儿茶素总量分别下降了91.46 mg·g-1和98.14 mg·g-1,然而,茶黄素总量仅分别增加了4.83 mg·g-1和4.49 mg·g-1。值得注意的是,EGCG3''Me是紫娟茶样的特殊功能成分,在厌氧冻干样中含量为13.05 mg·g-1,在红茶样中仅为0.29 mg·g-1,这与以往的研究结果相似[21]。此外,3种成品茶中GA含量均显著高于冻干茶样,可能是由于在加工过程中,部分酯型儿茶素会水解成非酯型儿茶素并释放GA,导致GA含量显著增加[20]。此外,冻干处理能较好地保留紫娟茶树鲜叶中花青素成分,厌氧冻干样中其总量为0.95 mg·g-1,略高于常规冻干样(0.91 mg·g-1),两者差异不显著,而与冻干茶样相比,成品茶中花青素总量均显著降低(<0.05),尤其是红茶样中最低,为0.10 mg·g-1。据报道[22-23],与紫娟茶树鲜叶相比,加工成绿茶和红茶后花青素含量分别下降了60.78%和92.90%,这与本研究结果相似,可能是由于加工过程中的高温和发酵条件导致花青素成分降解。由此可见,为了更好地保持厌氧处理后茶样中类黄酮成分,尤其是EGCG3''Me和花青素等特殊成分,应采用真空冷冻干燥进行加工。此外,常规冻干和厌氧冻干茶样中咖啡碱含量分别为37.67 mg·g-1和37.55 mg·g-1,两者之间无显著差异,表明厌氧处理对茶样中咖啡碱含量无显著影响。相较于冻干茶样,白茶样中咖啡碱含量显著增加至38.97 mg·g-1,而红茶样中则显著下降至35.33 mg·g-1(<0.05),均存在显著性差异。
现有的小区治理结构中存在着业主自治、居民自治和政府管理三种形式,但这些治理形式的边界如何确定,不同物业类型的小区治理结构又有着何种差异,是困扰当前小区内部治理的关键性难题。
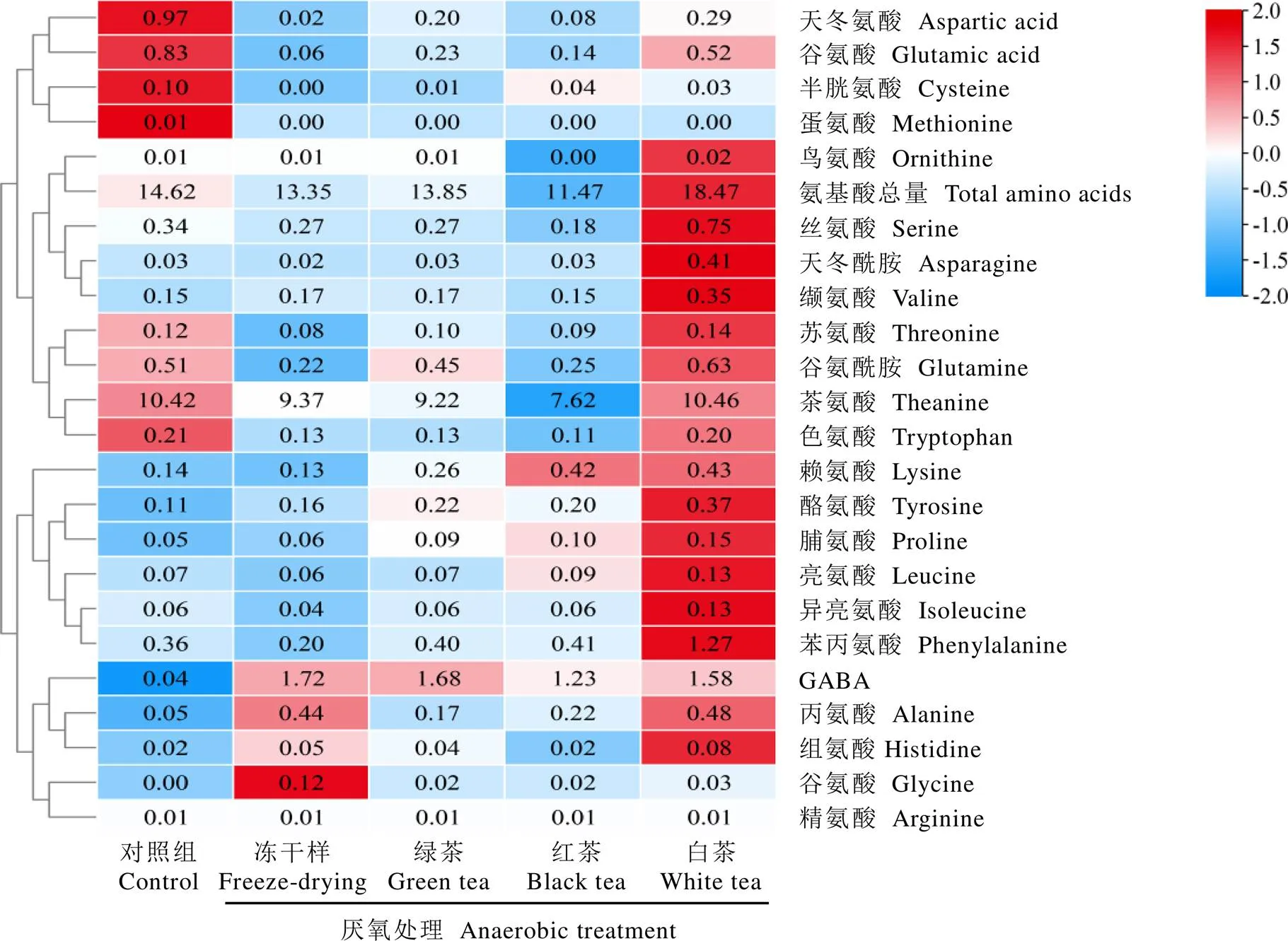
注:热图中的数值为茶样中相应氨基酸的平均含量,单位为mg·g-1。对每行数值进行归一化处理,热图的图例通过颜色和数值的对应关系,将不同数值范围映射到不同的颜色
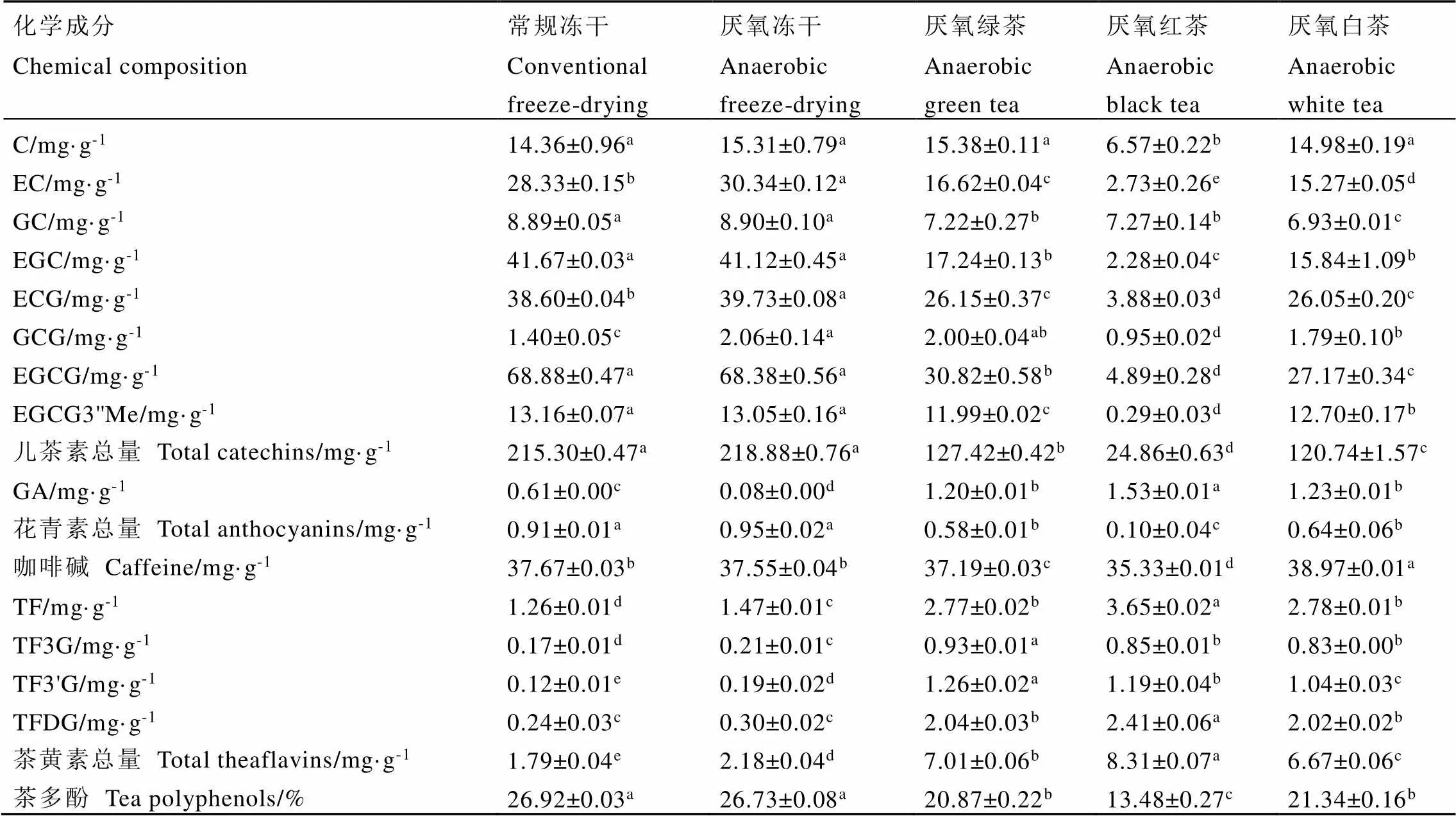
表2 不同加工工艺紫娟茶样中多酚类和咖啡碱含量
注:数据以平均值±标准差(SD)表示。同一行中的不同字母表示通过Tukey检验,各茶类之间的差异显著(˂0.05)
Note: The data are expressed as the mean ± standard deviation (SD). The different letters in the same row indicate that the difference between the teas is significant through Tukey test (˂0.05)
2.3 不同类型茶叶对ACE的抑制活性分析
如图3A所示,通过HPLC系统对HA和HHL混合标准品进行检测,两者能很好地分离。HA进样质量浓度为0.012 5~0.400 0 mg·mL-1,HA峰面积(mAU·min)与浓度(mg·mL-1)的线性关系良好,回归方程为=39 561 808+197 970,2=0.997 8(图3B)。表明在该浓度范围内,HA浓度与峰面积具有较好的线性关系,故样品中的HA峰面积能反映样品中HA的含量,进而反映ACE抑制活性。
IC50值被定义为抑制一半ACE活性所需抑制剂的浓度,数值越小表明抑制剂对ACE抑制活性越强。如图4所示,常规冻干和厌氧冻干茶叶样品的IC50值分别为3.247 mg·mL-1和2.608 mg·mL-1。厌氧冻干茶叶样品的IC50值显著低于常规冻干茶叶样品的IC50值(<0.05),说明厌氧处理可以提高紫娟茶树鲜叶样品的ACE抑制活性。结合非挥发性化学成分的分析,推断样品的ACE抑制活性增强可能与厌氧处理后样品中的GCG、ECG、EC和GABA等成分增加有关。此外,将该批次厌氧处理后的紫娟茶树鲜叶按照绿茶、红茶和白茶加工工艺制备成茶产品后,相较于厌氧冻干样,其ACE抑制活性的IC50值(分别为3.603 mg·mL-1、5.420 mg·mL-1及3.457 mg·mL-1)均显著增加(<0.05)。其中绿茶样和白茶样之间没有显著差异,但两者均显著低于红茶样。由此可知,茶鲜叶经厌氧处理后采用绿茶和白茶的加工工艺能够更好地保持其对ACE的抑制活性。最近的研究表明,厌氧处理可以增加桑树叶片中的GABA含量,并能提高桑叶提取物的体外ACE抑制活性[24],这支持了GABA可能具有作为ACE抑制剂的潜力。结合不同茶样中氨基酸含量的分析结果(图2),绿茶样和白茶样中的GABA含量均高于红茶样,因此,GABA可能是厌氧处理后茶样中的重要抑制剂成分。常规冻干和厌氧白茶对ACE抑制活性无显著差异,而常规冻干样中GABA含量显著低于厌氧白茶,表明茶样中除了GABA还存在其他对ACE具有强抑制活性的成分。Dong等[6]发现,绿茶中的茶多酚能直接钝化体外ACE的活性,显示出较强的体外ACE抑制活性。杨高中等[18]研究报道,中茶108茶树品种的鲜叶经厌氧处理后加工而成的不同类型茶叶样品对ACE的抑制活性不同,其中,绿茶对ACE的抑制率较高,白茶次之,红茶的抑制活性最弱,这与本研究结果基本一致。在本研究中,不同加工工艺制成的茶样中的茶多酚含量差异显著,其中,冻干样中茶多酚含量显著高于绿茶样和白茶样,红茶样中茶多酚含量最低,这与各个茶样的ACE抑制活性强弱相对应,表明茶样中的茶多酚可能是重要的ACE抑制剂。

图3 HHL和HA的色谱分离图(A)以及HA的标准曲线图(B)
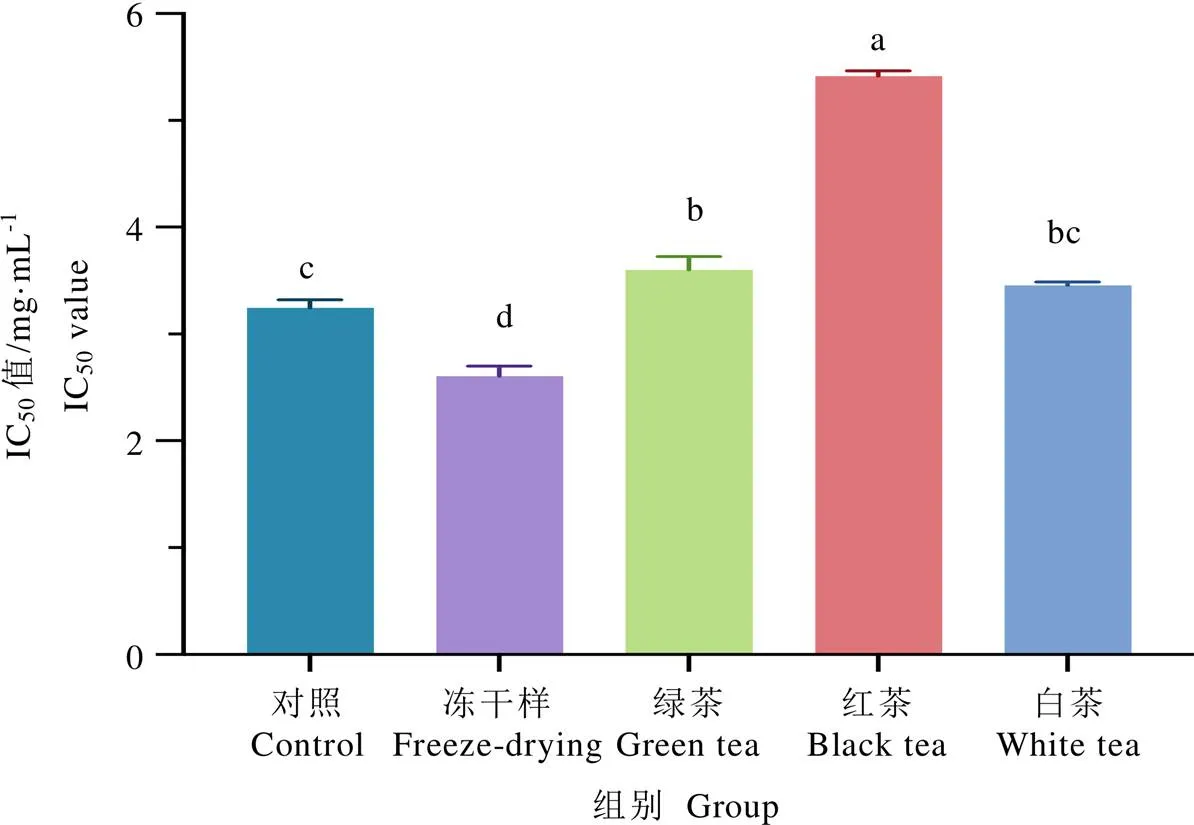
图4 不同茶叶样品的体外ACE抑制活性
茶叶中主要化学成分与其体外ACE抑制活性的IC50值的皮尔逊相关性分析见表3。相关性系数为正值时,表明该化合物含量越高,样品体外ACE抑制活性的IC50值越大(即体外ACE抑制活性越弱);而相关性系数为负值时,表明该化合物含量越高,样品体外ACE抑制活性的IC50值越小(即体外ACE抑制活性越强),可以推断该化学成分可能是茶样中主要的抑制剂成分。由表3可知,不同茶样的体外ACE抑制活性的IC50值与茶样中的花青素总量以及ECG的相关性系数均为–0.97,达到极显著负相关水平(<0.01);与茶样中的EGCG3"Me、茶多酚、GCG、儿茶素总量、EGCG等化学成分的相关系数在–0.95~–0.92,达到显著负相关水平(<0.05)。因此,推断这些成分可能是茶样中发挥体外ACE抑制活性的主要化学成分。值得注意的是,GABA与茶样的体外ACE抑制活性的IC50值的相关系数为–0.04,表明GABA对茶样的体外ACE抑制活性贡献不大。此外,茶黄素类成分和GA成分与茶样的体外ACE抑制活性的IC50值均呈正相关,相关系数在0.61~0.84,但均未达到显著水平(>0.05)。
注:采用皮尔逊相关性进行分析,相关性值用符号*表示,其中*表示<0.05,**表示<0.01
Note: The Pearson correlation was used for the analysis, and the correlationvalues are indicated by the symbol *, * indicates<0.05 and ** indicates<0.01
2.4 分子对接分析
茶叶中的主要化学成分与ACE模型分子对接的结合亲和力结果如表4所示。结合亲和力是指在结合过程中释放的能量,其绝对值越大,结合越容易发生。因此,可以根据结合亲和力的大小预测化合物对ACE的抑制活性强度[25]。分子对接结果显示,茶黄素类化合物与ACE分子对接的结合亲和力绝对值最大(10.49~11.37 kcal·mol-1),显著高于其他成分(<0.05),表明茶黄素类可能是红茶中发挥ACE抑制活性的重要成分。此外,飞燕草素-3--半乳糖苷和矢车菊素-3--半乳糖苷是紫娟茶树鲜叶中含量最丰富的两种花青素组分[5],它们与ACE分子对接的结合亲和力绝对值分别为9.46、8.91 kcal·mol-1。EGCG3"Me也是紫娟茶树鲜叶中的特殊功能成分,其与ACE的结合亲和力绝对值为9.43 kcal·mol-1,高于未甲基化的EGCG(9.34 kcal·mol-1)和非酯型儿茶素EC(8.29 kcal·mol-1)。相比之下,GABA与ACE的结合亲和力绝对值为3.91 kcal·mol-1,显著小于其他化学成分(<0.05),表明GABA对体外ACE抑制活性可能较弱。然而,分子对接结果仅从理论层面揭示这些成分对ACE抑制活性的强弱,后续还要开展ACE抑制活性试验进行验证。
分子对接模拟表明,茶黄素类成分对ACE抑制活性可能强于花青素和儿茶素类成分。然而,2.3章节的相关性分析结果则表明茶黄素类与茶样的体外ACE抑制活性的IC50值均呈相关(即表明茶黄素类并不是茶样中抑制体外ACE活性的主要成分),两者结果不一致。相较于厌氧冻干茶样,尽管茶黄素类成分的含量在3种成品茶样(绿茶、红茶和白茶)中均显著积累,但增加量相对较低(4.49~6.13 mg·g-1);然而3种成品茶样中儿茶素总量急剧下降,这可能是导致成品茶样的ACE抑制活性低于厌氧冻干茶样的主要原因。因此,尽管茶黄素类成分对ACE抑制活性可能强于花青素和儿茶素类成分,但由于其在茶叶中的含量相对较低,其可能并非是茶叶中主要发挥体外ACE抑制活性的成分。值得注意的是,以往的研究报道GABA在体内具有降低动物和人类高血压的健康功效,GABA一方面可以通过抑制ACE活性和减少血管紧张素Ⅱ的合成来降低血压,另一方面可以作用于中枢神经系统,通过调节突触前GABAB受体抑制去甲肾上腺素释放或通过GABAA受体抑制节后交感心神经,从而引起血管扩张[11,26]。此外,GABA具有更高的口服生物利用度和穿越血脑屏障能力,这可能有助于GABA在体内发挥更有效的降压活性[11]。然而,茶黄素类、儿茶素类(尤其是酯型儿茶素)和花青素类成分的生物利用度相对较低[27],因此,有必要对这些成分在体内的降血压作用机制进一步研究。
TF3G、飞燕草素-3--半乳糖苷、EGCG、EC、GA和GABA等6个代表性化合物与ACE蛋白受体的分子对接的结合袋和相互作用分析如图5所示。通过分子对接可以预测分子中的特定功能区域与目标蛋白质中结合位点之间的互作关系,对筛选天然生物活性抑制剂具有参考价值[28]。ACE的主要活性部位由3个活性口袋(S1、S2和S1')和Zn2+组成。S1口袋包含Ala354、Glu384和Tyr523,S2口袋包含Gln281、His353、Lys511、His513和Tyr520,而S1'口袋只包含Glu162[29-30]。分子对接结果表明,6种化合物都可以进入ACE的疏水口袋,形成稳定的疏水键。Shukor等[31]研究发现,一些官能团,如羟基和羧基,可能作为氢键受体或供体促进配体化合物与ACE之间的相互作用。然而,配体化合物与ACE之间相互作用的强弱也受到化合物空间结构等因素的影响。其中,TF3G主要与ACE的Ala354、Arg522、His353等残基形成12个氢键,键距为2.3 Å~3.2 Å;还与Zn2+螯合形成1个键距为2.7 Å的氢键。飞燕草素-3--半乳糖苷与ACE的Tyr523、Glu384、Glu403和Glu411等残基形成9个氢键,键距为2.8 Å~3.2 Å。此外,EGCG主要与ACE的Glu384、Glu411、Arg522和Tyr523等残基形成8个氢键,键距为2.7 Å~3.1 Å。与EGCG相比,EC由于缺乏没食子酰基,与ACE残基His387、Glu411、Try523等形成6个氢键。酯型儿茶素水解后形成的GA则可以与ACE残基Glu411和Gly404形成6个氢键,而且GA的苯环还与His387的咪唑环形成1个π堆积,键距为3.9 Å。GABA可与Tyr523和Glu411的ACE残基形成3个氢键,且GABA可以深入隧道,直接与Zn2+螯合(键距为2.4 Å)。分子对接结果表明,6种成分主要与ACE的S1和S2口袋相互作用,而TF3G和GABA还能与ACE的Zn2+相互作用。茶黄素类与ACE的结合能力强于花青素类以及儿茶素类成分,可能与其分子结构中包含更多的亲水基团和芳香环结构有关,使其能够与ACE中的多个结构域发生相互作用。GABA与ACE的结合能力弱,可能是由于其分子量相对较小、结构较为简单,导致其与ACE之间的相互作用较弱。
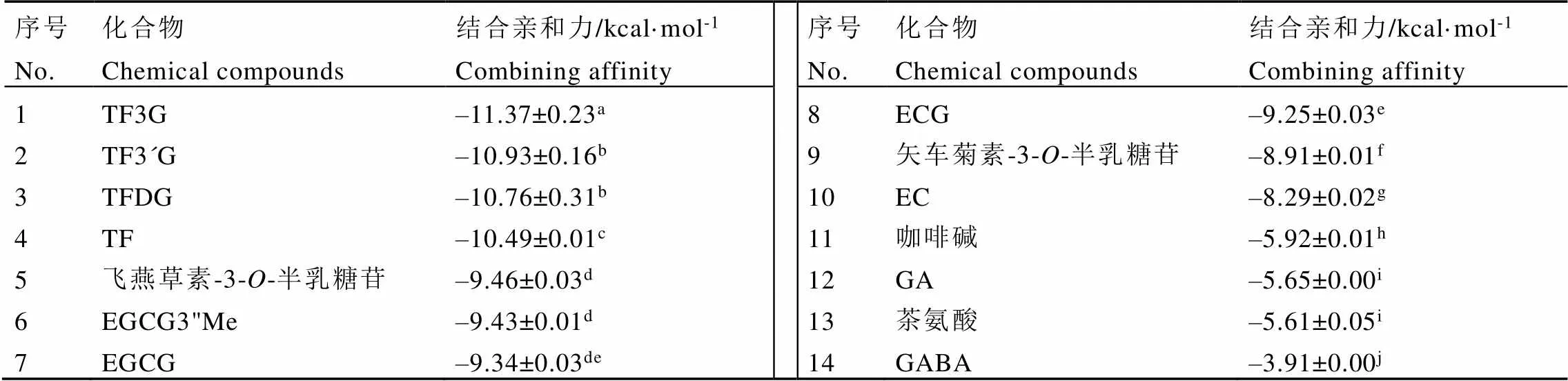
表4 茶叶中主要化学成分与ACE的分子对接的结合亲和力
注:数据以平均值±标准差(SD)表示。同一列中的不同字母表示经Tukey多重比较检验,各化合物之间存在显著差异(˂0.05)
Note: The data are expressed as the mean ± standard deviation (SD). The different letters in the same column indicate a significant difference between the compounds by Tukey's multiple comparisons test (˂0.05)

注:A为茶黄素-3-没食子酸酯,B为飞燕草素-3-O-半乳糖苷,C为表没食子儿茶素没食子酸酯,D为表儿茶素,E为没食子酸,F为γ-氨基丁酸。绿色虚线代表氢键,黑色虚线代表π堆叠
3 结论
本研究表明,厌氧处理能显著提高紫娟茶树鲜叶中GABA含量,而厌氧处理后不同的加工工艺不仅对茶样中的氨基酸组成及含量影响较大,还显著影响茶叶中多酚类化合物的组成和含量;采用冻干工艺能最大程度保留茶样中多酚类化合物含量,其次为绿茶和白茶工艺,红茶工艺保留茶样中多酚类化合物含量最低。此外,厌氧处理能显著提高紫娟茶的体外ACE抑制活性。紫娟茶树鲜叶经厌氧处理后,采用冻干工艺制备的样品体外ACE抑制活性最强,其次是采用绿茶和白茶工艺制备的样品,而采用红茶工艺制备的样品ACE抑制活性最弱。相关性分析表明,茶叶中的茶多酚,尤其是儿茶素类成分可能是主要的体外ACE抑制活性成分,而与厌氧处理后GABA的增加无关。分子对接结果表明,茶黄素类成分与ACE的相互作用强于花青素类和儿茶素类成分,GABA最弱,这可能与其分子结构包含更多的亲水基团和芳香环结构有关。后续有必要开展茶黄素类、儿茶素类和GABA等功能成分的体内试验以明确其降血压作用。研究结果有助于揭示厌氧处理对紫娟茶的体外ACE抑制活性的影响,为开发具有潜在治疗高血压的特殊功能型紫娟茶产品提供理论依据。
[1] Zhou B, Carrillo-larco R M, Danaei G, et al. Worldwide trends in hypertension prevalence and progress in treatment and control from 1990 to 2019: a pooled analysis of 1201 population-representative studies with 104 million participants [J]. The Lancet, 2021, 398(10304): 957-980.
[2] Li X C, Zhang J, Zhuo J L. The vasoprotective axes of the renin-angiotensin system: physiological relevance and therapeutic implications in cardiovascular, hypertensive and kidney diseases [J]. Pharmacological Research, 2017, 125: 21-38.
[3] Wu J, Liao W, Udenigwe C C. Revisiting the mechanisms of ACE inhibitory peptides from food proteins [J]. Trends in Food Science & Technology, 2017, 69: 214-219.
[4] Yang G Z, Meng Q, Shi J, et al. Special tea products featuring functional components: health benefits and processing strategies [J]. Comprehensive Reviews in Food Science and Food Safety, 2023, 22(3): 1686-1721.
[5] Shi J, Simal-gandara J, Mei J, et al. Insight into the pigmented anthocyanins and the major potential co-pigmented flavonoids in purple-coloured leaf teas [J]. Food Chemistry, 2021, 363: 130278. doi: 10.1016/j.foodchem.2021.130278.
[6] Dong J, Xu X, Liang Y, et al. Inhibition of angiotensin converting enzyme (ACE) activity by polyphenols from tea () and links to processing method [J]. Food & Function, 2011, 2(6): 310. doi: 10.1039/c1fo10023h.
[7] Kurita I, Maeda-yamamoto M, Tachibana H, et al. Antihypertensive effect of Benifuuki tea containing-methylated EGCG [J]. Journal of Agricultural and Food Chemistry, 2010, 58(3): 1903-1908.
[8] Fan W D, Zong H R, Zhao T, et al. Bioactivities and mechanisms of dietary proanthocyanidins on blood pressure lowering: a critical review ofand clinical studies [J]. Critical Reviews in Food Science and Nutrition, 2022: 1-17. doi: 10.1080/10408398.2022.2132375.
[9] Ockermann P, Headley L, Lizio R, et al. A review of the properties of anthocyanins and their influence on factors affecting cardiometabolic and cognitive health [J]. Nutrients, 2021, 13(8): 2831. doi: 10.3390/nu13082831.
[10] 包云秀, 夏丽飞, 李友勇, 等. 茶树新品种‘紫娟’[J]. 园艺学报, 2008, 35(6): 934. Bao Y X, Xia L F, Li Y Y, et al. A new tea tree cultivar ‘Zjuan’ [J]. Acta Horticulturae Sinica, 2008, 35(6): 934.
[11] Hinton T, Johnston G A R. GABA-enriched teas as neuro-nutraceuticals [J]. Neurochemistry International, 2020, 141: 104895. doi: 10.1016/j.neuint.2020.104895.
[12] Dai W D, Xie D C, Lin Z, et al. A nontargeted and targeted metabolomics study on the dynamic changes in metabolite levels during the anaerobic treatment of-aminobutyric acid (GABA) tea [J]. LWT, 2020, 126: 109313. doi: 10.1016/j.lwt.2020.109313.
[13] Chen Q, Zhang Y M, Tao M M, et al. Comparative metabolic responses and adaptive strategies of tea leaves () to N2and CO2anaerobic treatment by a nontargeted metabolomics approach [J]. Journal of Agricultural and Food Chemistry, 2018, 66(36): 9565-9572.
[14] Yin Z T, Yan R Y, Jiang Y S, et al. Identification of peptides in Qingke baijiu and evaluation of its angiotensin converting enzyme (ACE) inhibitory activity and stability [J]. Food Chemistry, 2022, 395: 133551. doi: 10.1016/j.foodchem.2022.133551.
[15] Wei D, Fan W L, Xu Y. Identification of water-soluble peptides in distilled spent grain and its angiotensin converting enzyme (ACE) inhibitory activity based on UPLC-Q-TOF-MS and proteomics analysis [J]. Food Chemistry, 2021, 353: 129521. doi: 10.1016/j.foodchem.2021.129521.
[16] Yang C, Hu Z Y, Lu M L, et al. Application of metabolomics profiling in the analysis of metabolites and taste quality in different subtypes of white tea [J]. Food Research International, 2018, 106: 909-919.
[17] Da Silva T B V, Castilho P A, De Sá-nakanishi A B, et al. The inhibitory action of purple tea onstarch digestion compared to otherteas [J]. Food Research International, 2021, 150: 110781. doi: 10.1016/j.foodres.2021.110781.
[18] 杨高中, 彭群华, 张悦, 等. 厌氧处理对不同类型茶叶的氨基酸组成及生物活性的影响[J]. 茶叶科学, 2022, 42(2): 222-232. Yang G Z, Peng Q H, Zhang Y, et al. Effects of anaerobic treatment on amino acid composition and biological activities of different type teas [J]. Journal of Tea Science, 2022, 42(2): 222-232.
[19] Wang Y, Kan Z, Thompson H J, et al. Impact of six typical processing methods on the chemical composition of tea leaves using a singlecultivar, Longjing 43 [J]. Journal of Agricultural and Food Chemistry, 2019, 67(19): 5423-5436.
[20] Yu F, Chen C, Chen S N, et al. Dynamic changes and mechanisms of organic acids during black tea manufacturing process [J]. Food Control, 2022, 132: 108535. doi: 10.1016/j.foodcont.2021.108535.
[21] 吕海鹏, 杨停, 梁名志, 等. “紫娟”茶中的EGCG3"Me成分研究[J]. 现代食品科技, 2014, 30(9): 286-289, 296. Lü H P, Yang T, Liang M Z, et al. Study of EGCG3"Me content in Zijuan tea [J]. Modern Food Science and Technology, 2014, 30(9): 286-289, 296.
[22] 时鸿迪, 王邦政, 李乾, 等. 不同加工工艺下‘紫娟’茶品质的比较[J]. 中国农学通报, 2020, 36(34): 142-147. Shi H D, Wang B Z, Li Q, et al. The quality of ‘Zijuan’ tea under different processing techniques: a comparative analysis [J]. Chinese Agricultural Science Bulletin, 2020, 36(34): 142-147.
[23] Lü H P, Dai W D, Tan J F, et al. Identification of the anthocyanins from the purple leaf coloured tea cultivar Zijuan (var.) and characterization of their antioxidant activities [J]. Journal of Functional Foods, 2015, 17: 449-458.
[24] Tu J, Liu G H, Jin Y C, et al. Enrichment of-aminobutyric acid in mulberry leaves and the inhibitory effects of the water extract on ACE and-glucosidase activity [J]. Industrial Crops and Products, 2022, 177: 114485. doi: 10.1016/j.indcrop.2021.114485.
[25] Wu Y, Han Z S, Wen M C, et al. Screening of-glucosidase inhibitors in large-leaf yellow tea by offline bioassay coupled with liquid chromatography tandem mass spectrometry [J]. Food Science and Human Wellness, 2022, 11(3): 627-634.
[26] Diana M, Quílez J, Rafecas M. Gamma-aminobutyric acid as a bioactive compound in foods: a review [J]. Journal of Functional Foods, 2014, 10: 407-420.
[27] Liu Z, Bruins M E, Ni L, et al. Green and black tea phenolics: bioavailability, transformation by colonic microbiota, and modulation of colonic microbiota [J]. Journal of Agricultural and Food Chemistry, 2018, 66(32): 8469-8477.
[28] Wang X M, Chen H X, Fu X G, et al. A novel antioxidant and ACE inhibitory peptide from rice bran protein: biochemical characterization and molecular docking study [J]. LWT, 2017, 75: 93-99. doi: 10.1016/j.lwt.2016.08.047.
[29] Shih Y H, Chen F A, Wang L F, et al. Discovery and study of novel antihypertensive peptides derived from cassia obtusifoliaseeds [J]. Journal of Agricultural and Food Chemistry, 2019, 67(28): 7810-7820.
[30] Mirzaei M, Mirdamadi S, Ehsani M R, et al. Production of antioxidant and ACE-inhibitory peptides fromprotein hydrolysates: purification and molecular docking [J]. Journal of Food and Drug Analysis, 2018, 26(2): 696-705.
[31] Shukor N A, Van Camp J, Gonzales G B, et al. Angiotensin-converting enzyme inhibitory effects by plant phenolic compounds: a study of structure activity relationships [J]. Journal of Agricultural and Food Chemistry, 2013, 61(48): 11832-11839. doi:10.1021/jf404641v.
Changes in Chemical Composition of ZijuanTea under Anaerobic Treatment Conditions and Their Effects onACEActivity
YANG Gaozhong1,2, SHI Jiang1, ZHANG Yue1, PENG Qunhua1, LIN Zhi1*, LÜ Haipeng1*
1. Tea Research Institute of the Chinese Academy of Agricultural Science/Key Laboratory of Biology, Genetics and Breeding of SpecialEconomic Animals and Plants, Ministry of Agriculture and Rural Affairs, Hangzhou 310008, China; 2. Graduate School of Chinese Academy of Agricultural Sciences, Beijing 100081, China
In this study, fresh leaves of Zijuan tea were treated with anaerobic treatment and used to make freeze-dried, green, black and white tea samples. The main non-volatile components (such as catechins, amino acids, anthocyanins) in these samples were determined and theirangiotensin-converting enzyme (ACE) inhibitory activities were evaluated by high performance liquid chromatography. In addition, molecular docking simulation experiments were conducted to investigate the potential interaction mechanisms between the major chemical components in tea and ACE. The results show that the GABA content in the freeze-dried samples after anaerobic treatment increased to 1.72 mg·g-1, which was significantly higher than that in the tea samples without anaerobic treatment (0.04 mg·g-1,<0.05). The composition and contents of amino acids and polyphenolic compounds in the tea samples were significantly affected by the processing methods after anaerobic treatment. The white tea process could increase the contents of amino acid components in the tea samples, while the freeze-drying process could maximize the retention of polyphenolic compounds in the tea samples. TheACE inhibitory activity of Zijuan tea fresh leaf samples was significantly enhanced after anaerobic treatment (<0.05); the strongest ACE activity inhibition was observed in samples prepared by freeze-drying process after anaerobic treatment, which was significantly higher than that of samples prepared by green, white, and black tea processing methods (<0.05). In addition, molecular docking simulation experiments reveal that the strength of the interaction between the main chemical components in tea and ACE was related to the hydrophilic groups and aromatic ring structures in their molecular structures. The results of the study helped to reveal the effect of anaerobic treatment on the ACE inhibitory activity of Zijuan tea and provided a theoretical basis for the development of special functional Zijuan tea products with potential treatment of hypertension.
tea,-aminobutyric acid, anaerobic treatment, processing technology, angiotensin-converting enzyme
S571.1
A
1000-369X(2023)04-553-14
2023-04-17
2023-05-14
国家茶叶产业技术体系(CARS-19)、中国农业科学院科技创新工程项目(CAAS-ASTIP-2014-TRICAAS)
杨高中,男,硕士研究生,主要从事茶叶品质化学与营养健康方面研究。*通信作者:linz@tricaas.com;lvhaipeng@tricaas.com

