鸠坑龙井茶对高脂饮食C57BL/6小鼠肝脂肪变性SREBPs通路信号的影响及肠道菌群调节作用研究
龚明秀,袁懿炜,张一帆,叶江成,郭丽,李晓军,黄皓,毛宇骁,赵芸,赵进*
鸠坑龙井茶对高脂饮食C57BL/6小鼠肝脂肪变性SREBPs通路信号的影响及肠道菌群调节作用研究
龚明秀1,2,袁懿炜1,2,张一帆1,2,叶江成1,2,郭丽3,李晓军4,黄皓4,毛宇骁5,赵芸5,赵进1,2*
1. 中国计量大学生命科学学院,食品营养与质量安全研究所,浙江 杭州 310018;2. 特色农产品品质与危害物控制技术浙江省重点实验室,浙江 杭州 310018;3. 中国农业科学院茶叶研究所,浙江 杭州 310008;4. 浙江艺福堂茶业有限公司博士创新工作站,浙江 杭州 311500;5. 杭州市农业科学研究院,浙江 杭州 310024
探究鸠坑龙井茶水提物(LJT)对小鼠肝组织脂质代谢SREBPs通路信号影响及肠道菌群的调节作用。通过高脂饮食诱导小鼠构建非酒精性脂肪肝(NAFL)模型,并给予LJT(300 mg·kg-1)灌胃干预。定期记录小鼠的体质量,检测小鼠血清生化指标和葡萄糖耐受水平,观察并分析Hematoxylin-Eosin(HE)染色、油红O染色肝组织切片特征;应用Real-time qPCR技术检测小鼠肝组织SREBPs通路7个基因(-、、-、-、-、、)的相对表达量,采用蛋白免疫印记技术(Western Blot)分析肝组织蛋白质表达水平,同时对小鼠肠道菌群进行高通量测序(16 S rDNA)并分析其结构。结果显示,LJT干预后小鼠体质量、血糖AUC、血清TG、TC、LDL-C和肝脏中TG、TC水平有显著下降,龙井组小鼠肝组织SREBP-1c、FAS、ACC-1、SCD-1和PPAR蛋白表达水平降低,-、-、、-、-、、基因的相对表达量显著下调;16 S rDNA分析发现,小鼠肠道菌群门水平主要为Firmicutes、Bacteroidota、Desulfobacterota和Actinobacteriota4类,LJT有效延缓了高脂饮食引起的Firmicutes相对丰度升高和Bacteroidota相对丰度下降趋势,并增加了肠道菌群的物种丰度。结果表明,LJT能够干预小鼠肝脂肪变性SREBPs通路信号表达,改善小鼠肠道菌群紊乱,具有降脂减肥作用。
鸠坑龙井茶;非酒精性脂肪肝;SREBPs通路;肠道菌群紊乱;降脂作用
非酒精性脂肪肝病(Non-alcoholic fatty liver disease,NAFLD)是指除酒精、药物和单基因遗传等肝损伤原因外,导致的肝细胞内脂质积聚引起的综合征,肝细胞内甘油三酯的积聚(即肝脂肪变性)是NAFLD的标志[1]。其发展过程包括从非酒精性脂肪肝(Non-alcoholic fatty liver,NAFL)到非酒精性脂肪性肝炎(Non-alcoholic steato-hepatitis,NASH),甚至是晚期的肝纤维化和肝硬化[2]。此症状与心血管疾病[3]、肥胖[4]、Ⅱ型糖尿病[5]和肝外恶性肿瘤[6]等代谢疾病密切相关。报道显示,NAFLD成为我国发病率最高的慢性肝病,在部分地区达25%[7]。肠道菌群与NAFLD密切相关,可以通过激活固醇调节元件结合蛋白(Sterol regulatory element binding proteins,SREBPs)来影响宿主脂质代谢[8]。SREBPs是调控胆固醇、甘油三酯和脂肪酸从头合成的关键核转录因子,通过调节SREBPs信号通路抑制肝脏中脂质沉积,缓解NAFLD症状。
《地理标志产品龙井茶》(GB/T 18650—2008)指出,鸠坑种是适宜加工龙井茶的茶树良种,其芽叶肥壮,持嫩性强,内含物质丰富,具有相对丰富的香气成分[9-10]。茶多酚具有良好的降脂作用,且降脂功效的强弱与其浓度呈正相关[11]。Li等[12]研究发现龙井茶能预防酒精引起的肝脏脂质的累积,Ma等[13]研究显示绿茶通过调节SREBPs信号通路抑制肝脏中脂质沉积。本研究通过高脂饮食诱导C57BL/6小鼠构建非酒精性肝脂肪变性模型,研究鸠坑龙井茶水提物对小鼠肝组织脂质代谢SREBPs通路信号的影响及肠道菌群的调节作用,进而解析鸠坑龙井茶改善小鼠NAFLD功效的作用机理,旨在为促进鸠坑龙井茶产品的功效应用提供理论依据。
1 材料与方法
1.1 试验材料
2021年11月19日采摘桐庐茶园的鸠坑种茶树鲜叶,按照龙井茶工艺加工制作龙井茶。
8周龄雄性SPF级C57BL/6小鼠购自杭州子源实验动物科技有限公司,使用许可证号为SYXK(浙)2018-0009。
小鼠普通饲料(蛋白质20.6%、脂肪12%、碳水化合物67.4%)购自江苏省协同医药生物工程有限责任公司,高脂饲料(蛋白质26.2%、脂肪34.9%、碳水化合物26.3%)购自无锡帆泊生物技术有限公司。
1.2 试验方法
1.2.1 指标测定
水分含量参照GB 5009.3—2016直接干燥法,水浸出物含量参照GB/T 8305—2013方法,咖啡碱含量参照GB/T 8312—2013紫外分光光度法,茶多酚及儿茶素含量参照GB/T 8313—2018方法,游离氨基酸含量参照GB/T 8314—2013方法,可溶性糖含量采用苯酚-硫酸法[14],可溶性蛋白含量测定采用微孔酶标法。
1.2.2 动物实验
动物实验经中国计量大学动物伦理委员会批准(批件号:2022年第28号)。40只体质量为(23.00±1.00) g的C57BL/6雄性小鼠,安置在常规环境(12 h光/暗循环)中,自由取食饮水,适应性饲养1周后进行随机分组,分为正常组(Normal)、高脂组(Model)、阳性对照组(简称阳性组,Control)和鸠坑龙井茶水提物干预组(简称龙井组,LJT),小鼠分组方案如表1所示,小鼠每天进行灌胃。鸠坑龙井茶水提物的制备参照Li等[15]的方法并进行完善,用95 ℃热水按料液比1∶20浸提茶制品5 min,趁热抽滤、旋蒸得浓缩滤液,然后–55 ℃冷冻干燥24 h得到茶水提取物冻干粉,用于配置灌胃所需茶汤。每周测定小鼠体质量,在第9周饲养结束后解剖小鼠,观察并记录小鼠、肝脏和附睾脂肪形态,按照下列公式计算Lee’s指数:

式中,为小鼠体质量,g;为小鼠体长,cm。
1.2.3 口服葡萄糖耐受量实验(OGTT)
在小鼠饲喂第5周,禁食不禁水12 h,测定各组小鼠空腹血糖值。小鼠灌胃20%葡萄糖水溶液(2 g·kg-1),在小鼠空腹和灌胃后第15、30、60、120 min,分别用罗氏血糖仪和检测试纸条依次测定相应时间点的小鼠血糖值,计算时间-血糖曲线下面积(AUC)。
1.2.4 小鼠血清采集
在小鼠培养第9周,禁食不禁水过夜(12 h)。禁食结束后,采用眼球取血方式采集小鼠鲜血于抗凝管中静置2 h,然后以3 000 r·min-1冷冻离心(4 ℃)10 min,收集上层血清并及时储存于–80 ℃冰柜。
1.2.5 血清和肝脏常规指标测定
血清和肝脏中高密度脂蛋白胆固醇(High-density lipoprotein,HDL-C)、低密度脂蛋白胆固醇(Low-density lipoprotein,LDL-C)、总胆固醇(Total cholesterol,TC)、总甘油三酯(Total triglyceride,TG)和总蛋白(Total protein,TP)等含量,谷草转氨酶(Aspartate aminotransferase,AST)和谷丙转氨酶(Alanine aminotransferase,ALT)的活性采用南京建成生物工程研究所试剂盒测定。
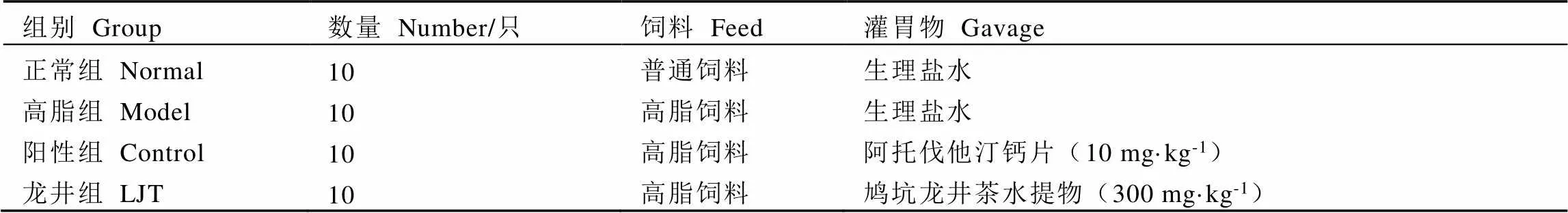
表1 小鼠分组方案
1.2.6 肝脏组织染色
采集小鼠肝组织并置于10%福尔马林组织固定液中48 h,参考冯琳等[16]方法并对其进行油红O染色和HE染色切片制作。
1.2.7 蛋白免疫印记
小鼠肝脏样品液氮保存送至杭州纽贝生物有限公司,采用蛋白质印迹技术(Western blot)分析小鼠肝组织脂质代谢相关蛋白质表达情况。通过SuperSignal®West Dura Extended Duration Substrate进行显影和定影,使用Image J 1.8.0图像处理软件(美国)分析条带的光密度值,每个条带重复3次,目的蛋白相对表达量=[目的蛋白(光密度值)/内参(光密度值)]×10n。
1.2.8 实时荧光定量PCR
1.2.9 肠道菌群检测
采集小鼠结肠部位内容物,提取样品总DNA后,根据保守区设计得到引物,在引物末端加上测序接头,进行PCR扩增并对其产物进行纯化、定量和均一化形成测序文库并进行文库质检,质检合格的文库用Illumina NovaSeq 6000进行测序。测序由北京擎科生物公司完成。
1.3 数据分析
2 结果与分析
2.1 鸠坑龙井茶主要理化成分检测结果
鸠坑龙井茶主要理化成分检测结果如表3所示。鸠坑龙井茶中水浸出物含量为(31.590±0.292)%,茶多酚含量为(19.773±0.284)%,可溶性糖含量为(4.656±0.070)%,可溶性蛋白含量为(4.103±0.026)%,咖啡碱含量为(2.455±0.012)%,水分含量为(5.173±0.132)%。
2.2 鸠坑龙井茶对高脂饮食小鼠脏器、体质量和Lee’s指数的影响
鸠坑龙井茶对小鼠形体的影响如图1所示。由图1A可知,经过9周的高脂饮食诱导性饲养,高脂组、阳性组和龙井组小鼠的体型明显比正常组肥大,其中龙井组小鼠体型比高脂组瘦小;正常组小鼠肝脏呈现为健康的深红褐色,高脂组肝脏颜色偏黄,有明显脂肪聚积现象,阳性组和龙井组小鼠肝组织形态与正常组相近;高脂组小鼠附睾脂肪体积与其他3组有明显差异。

表2 荧光定量PCR引物序列
小鼠饲喂期间体质量和体形变化情况如图1B和图1C所示。高脂组小鼠体质量和Lee’s指数显著高于正常组(<0.05),阳性组和龙井组小鼠体质量显著低于高脂组(<0.05)。研究结果显示,高脂饮食能够诱导小鼠肥胖与小鼠肝组织脂肪堆积,并导致肝脂肪变性,而通过长期饮食鸠坑龙井茶能减缓或者改善小鼠肝脂肪变性症状。
2.3 小鼠血糖耐受水平检测分析
小鼠血糖变化如图2所示。正常组小鼠血糖值在口服葡萄糖溶液15 min后达到最高水平,120 min后下降至接近正常水平,并且正常组小鼠在口服糖期间AUC值显著低于高脂组(<0.01);高脂组、阳性组和龙井组小鼠血糖在口服葡萄糖后30 min达到最高水平,120 min后高脂组血糖水平仍高于正常组,而阳性组、龙井组小鼠血糖值趋近于正常组水平,并显著低于高脂组(<0.05)。

表3 鸠坑龙井茶中主要理化成分含量
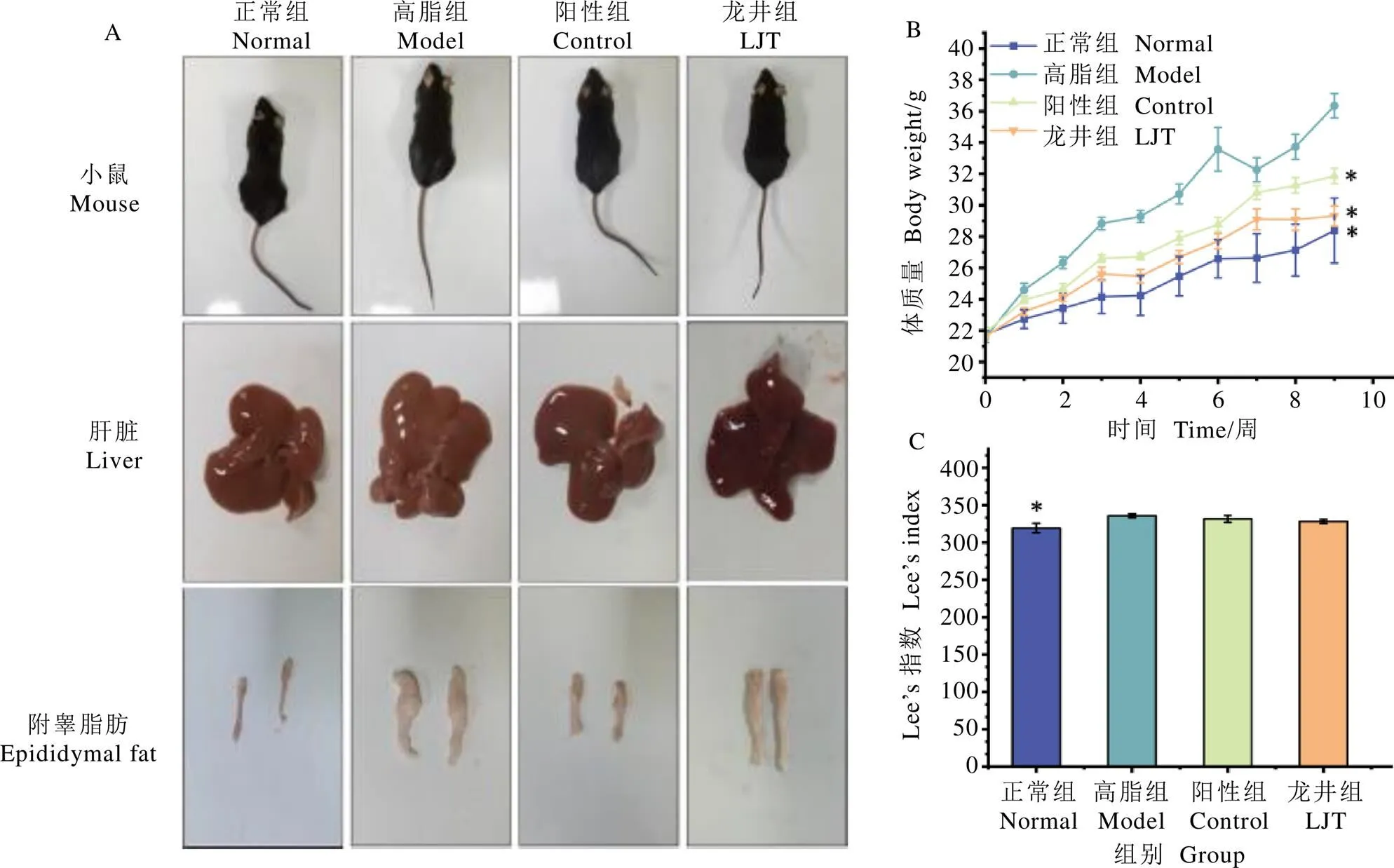
注:A为小鼠体型、肝脏和附睾脂肪,B为0~9周小鼠体质量变化,C为小鼠Lee’s指数。*表示与高脂组相比P<0.05
由图2B可知,与高脂组小鼠相比,正常组、阳性组和龙井组的小鼠血糖AUC均显著下降(<0.05)。检测结果表明,高脂饮食能引起C57BL/6小鼠葡萄糖耐受能力受损,通过长期灌胃龙井茶水提物能有效改善小鼠葡萄糖耐受性。
2.4 小鼠血清生化指标检测分析
小鼠血清生化指标变化趋势如图3。由图3A~D可知,与高脂组相比,正常组阳性组和龙井组小鼠的TC、TG和LDL-C值显著降低(<0.05),各组间的HDL-C无显著差异。小鼠血清中酶活性水平如图3E和3F所示,高脂组小鼠AST酶活性水平显著高于正常组(<0.01),但仍处于正常水平范围内,龙井组小鼠血清AST酶活性水平显著低于高脂组(<0.05);小鼠血清ALT酶活性在各组间不具有统计学差异。结果表明,鸠坑龙井茶能有效降低高脂饮食引起的小鼠血脂含量,推测长期饮用鸠坑龙井茶能够降低血脂累积水平。
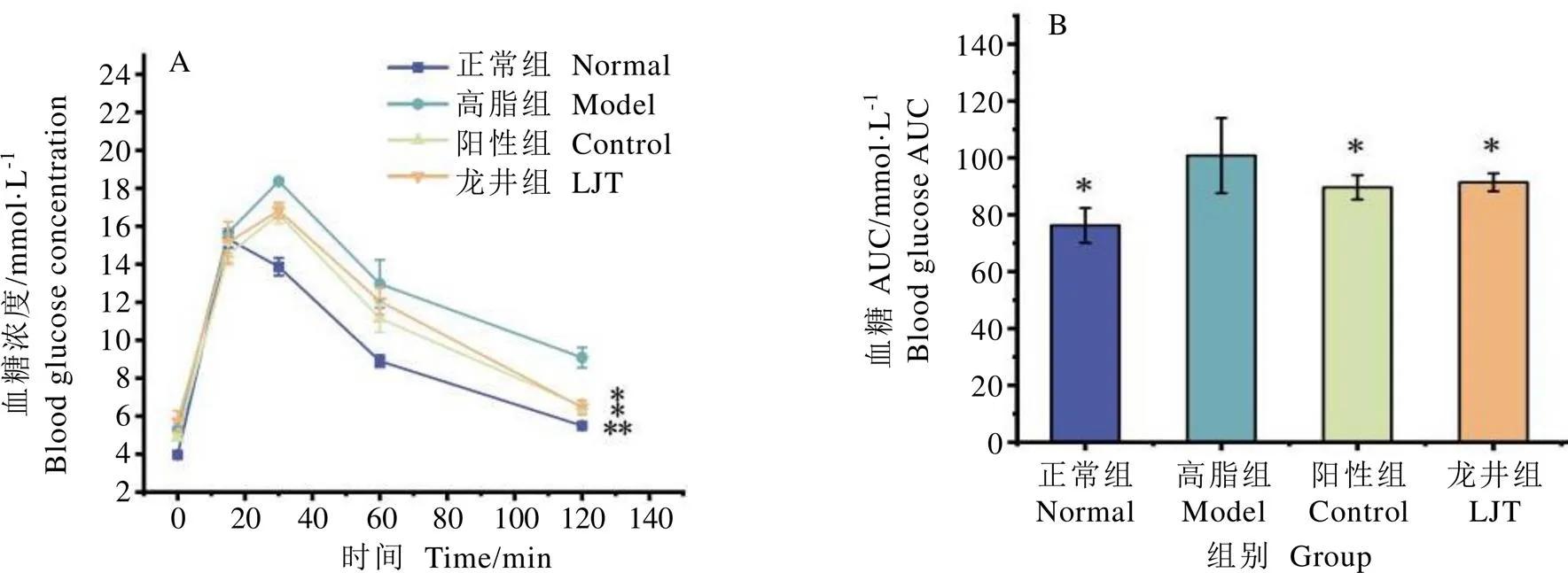
注:A为小鼠OGTT血糖变化曲线,B为小鼠OGTT曲线下面积。*表示与高脂组相比P<0.05,**表示与高脂组相比P<0.01,下同
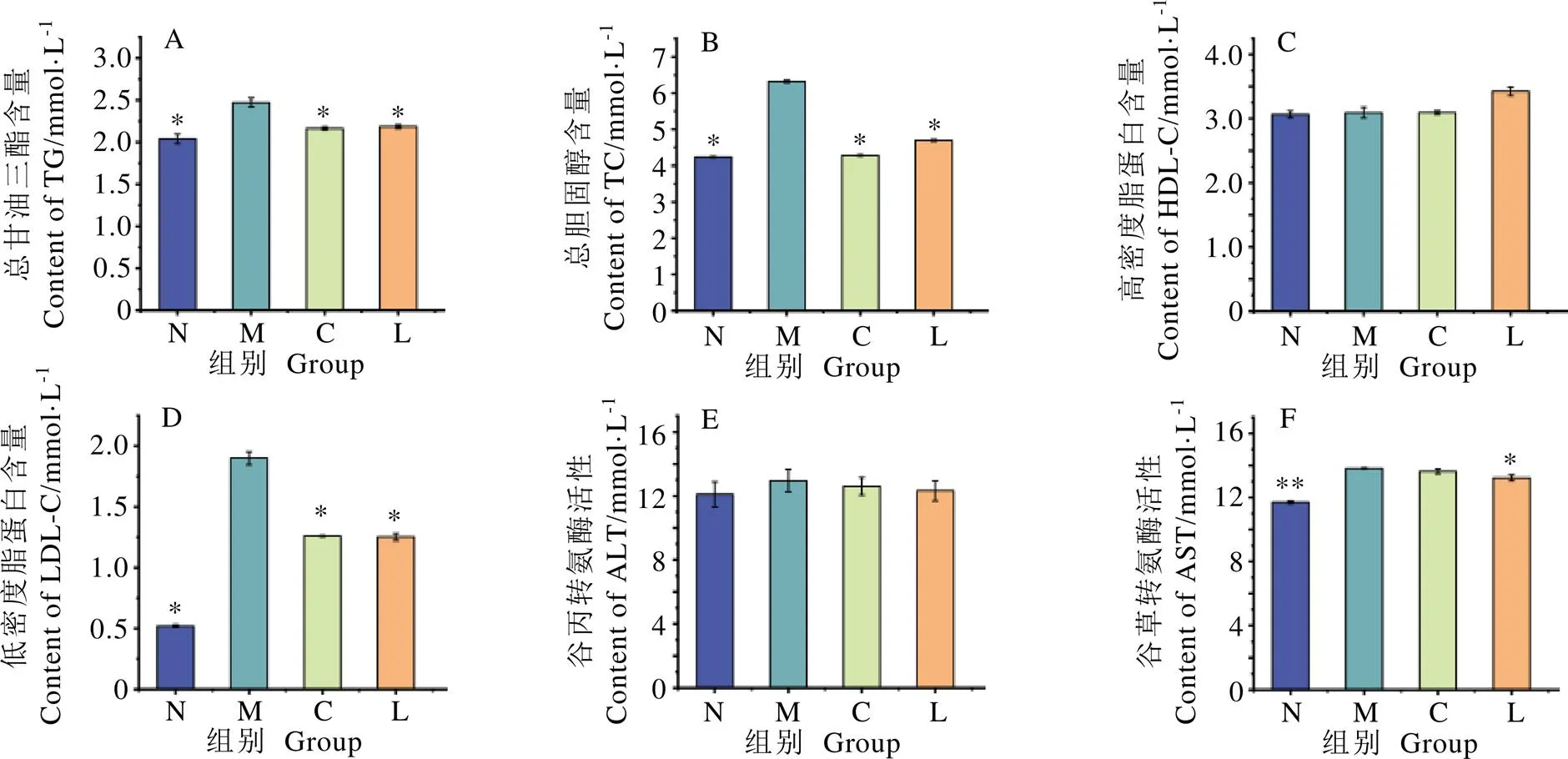
注:N为正常组,M为高脂组,C为阳性组,L为龙井组
2.5 小鼠肝组织脂肪变性检测分析
小鼠肝组织脂质含量如图4。由图4A和4B可以得出,高脂饮食能够显著增加小鼠肝脏TG和TC的含量(<0.05),阳性药物和鸠坑龙井茶具有显著降低小鼠肝脏TG和TC的作用(<0.05)。
HE染色结果显示(图4C),正常组的小鼠肝细胞排列紧密,肝小叶结构清晰,脂肪空泡密度小;高脂组小鼠肝细胞排列较松散,肝小叶结构不清晰,大量的脂肪空泡聚集在细胞核周围,少量炎性细胞浸润现象,但无气球样病变;阳性组和龙井组小鼠肝细胞结构中脂肪空泡减少,炎性细胞浸润现象几乎消失。油红O染色结果显示(4D),正常组小鼠肝组织中甘油三酯的含量较少,高脂组小鼠肝组织甘油三酯遍布大部分或整个细胞质,且含量显著高于正常组(<0.05),阳性组和龙井组小鼠肝组织甘油三酯含量显著低于高脂组(<0.05)。肝组织切片病理观察结果表明,高脂饮食诱发小鼠肝组织脂肪堆积并发生变性,而长期饮食鸠坑龙井茶能有效缓解该症状。
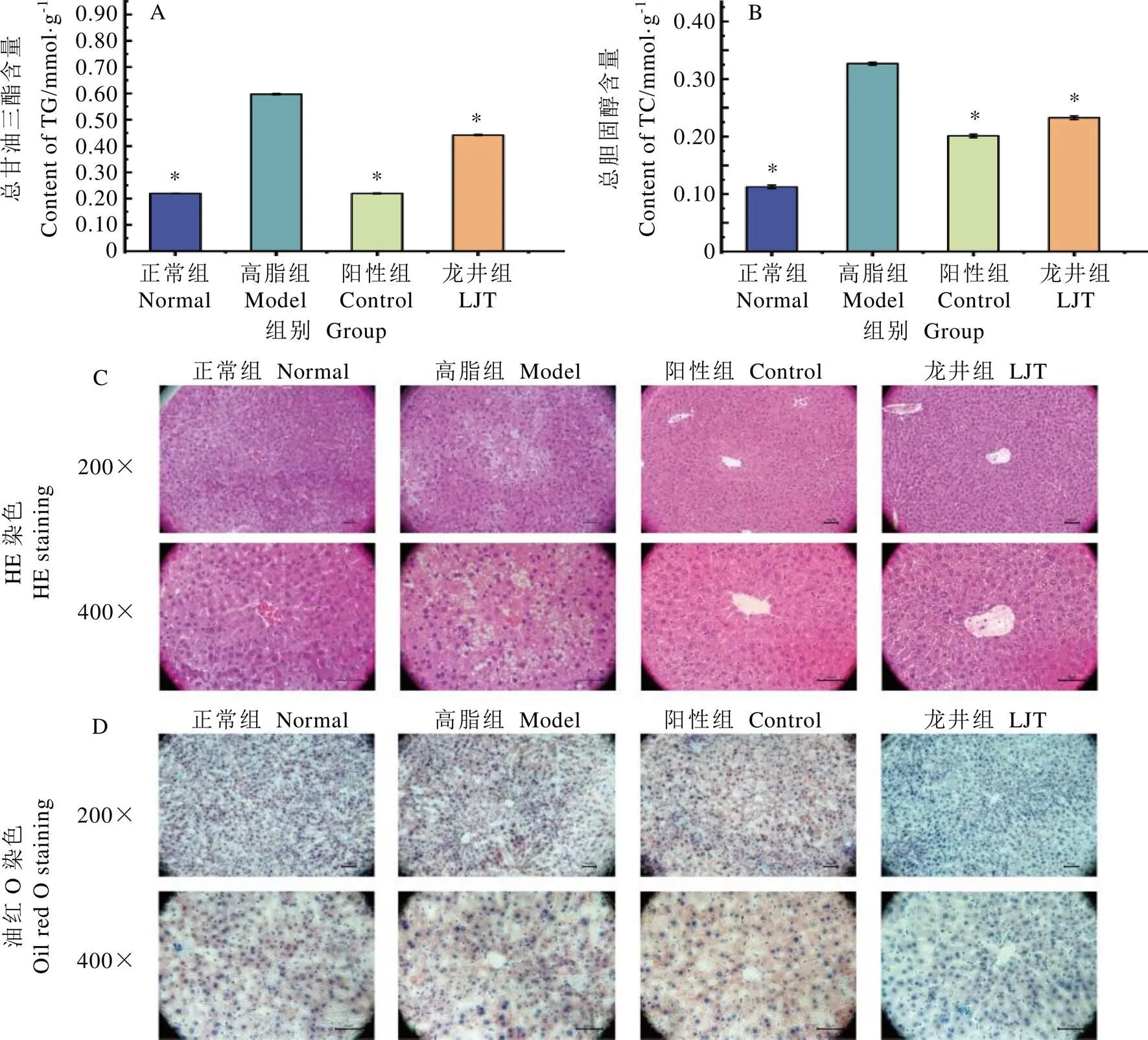
图4 小鼠肝组织脂质含量
2.6 鸠坑龙井茶对肝组织脂质代谢通路信号的影响
小鼠肝脏蛋白免疫印迹结果如图5A所示。分析图5A和图5B可知,与高脂组相比,正常组、阳性组和龙井组PPAR相对表达量显著降低(<0.05);由图5A、图5C~F可知,正常组、阳性组和龙井组中SREBP-1c、SCD-1、FAS蛋白表达量显著低于高脂组(<0.05)。与高脂组相比,阳性组、龙井组p-ACC-1/ACC-1值显著升高,结果表明,阳性药物与鸠坑龙井茶都具有影响高脂饮食小鼠肝组织脂质合成代谢过程的效应。
由图6A可知,正常组、阳性组和龙井组相对表达量显著低于高脂组(<0.05),说明高脂饮食促使小鼠肝组织相对表达量增加,促进脂质合成代谢。由图6B可知,高脂组小鼠肝组织中-、、-和-基因相对表达量显著高于正常组(<0.05);与高脂组相比,经阳性药物和鸠坑龙井茶干预后,小鼠肝组织-、、-和-基因表达水平显著下降(<0.05)。图6C显示,高脂组小鼠肝组织中-和基因表达水平显著高于其他组(<0.05),说明高脂组中胆固醇合成显著增加,鸠坑龙井茶干预能抑制高脂小鼠肝组织胆固醇合成过程。
2.7 小鼠肠道菌群检测分析
各组小鼠肠道菌群分类操作单元(Operational taxonomic units,OTUs)韦恩图如图7所示。检测分析获得正常组小鼠肠道菌群有457种OTUs,高脂组、阳性组和龙井组分别获得327、319、389种OTUs,分别有201、194、229种OTUs与正常组相同,表明龙井组小鼠肠道菌群构成与正常组最为相似。

注:N为正常组,M为高脂组,C为阳性组,L为龙井组
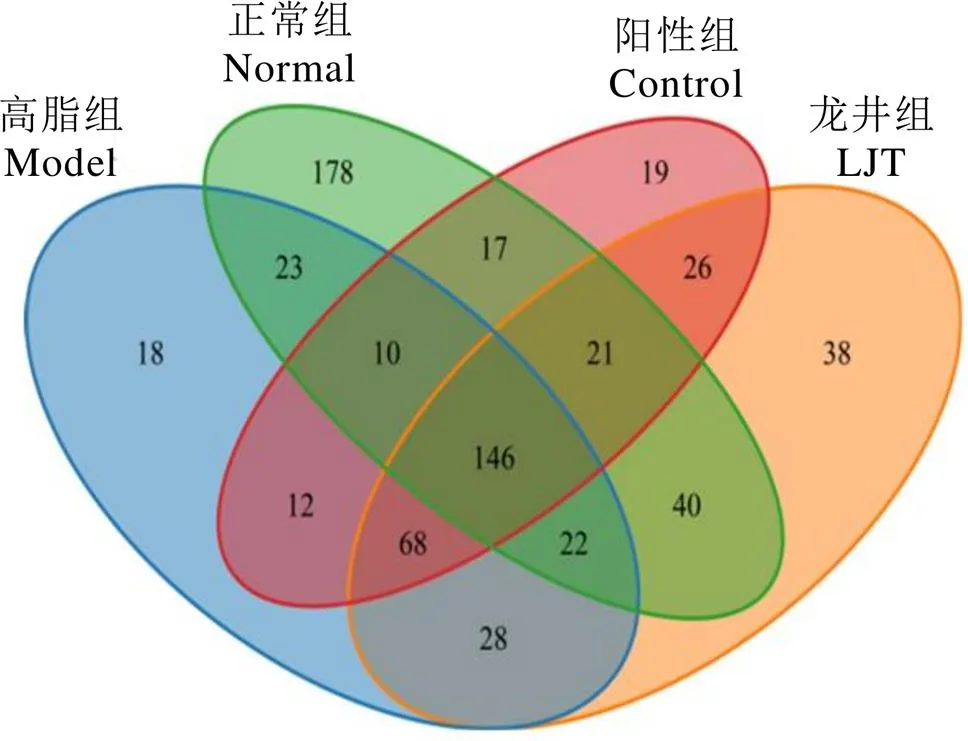
图7 OTUs韦恩图
2.7.1 肠道菌群的多样性分析
由稀释曲线(图8A)可知,样品测序量充分,测序深度足以覆盖大多数菌群,可进行数据分析。菌群物种的多样性和丰度由多样性分析体现(图8B~D),由Chao1指数图可见,与正常组相比,高脂组小鼠肠道菌群丰度极显著降低(<0.01),阳性组和龙井组显著降低(<0.05);由香农指数和辛普森指数所示,正常组菌群多样性良好,高脂饮食导致肠道菌群多样性显著降低;与高脂组相比,龙井组香农指数显著增高(<0.05),而正常组、龙井组之间辛普森指数无显著差异。
多样性主要通过PCA和PCoA体现出来(图8E和8F),由PCA图(PC1和PC2分别占小鼠肠道菌群结构总体差异的58.69%和9.84%)结果可知,正常组与高脂组、阳性组、龙井组肠道菌群组成结构两两之间存在差异,但是鸠坑龙井茶干预后小鼠肠道菌群的组成结构趋近于正常组,说明鸠坑龙井茶具有改善高脂饮食导致的小鼠肠道菌群多样性紊乱效应,并且促使小鼠肠道菌群结构趋向于正常组小鼠肠道菌群生态。
2.7.2 肠道菌群组成分析
肠道菌群各水平上分布如图9所示。在门水平上主要检测到Firmicutes、Bacteroidota、Desulfobacterota和Actinobacteriota等4种菌群(图9A)。与正常组相比,高脂组小鼠肠道菌群中Desulfobacterota的相对丰度增加,并且Firmicutes/Bacteroidota比值(F/B值)提高;经龙井茶干预后,小鼠肠道菌群中Firmicutes相对丰度降低,Bacteroidota相对丰度增加,F/B值降低趋势明显,显示小鼠肠道菌群组成有改善效果。
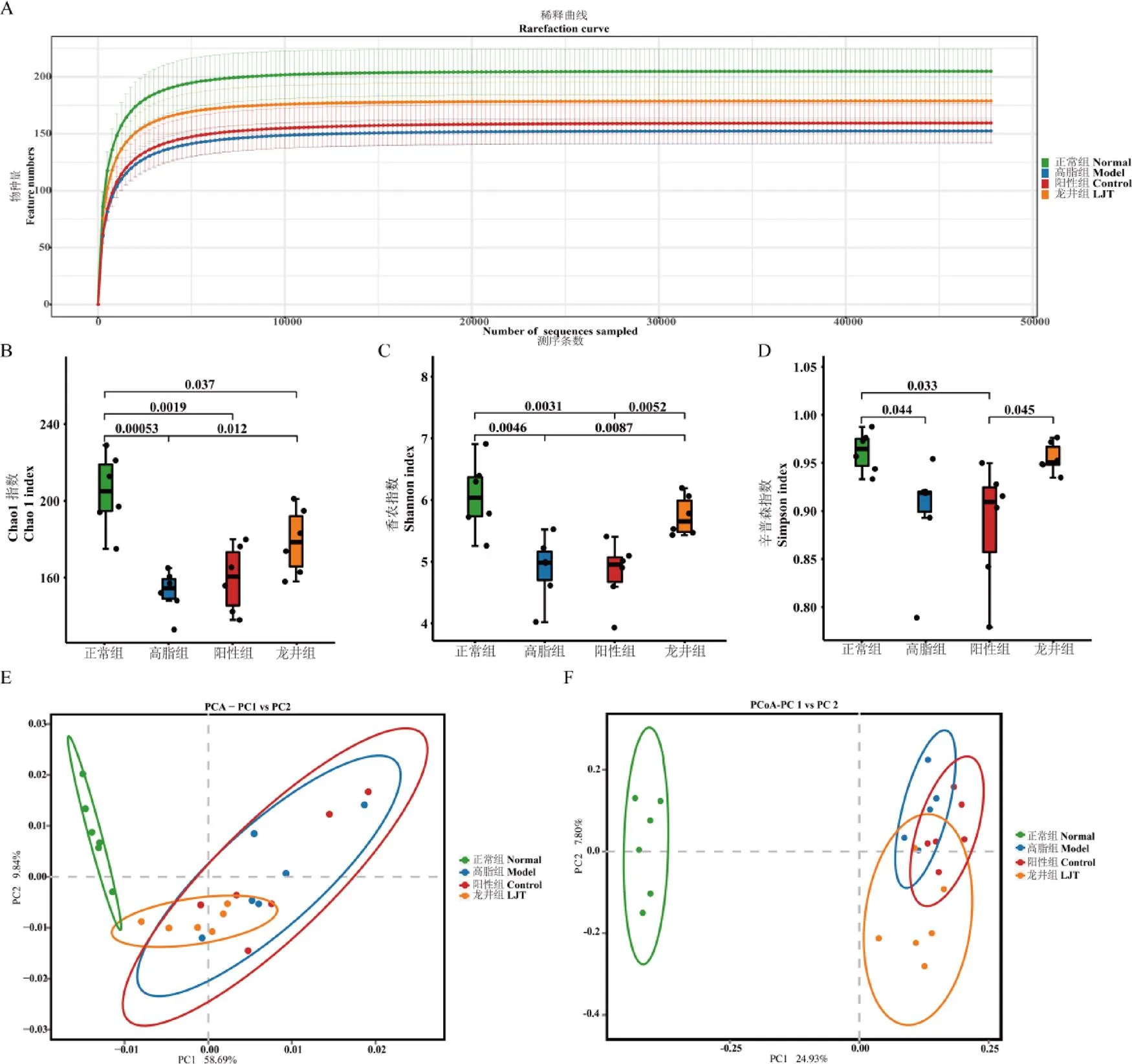
注:A为稀释曲线,B为Chao1指数,C为香农指数,D为辛普森指数,E为PCA图,F为PCoA图

注:A为门水平上菌群分布,B为目水平菌群分布,C为属水平菌群分布
在目水平上主要检测到Lachnospirales、Bacteroidales、Oscillospirales、Erysipelotrichales、Desulfovibrionales、Coriobacteriales等菌群(图9B)。与正常组相比,高脂组小鼠肠道菌群中Lachnospirales、Desulfovibrionales、Oscillospirales、Coriobacteriales、Peptostreptococcales_Tissierellales的相对丰度升高,而Bacteroidales、Erysipelotr-ichales、Verrucomicrobiales、Campylobacterales和Clostridia_UCG_014的相对丰度降低;阳性组小鼠肠道菌群中Lachnospirales、Peptostre-ptococcales_Tissierellales、Erysipelotrichales和Clostridia_UCG_014相对丰度进一步升高,Bacteroidales、Oscillospirales和Campylobac-terales相对丰度降低;龙井组小鼠肠道菌群中Lachnospirales、Desulfovibrionales和Campylobacterales相对丰度降低,同时Bacteroidales、Erysipelotrichales、Coriobacteriales、Peptostreptococcales_Tissierellales和Clostridia_UCG_014相对丰度升高。
小鼠的肠道菌群在属水平的分布如图9C所示。与正常组相比,高脂组小鼠肠道菌群中、、、和的相对丰度上调,同时、和相对丰度下调;阳性组小鼠肠道菌群经阳性药物干预后,、、和相对丰度下降,而相对丰度上升;龙井组小鼠肠道菌群经鸠坑龙井茶干预后,、、和相对丰度下降,-、、、和相对丰度上升。
2.7.3 LEfSe分析
经LEfSe多级物种差异线性判别分析(LDA≥4),各组小鼠体内菌群变化结果如图10所示。正常组小鼠肠道中主要标志性菌属为、、、、、和;高脂组小鼠主要标志性菌属为和;阳性组小鼠主要标志性菌属为、、和;龙井组标志性菌属主要为。
2.7.4 KEGG通路功能性预测分析
由图11A所示,与正常组相比,高脂组下调花生四烯酸代谢、磷酸盐和次磷酸盐代谢、核黄素代谢、丙氨酸代谢、-亚麻酸代谢、维他命B6代谢、烟酸和烟酰胺代谢、亚油酸代谢、-谷氨酰胺和-谷氨酸代谢、入脂代谢、磷酸肌醇代谢和甘氨酸,丝氨酸和苏氨酸代谢,上调甲烷代谢、C5-支链二元酸代谢、2-氧羧酸代谢、卟啉与叶绿素代谢和半胱氨酸、蛋氨酸代谢。由图11B所示,与高脂组相比,龙井组下调次生代谢的生物合成、C5-支链二元酸代谢、淀粉和蔗糖代谢、氰基氨基酸代谢和氮代谢,推测鸠坑龙井茶具有调节C5-支链二元酸代谢作用。
2.7.5 小鼠肠道菌群丰度与生化指标相关性分析
肠道菌群丰度与小鼠生化指标相关性结果如图12A所示。小鼠体质量与相对丰度负相关;TG含量与和相对丰度负相关,与相对丰度正相关;LDL-C含量与、、和相对丰度负相关,与和相对丰度正相关;AST活性水平与、、和-相对丰度负相关,与和相对丰度正相关。其中,与小鼠体质量及血清指标相关性最高的肠道菌种为和。
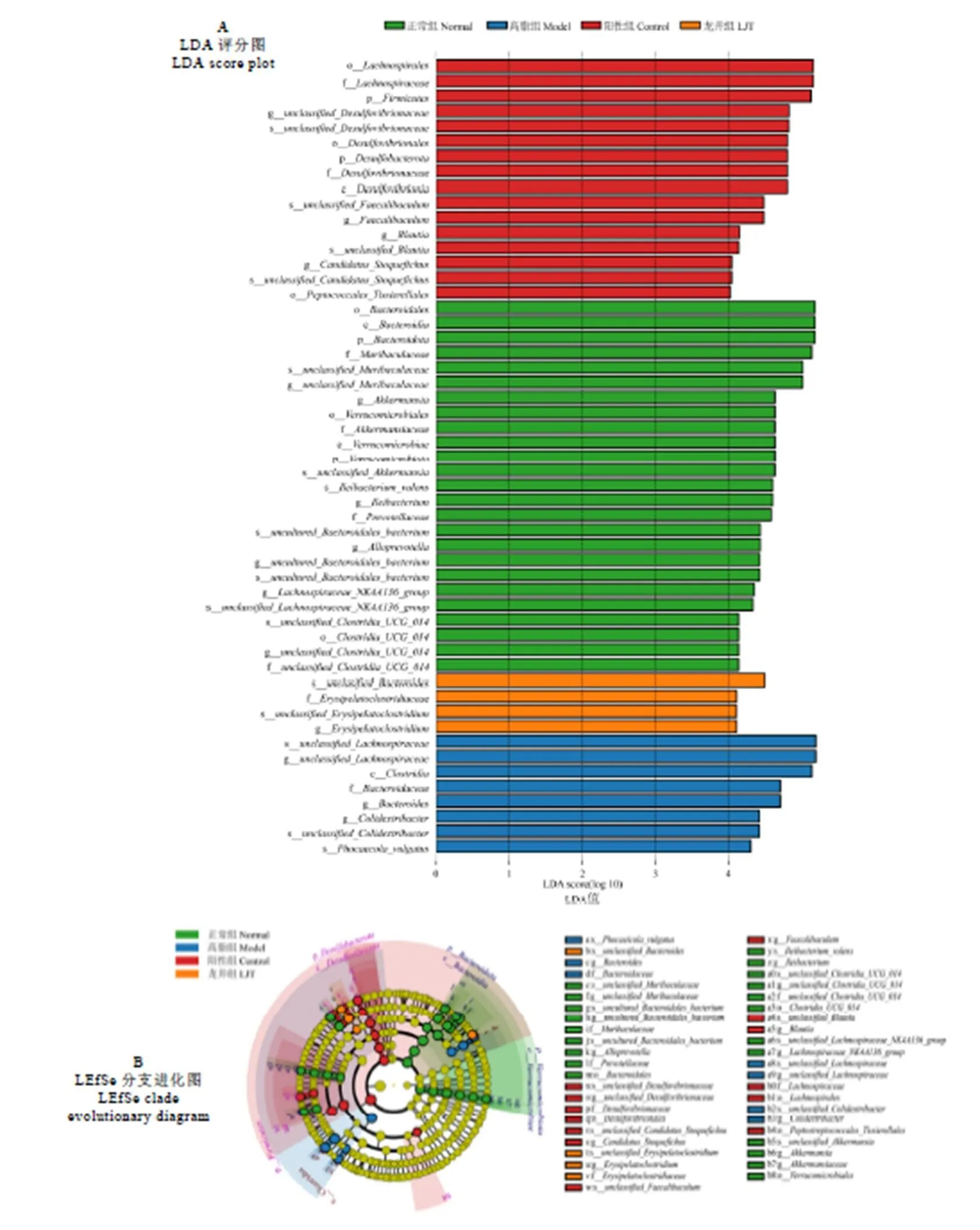
图10 LEfSe分析

注:A为正常组与高脂组KEGG对比(由于数据过多,仅展示人类疾病分类且P<0.01),B为高脂组与龙井组KEGG对比
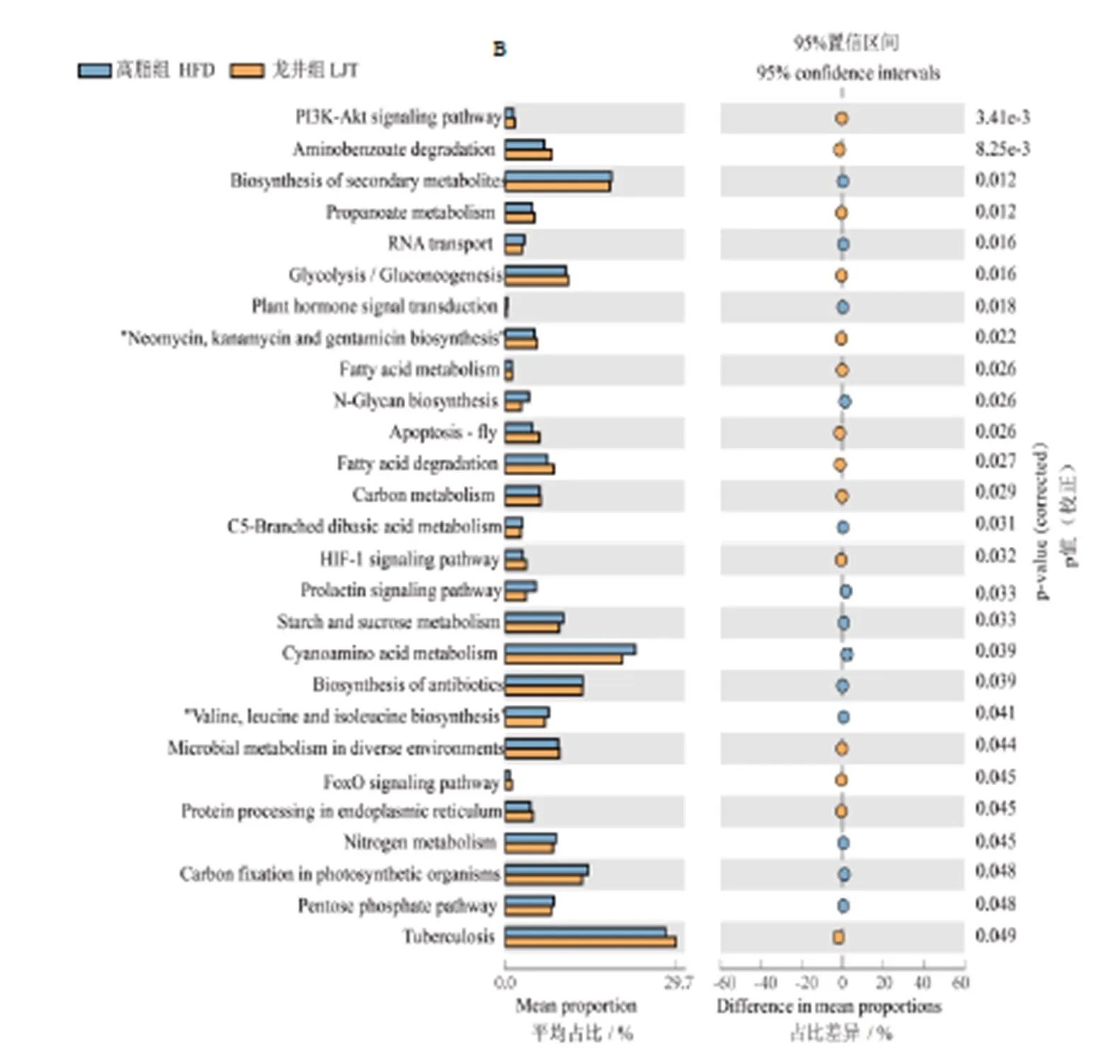
续图11
Continued Fig.11
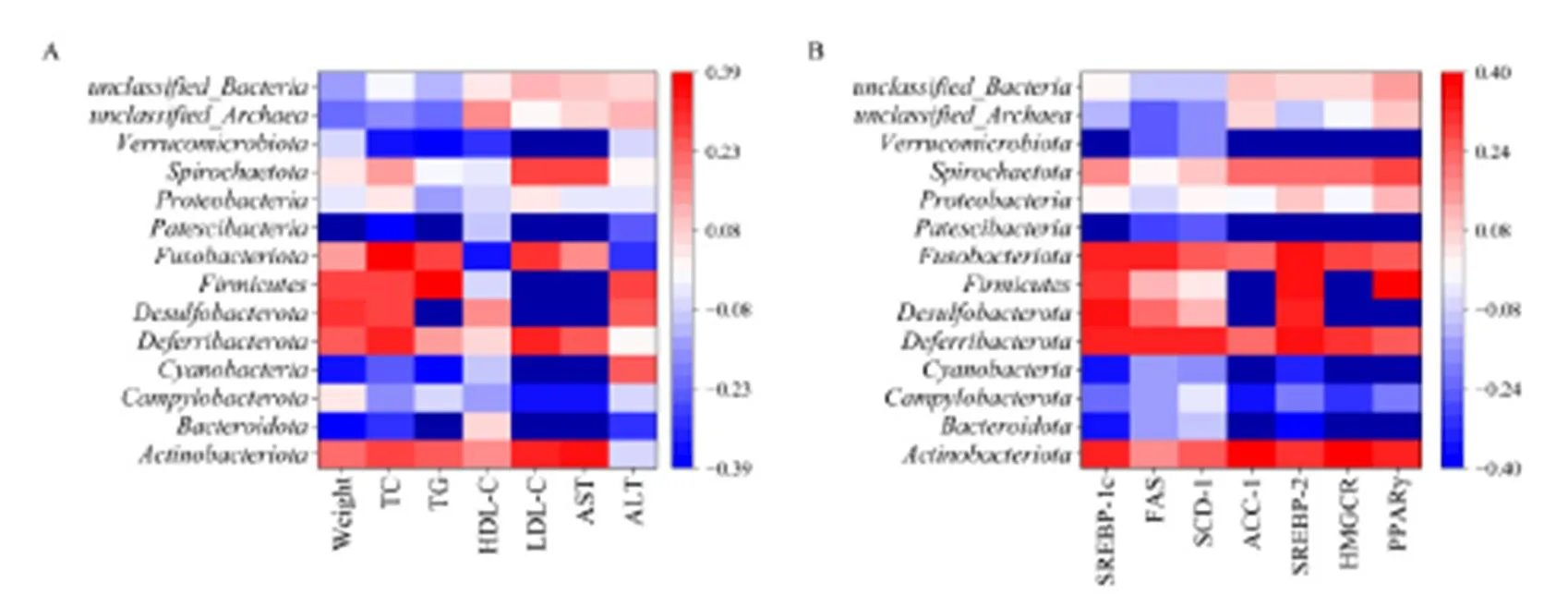
注:A为小鼠体质量、血清生化指标与肠道菌群丰度相关性,B为小鼠肝脂质代谢基因相对表达量与肠道菌群丰度相关性
肠道菌群丰度与小鼠肝脂质代谢通路基因相对含量相关性分析如图12B所示。SREBP-1基因相对含量与Patescibacteria、Verrucomicrobiota和unclassified_Archaea相对丰度呈负相关,ACC-1基因相对含量与Bacteroidota、Cyanobacteria、Patescibacteria和Verrucomicrobiota相对丰度呈负相关,与Desulfobacterota和Firmicutes呈正相关;SREBP-2基因相对含量与Patescibacteria和Verrucomicrobiota相对丰度呈负相关;HMGCR基因相对含量与Bacteroidota、Cyanobacteria、Patescibacteria和Verrucomicrobiota相对丰度呈正相关;与Desulfobacterota和Firmicutes相对丰度呈正相关;PPAR基因相对含量与Bacteroidota、Campylobacterota、Cyanobacteria、Patescibacteria和Verrucomicrobiota相对丰度呈负相关,与Desulfobacterota相对丰度呈正相关。其中,小鼠肝脂质代谢基因相对含量与Verrucomicrobiota、Bacteroidota和Cyanobac-teria肠道菌种丰度相关性最高。
3 讨论
本研究以C57BL/6小鼠为研究对象,经9周高脂饮食诱导模型组小鼠血脂升高、肝组织脂肪变性、糖耐受能力下降和肠道菌群紊乱,与相关研究报道结果具有相似性[17-20],进一步佐证本研究中NAFL小鼠造模成功的科学性和可信度。与高脂组相比,经龙井茶水提物干预,小鼠的体质量、血脂水平、肝组织脂肪变性症状得到缓解,小鼠肠道菌群多样性和丰度明显增加并趋于正常组肠道菌群生态。
在脂肪代谢过程中,PPAR是启动脂肪细胞分化的起点[21]。PPAR在脂肪分化方面具有决定性作用[22]。SREBP-1c可靶向促进脂质合成基因-、、-的表达,推动脂肪酸的合成,在TG和TC合成中发挥重要作用[23],其异常高表达会导致肝TG积累和脂代谢紊乱。通过龙井茶水提物干预,促使高脂饮食诱导的小鼠肝组织脂肪合成关键酶AMPK活性增强,调控脂质代谢通路信号p-ACC-1/ACC-1比例升高,降低ACC-1蛋白质表达水平,从而抑制脂肪酸合成,减少肝组织脂质蓄积[24]。本研究结果显示,鸠坑龙井茶水提物具有抑制脂质代谢通路SREBP-1c及其下游脂联素基因、和-的相对表达量,阻断肝组织脂肪持续堆积,延缓肝组织脂肪变性,进而缓解NAFLD的进展。
SREBPs存在3种形式的亚型,除SREBP-1c外还存在SREBP-1a和SREBP-2[25]。SREBP-2是体内参与调节细胞胆固醇代谢合成相关酶类的基因调控因子,可直接作用于TC合成途径的限速酶HMGCR,从而直接调节胆固醇的合成,同时还反馈调节减少内源性胆固醇的生物合成[26]。本研究结果显示,鸠坑龙井茶水提物具有降低小鼠肝组织-和基因相对表达量,减少肝脏内胆固醇从头合成。
人体肠道中寄生的细菌数量有近1014,调控人体对摄入饮食的消化吸收,是决定摄入能量转化率的重要组分。本研究结果显示,鸠坑龙井茶水提物能够改善NAFLD小鼠的肠道菌群结构,使其接近正常小鼠肠道菌群的生态。肠道菌群在门水平中的主要菌为Bacteroidota、Firmicutes、Actinobacteriota和Proteobacteria,占肠道菌群的98%,肠道和肝脏通过门静脉直接关联,通过“肠-肝轴”影响肝脏脂质代谢[27],肠道菌群失衡是促进NAFLD的重要因素[28]。已有研究报道,高脂饮食C57BL/6小鼠与正常饮食小鼠相比,肠道菌群中厚壁菌门的种类和数量增加,而拟杆菌门的种类和数量下降[29],F/B值升高[30],F/B值常被用来作为肠道菌群有序性的评判标准。本研究结果证实了高脂饮食能够引起小鼠肠道菌群中F/B值升高,而龙井组小鼠肠道菌群F/B值下降,表明鸠坑龙井水提物具有调节和改善小鼠肠道菌群紊乱的作用效应。
Guo等[31]研究发现,在结肠中产生H2S,抑制结肠上皮细胞呼吸作用[32],抑制丁酸盐等短链脂肪酸(SCFAs)的生成。本研究发现,在高脂组小鼠肠道菌群中相对丰度上升,而在龙井组相对丰度下降。Carter等[33]研究发现,和能促进丁酸盐的产生,相对丰度与丙酸含量有很强的相关性[34],丁酸可刺激食欲抑制激素分泌,促脂质代谢从而减缓NAFLD[35-36]。本研究分析发现,鸠坑龙井茶水提物干预后,小鼠肠道菌群中和Erysipelotrichales相对丰度增加,表明鸠坑龙井茶水提物具有促进肠道菌群代谢产生友好型短链脂肪酸的效应,进而缓解小鼠NAFLD症状。
[1] Hardy T, Oakley F, Anstee Q M, et al. Nonalcoholic fatty liver disease: pathogenesis and disease spectrum [J]. Annual Review of Pathology, 2016, 11: 451-496.
[2] Paternostro R, Trauner M. Current treatment of non-alcoholic fatty liver disease [J]. Journal of Internal Medicine, 2022, 292(2): 190-204.
[3] Brouwers M C G J, Simons N, Stehouwer C D A, et al. Non-alcoholic fatty liver disease and cardiovascular disease: assessing the evidence for causality [J]. Diabetologia, 2020, 63(2): 253-260.
[4] Carmiel-Haggai M, Cederbaum A I, Nieto N. A high-fat diet leads to the progression of non-alcoholic fatty liver disease in obese rats [J]. The FASEB Journal, 2005, 19(1): 136-138.
[5] El-Koofy N M, Anwar G M, El-Raziky M S, et al. The association of metabolic syndrome, insulin resistance and non-alcoholic fatty liver disease in overweight/obese children [J]. Saudi Journal of Gastroenterology, 2012, 18(1): 44-49.
[6] Powell E E, Wong V W, Rinella M. Non-alcoholic fatty liver disease [J]. Lancet, 2021, 397(10290): 2212-2224.
[7] Bashiardes S, Shapiro H, Rozin S, et al. Non-alcoholic fatty liver and the gut microbiota [J]. Molecular Metabolism, 2016, 5(9): 782-794.
[8] Charroux B, Royet J. Gut-derived peptidoglycan remotely inhibits bacteria dependent activation of SREBP byadipocytes [J]. Plos Genetics, 2022, 18(3): e1010098. doi: 10.1371/journal.pgen.1010098.
[9] 朱荫, 邵晨阳, 张悦, 等. 不同茶树品种龙井茶香气成分差异分析[J]. 食品工业科技, 2018, 39(23): 241-246, 254. Zhu Y, Shao C Y, Zhang Y, et al. Comparison of differences in aroma constituents of Longjing tea produced from different tea germplasms [J]. Science and Technology of Food Industry, 2018, 39(23): 241-246, 254.
[10] 孙达, 龚恕, 崔宏春, 等. 不同品种茶树春秋季鲜叶超微绿茶粉适制性研究[J]. 浙江农业学报, 2021, 33(3): 437-446. Sun D, Gong S, Cui H C, et al. Suitablity of fresh spring and autumn leaves from different tea cultivars for ultramicro green tea powder production [J]. Acta Agriculturae Zhejiangensis, 2021, 33(3): 437-446.
[11] 王素敏, 徐欢欢, 黄业伟, 等. 茶多酚的降脂作用及其机制研究进展[J]. 食品研究与开发, 2016, 37(10): 219-224. Wang S M, Xu H H, Huang Y W, et al. Review on the effect of tea polyphenols in hypolipidemic and its medchanism [J]. Food Research and Development, 2016, 37(10): 219-224.
[12] Li B Y, Li H Y, Zhou D D, et al. Effects of different green tea extracts on chronic alcohol induced-fatty liver disease by ameliorating oxidative stress and inflammation in mice [J]. Oxid Med Cell Longev, 2021, 2021: 5188205. doi: 10.1155/2021/5188205.
[13] Ma H, Zhang B, Hu Y, et al. The novel intervention effect of cold green tea beverage on high-fat diet induced obesity in mice [J]. Journal of Functional Foods, 2020, 75: 104279. doi: 10.1016/j.jff.2020.104279.
[14] 王忠民, 吴谋成, 李小定, 等. 葡萄多糖的提取及含量测定[J]. 新疆农业大学学报, 2002, 25(2): 57-58. Wang Z M, Wu M C, Li X D, et al. Extraction and contents, measurement of the VLP [J]. Journal of Xinjiang Agricultural University, 2002, 25(2): 57-58.
[15] Li M, Xu J, Zhang Y, et al. Comparative analysis of fecal metabolite profiles in HFD-induced obese mice after oral administration of Huangjinya green tea extract [J]. Food and Chemical Toxicology, 2020, 145: 111744. doi: 10.1016/j.fct.2020.111744.
[16] 冯琳, 龚自明, 刘盼盼, 等. 青砖毛茶对高脂饮食小鼠肠道微生物的影响[J]. 中国食品学报, 2021, 21(7): 87-96. Feng L, Gong Z M, Liu P P, et al. Effects of Qingzhuan Maocha on gut microbiota in high-fat diet fed mice [J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(7): 87-96.
[17] Ma H, Zhang B, Hu Y, et al. Correlation analysis of intestinal redox state with the gut microbiota reveals the positive intervention of tea polyphenols on hyperlipidemia in high fat diet fed mice [J]. Journal of Agricultural and Food Chemistry, 2019, 67(26): 7325-7335.
[18] Velázquez K T, Enos R T, Bader J E, et al. Prolonged high-fat-diet feeding promotes non-alcoholic fatty liver disease and alters gut microbiota in mice [J]. World Journal of Hepatology, 2019, 11(8): 619-637.
[19] Aydos L R, Do Amaral L A, De Souza R S, et al. Nonalcoholic fatty liver disease induced by high-fat diet in C57BL/6 models [J]. Nutrients, 2019, 11(12): 3067. doi: 10.3390/nu11123067.
[20] Yin J, Li Y, Han H, et al. Melatonin reprogramming of gut microbiota improves lipid dysmetabolism in high-fat diet-fed mice [J]. Journal of Pineal Research, 2018, 65(4): e12524. doi: 10.1111/jpi.12524.
[21] 黄玉晶. 邻苯二甲酸酯母体暴露对早产和胎儿发育的影响及过氧化物酶体增殖物激活受体在其中的作用研究[D]. 重庆: 第三军医大学, 2014. Huang Y J. The role of peroxisome proliferator activated receptor in the effects of gestation exposure to phthalates on preterm delivery and fetal development [D]. Chongqing: Army Medical University, 2014.
[22] 刘亚茹, 苗志国, 高明磊, 等. PPAR在动物脂肪发育中的研究进展[J]. 黑龙江畜牧兽医, 2019(1): 32-35. Liu Y R, Miao Z G, Gao M L, et al. Research advance on PPARin animal adipose tissue [J]. Heilongjiang Animal Science and Veterinary Medicine, 2019(1): 32-35.
[23] Shi W, Hou T, Guo D, et al. Evaluation of hypolipidemic peptide (Val-Phe-Val-Arg-Asn) virtual screened from chickpea peptides by pharmacophore model in high-fat diet-induced obese rat [J]. Journal of Functional Foods, 2019, 54: 136-145.
[24] Geng T T, Liu Y, Xu Y T, et al. H19 lncRNA promotes skeletal muscle insulin sensitivity in part by targeting AMPK [J]. Diabetes, 2018, 67(11) : 2183-2198.
[25] Loregger A, Raaben M, Nieuwenhuis J, et al. Haploid genetic screens identify SPRING/C12ORF49 as a determinant of SREBP signaling and cholesterol metabolism [J]. Nature Communications, 2020, 11: 1128. doi: 10.1038/s41467-020-14811-1.
[26] Wei S, Espenshade P J. Expanding roles for SREBP in metabolism [J]. Cell Metabolism, 2012, 16(4): 414-419.
[27] Milosevic I, Vujovic A, Barac A, et al. Gut-liver axis, gut microbiota, and its modulation in the management of liver diseases: a review of the literature [J]. International Journal of Molecular Sciences, 2019, 20(2): 395. doi: 10.3390/ijms20020395.
[28] Soderborg T K, Clark S E, Mulligan C E, et al. The gut microbiota in infants of obese mothers increases inflammation and susceptibility to NAFLD [J]. Nature Communications, 2018, 9: 4462. doi: 10.1038/s41467-018-06929-0.
[29] Ley R E, Bäckhed F, Turnbaugh P, et al. Obesity alters gut microbial ecology [J]. PNAS, 2005, 102(31): 11070-11075.
[30] Do M H, Lee H B, Oh M J, et al. Polysaccharide fraction from greens ofalleviates high fat diet-induced obesity [J]. Food Chemistry, 2021, 33:128395. doi: 10.1016/j.foodchem.2020.128395.
[31] Guo J L, Han X, Zhan J C, et al. Vanillin alleviates high fat diet-induced obesity and improves the gut microbiota composition [J]. Frontiers in Microbiology, 2018, 9: 2733. doi: 10.3389/fmicb.2018.02733.
[32] Beaumont M, Andriamihaja M, Lan A, et al. Detrimental effects for colonocytes of an increased exposure to luminal hydrogen sulfide: the adaptive response [J]. Free Radical Biology and Medicine, 2016, 93: 155-164.
[33] Carter J K, Bhattacharya D, Borgerding J N, et al. Modeling dysbiosis of human NASH in mice: loss of gut microbiome diversity and overgrowth of[J]. Plos One, 2021, 16(1): e0244763.
[34] Smith B J, Miller R A, Ericsson A C, et al. Changes in the gut microbiome and fermentation products concurrent with enhanced longevity in acarbose-treated mice [J]. BMC Microbiology, 2019, 19: 130. doi: 10.1186/s12866-019-1494-7.
[35] Musso G, Gambino R, Cassader M. Obesity, diabetes, and gut microbiota: the hygiene hypothesis expanded? [J]. Diabetes Care, 2010, 33(10): 2277-2284.
[36] Den Besten G, Bleeker A, Gerding A, et al. Short-chain fatty acids protect against high-fat diet-induced obesity via a PPAR-dependent switch from lipogenesis to fat oxidation [J]. Diabetes, 2015, 64(7): 2398-2408.
Effect of JiukengLongjing Tea on SREBPs Signaling Pathway and Gut Microbiota Regulation in High-fat Diet C57BL/6 Mice with Hepatic Steatosis
GONG Mingxiu1,2, YUAN Yiwei1,2, ZHANG Yifan1,2, YE Jiangcheng1,2, GUO Li3, LI Xiaojun4, HUANG Hao4, MAO Yuxiao5, ZHAO Yun5, ZHAO Jin1,2*
1. Institute of Food Nutrition and Quality Safety, College of Life Sciences, China Jiliang University, Hangzhou 310018, China; 2. Key Laboratory of Pecialty Agri-product Quality and Hazard Controlling Technology of Zhejiang Province, Hangzhou 310018, China; 3. TeaResearch Institute, Chinese Academy of Agricultural Sciences, Hangzhou 310008, China; 4. Doctor Innovation Workstation of Zhejiang Yifutang Tea Industry Co., Ltd., Hangzhou 311500, China; 5. Hangzhou Academy of Agricultural Sciences, Hangzhou 310024, China
To investigate the effect of Jiukeng Longjing tea water extract (LJT) on liver steatosis and the regulation of gut microbiota in C57BL/6 mice fed with high-fat diet, a non-alcoholic fatty liver model was established in mice induced by a high-fat diet, and LJT (300 mg·kg-1) was gavaged for intervention. The body weight of mice was recorded regularly, and serum biochemical indicators such as AST, ALT, TC, TG, LDL-C, HDL-C, and glucose tolerance levels were measured. The characteristics of HE staining and oil red O staining liver tissue sections were observed and analyzed. Real-time qPCR technology was used to detect the expressions of seven genes including,,,,,, andin mouse liver tissues. The relative expressions of proteins related to lipid metabolism were studied by western blot. At the same time, the gut microbiota of mice was sequenced by high-throughput sequencing (16 S rDNA) and its structure was analyzed. The results show that the body weight, blood glucose AUC, serum TG, TC, LDL-C, and liver TG, TC levels significantly decreased under LJT intervention. Western blot shows that LJT intervention reduced the expressions of SREBP-1c, FAS, ACC-1, SCD-1, and PPARin liver tissue of mice. LJT also significantly downregulated the relative expressions of,,,,,andin liver tissue. The 16 S rDNA detection reveals that the levels of gut microbiota were mainly classified into four categories: Firmicutes, Bacteroidota, Desulfobacterota, and Actinobaciota. LJT could effectively alleviate the trend of increasing the relative abundance of Firmicutes and decreasing the relative abundance of Bacteroidota caused by high-fat diet, and increase the species abundance of gut microbiota. Therefore, LJT could interfere with the signal expression of SREBPs pathway in mouse liver steatosis, and improve the disturbance of gut microbiota in mice, thereby achieve the effect of reducing fat and weight loss.
Jiukeng Longjing tea, non-alcoholic fatty liver, SREBPs path, gut microbiota dysbiosis, lipid-lowering effect
S571.1,R151.3
A
1000-369X(2023)04-576-17
2023-01-16
2023-04-12
浙江省重点研发计划项目(2020C02045)、杭州市农业与社会发展科研项目(202203A06、202203A11、202203B09)、开化茶产业提升浙江省团队科技特派员项目、杭州市科技特派员项目(20221122I80)、衢州市重点科技攻关项目科技强农专项(2023k098)
龚明秀,女,硕士研究生,主要从事药食同源植物营养与功效评价研究。*通信作者:zhaojin@cjlu.edu.cn

