基于高通量测序技术探究套种灵芝的茶树根际土壤真菌群落结构特征
韩海东,周柳婷,黄小云,俞成然,黄秀声
基于高通量测序技术探究套种灵芝的茶树根际土壤真菌群落结构特征
韩海东,周柳婷*,黄小云,俞成然,黄秀声*
福建省农业科学院农业生态研究所/福建省丘陵地区循环农业工程技术研究中心,福建 福州 350013
茶园套种灵芝是将茶叶加工的废弃物资源化再利用的生态循环间作模式,所形成的复合群体可以更彻底地覆盖地面,在改善土壤微生物群落结构,维持土壤微生态系统平衡等方面发挥重要作用。以未套种(CK)、套种1年(A1)、套种2年(A2)、套种3年(A3)的茶树根际土壤为研究对象,利用Miseq PE300高通量测序技术探究土壤真菌群落结构变化特征。结果表明,与CK相比,套种灵芝显著提高了茶树根际土壤碱解氮、速效磷、速效钾及有机碳含量,其中A3土壤升幅最高,各养分含量分别达32.36%、13.01%、69.21%和9.56%。多样性指数表明,茶树根际土壤真菌群落Observed species指数和Chao1指数呈现CK>A3>A1>A2;ACE指数、Shannon指数和Simpson指数呈现A3>CK>A1>A2。多样性指数表明,A2与CK、A1、A3的茶树根际土壤真菌群落组成结构差异相对较大。分类学分析发现,茶树根际土壤真菌分布于18门48纲135目309科632属。在门水平上,子囊菌门(Ascomycota)是CK、A1和A3的优势菌门,相对丰度分别为71.28%、68.74%和51.79%;担子菌门(Basidiomycota)是A2的优势菌门,相对丰度为64.48%。在属水平上,与CK相比,套种灵芝的茶树根际土壤A1中角担菌属()、被孢霉属()、毛孢子菌属()和三形菌属()分别显著上升59.14、1.34、3.70倍和1.92倍(<0.05);A2土壤的古根菌属()显著下降76.81%,而棉革菌属()和支孢瓶霉属()分别显著上升788.43倍和36.24倍(<0.05);A3土壤的被孢霉属和灵芝属()分别显著上升1.09倍和0.81倍(<0.05)。综上所述,茶园套种灵芝可有效调节茶树根际土壤真菌群落组成结构,改善茶园土壤微生态环境,为茶园可持续绿色发展提供理论依据。
茶园;套种灵芝;根际土壤;真菌群落结构
福建省茶产业发展历史悠久,茶产业既是千亿产业链“三产融合”的特色产业,也是我国助力全面推进新农村发展和乡村振兴的优势产业[1]。然而,由于福建省“八山一水一分田”的地形特征,大部分茶园由丘陵山地开发而来,茶农为了追求茶叶产量而不断进行茶园彻底清杂,使茶园生物多样性遭受严重破坏和损失,导致土壤养分流失,保水透气性降低。此外,茶树属于喜酸富铝植物,进一步加剧了茶园土壤酸化、微生物数量减少、微生物群落多样性降低等一系列生态环境问题,严重威胁茶树根际土壤质量[2]。
科学的间套作模式是茶园生境管理的有效措施之一,可以提高茶园生物多样性,改善和丰富土壤微生物种类、数量及活性,提高茶园保益控害的生态系统服务功能[3]。研究表明,茶园间套种白三叶草、黑麦草、圆叶决明、平托花生、百喜草等绿肥作物后,土壤微生物种类和数量显著增加,尤其土壤中有益真菌菌属的相对丰度显著提高[4-8]。茶园间作食用菌有利于提高水、热、光和空间等生境资源的利用率,进而改变土壤微生物生命活动的物质基础和生存条件[9-10]。有研究表明,茶树套种长根菇的间作模式可显著提高土壤速效氮、磷、钾含量,但对土壤有机质和pH影响不明显[11]。间作灵芝后茶园土壤变形菌门(Proteobacteria)相对丰度显著提高21.18%,而酸杆菌门(Acidobacteria)和芽单胞菌门(Gemmatimonadetes)的相对丰度显著降低15.09%和53.52%;在属水平上,间作灵芝处理显著提高了土壤有益微生物菌属相对丰度[12]。目前关于茶园套种食用菌间作模式的研究多集中于土壤理化性质、茶叶品质及产量、土壤细菌群落种类和数量等方面,对茶树根际土壤真菌群落组成结构的研究未见报道。
高通量测序技术具有通量高、灵敏度高、准确度高、样本量较低等优点,可以更深入全面地揭示环境中微生物组成结构及多样性变化[13]。因此,本研究以未套种(CK)、套种1年(A1)、套种2年(A2)和套种3年(A3)的茶树根际土壤为研究对象,采用Miseq PE300高通量测序技术探讨套种灵芝对茶树根际土壤真菌群落结构的影响,为该生态循环间作模式服务茶产业可持续发展提供理论依据。
1 材料与方法
1.1 试验小区概况与设计
1.1.1 试验区域概况
试验样地选址于武夷山市张天福有机茶园示范基地(117°5'50'' E,27°38'21'' N)。该基地占地面积3 000 m2,地处中亚热带季风湿润气候区,平均海拔335 m。试验茶树品种为奇丹,树龄5年。试验区土壤质地为砂壤土,理化性质如下:pH 5.60、有机质35.70 g·kg-1、全氮1.75 g·kg-1、全磷0.95 g·kg-1、全钾7.23 g·kg-1、碱解氮174.06 mg·kg-1、速效磷76.30 mg·kg-1、速效钾266.01 mg·kg-1。
1.1.2 试验小区设计
在试验园区内地形地势及茶树长势基本一致的山地上设置4个样地:未套种(CK)、套种1年(A1)、套种2年(A2)和套种3年(A3),每个样地随机设3个100 m2的重复小区,共12个小区,小区间设保护行。分别于2017年(A3)、2018年(A2)、2019年(A1)开沟套种灵芝。套种方法:每年5月上旬茶叶采收完毕后,在每个小区的茶树树冠垂直下方土层开凿约20 cm深沟,将250根灵芝菌棒脱去塑料外膜并填埋于深沟内,覆土。每年7月中上旬采摘灵芝,菌棒留置于土壤中。灵芝菌棒质量约2 kg,长度约40 cm,配方为70%茶梗、10%木粉、15%麦麸及5%其他,有机碳和有机氮含量分别为165 g·kg-1和3.2 g·kg-1。
1.2 试验方法
1.2.1 土壤样品采集
2020年9月,在每个小区内随机选择5株长势相近的茶树,逐层铲除表层覆土,剪下茶树细根分枝并轻轻抖落根围土,用小毛刷收集仍紧贴于细根表面的根际土壤至无菌袋中,并迅速用液氮冷冻保存。将每个小区内取得的5份根际土壤混匀为1份土样,共获得12份土壤样品。土样通过2 mm筛去除细根、碎石等杂物后,将每份土样混匀分成2份装入无菌袋,每份5 g,一份保存于4 ℃冰箱用于测定土壤基础理化指标,另一份用液氮冷冻运输至北京奥维森基因科技有限公司进行ITS1 MiSeq PE300测序。
1.2.2 土壤真菌群落结构分析
根际土壤真菌DNA提取与PCR扩增:采用PowerSoil DNA Isolation Kit试剂盒(MoBio Laboratories,Inc.,CA)抽提根际土壤基因组DNA,利用1%琼脂糖凝胶电泳检测基因组DNA片段大小,并通过Nanodrop 2000(Thermo Scientific,美国)测定DNA浓度。以稀释至1 ng·μL-1的基因组DNA为模板,对土壤真菌ITS1区进行PCR扩增,扩增引物为ITS1-F(5'-CTTGGTCATTTAGAGGAAGTA A-3')和ITS2-R(5'-TGCGTTCTTCATCGATGC-3'),采用1%琼脂糖凝胶电泳检测扩增产物质量。
1.3 数据分析
通过Illumina MiSeq平台进行Paired-end测序,下机数据经QIIME(v 1.8.0)软件过滤、拼接、去除嵌合体后,剔除碱基模糊、引物错配或长度小于150 bp的低质量序列。利用QIIME(v 1.8.0)和Uclust(v 1.2.22)对97%相似度的有效序列分配运算分类单元(Operational taxonomic unit,OTU),与Silva数据库比对后,得到每个OTU对应的物种分类信息。运用Mothur软件(v 1.31.2)进行多样性分析;基于Weighted Unifrace距离矩阵,利用R(v 3.1.1)软件包的非加权组平均法(UPGMA)进行聚类分析;通过Bray-Curtis算法计算多样性距离矩阵,基于系统进化信息比较各样品间的物种群落差异。具体的数据分析软件和算法参考北京奥维森基因科技有限公司官方网站的说明。使用SPSS 16.0进行数据方差分析,通过LSD比较法进行差异显著性分析(<0.05)。
2 结果与分析
2.1 套种灵芝后茶树根际土壤理化性质变化特征
由表1可知,套种灵芝的栽培模式提高了茶树根际土壤pH值,但差异不显著,即茶园套种灵芝在一定程度上可能会缓解土壤酸化现象。4个土壤样品中,A2土壤的pH值最高(5.83),CK的pH值最低(5.63)。与CK相比,碱解氮、速效磷、速效钾及有机碳含量在A1、A2和A3的土壤中均显著上升(<0.05),且在A3根际土壤中的含量均最高,分别比CK显著上升32.36%、13.01%、69.21%和9.56%;A2和A3茶树根际土壤的全氮和全磷显著高于CK和A1,全氮含量最高的A3比A1显著上升22.83%,全磷含量最高的A2比CK显著上升71.13%(<0.05);与CK相比,A1和A2的微生物量碳含量显著下降27.16%和21.84%(<0.05),在A3中略有上升,但差异不显著。
2.2 套种灵芝后茶树根际土壤真菌群落α多样性分析
多样性是常用于反映微生物群落丰富度和均匀性的综合指标。本试验共产生4 069个OTU,经过抽平处理剩余3 797。基于抽平后的OTU聚类结果进行多样性分析,结果表明,随着测序深度增加,Shannon-Wiener稀释曲线趋于平坦(图1),表明样本测序量已基本饱和,能够反映样本大部分真菌的物种信息。由表2可知,与CK相比,A1和A2茶树根际土壤观察到的物种数、Chao1指数、ACE指数、Shannon指数和Simpson指数均随着灵芝套种年限增加而降低,A2的降幅分别为32.39%、24.21%、22.85%、41.99%和29.90%。与A1和A2相比,A3观察到的物种数、Chao1指数、ACE指数、Shannon指数和Simpson指数均升高,其中A3观察到的物种数、ACE指数和Shannon指数与A1和A2差异显著(<0.05)。A3茶树根际土壤的ACE指数、Shannon指数和Simpson指数均最高,分别比最低的A2显著提高29.72%、83.58%和44.12%。
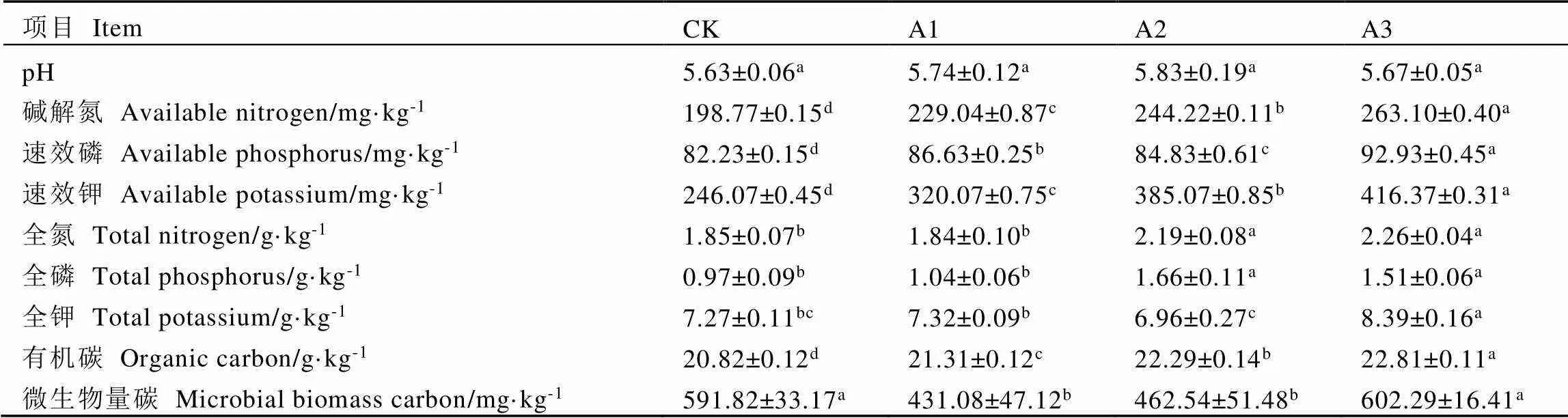
表1 不同处理茶树根际土壤理化性质
注:每行不同字母表示差异达显著水平(<0.05,n=3)
Note: Different letters in each line indicate significant differences (< 0.05, n=3)
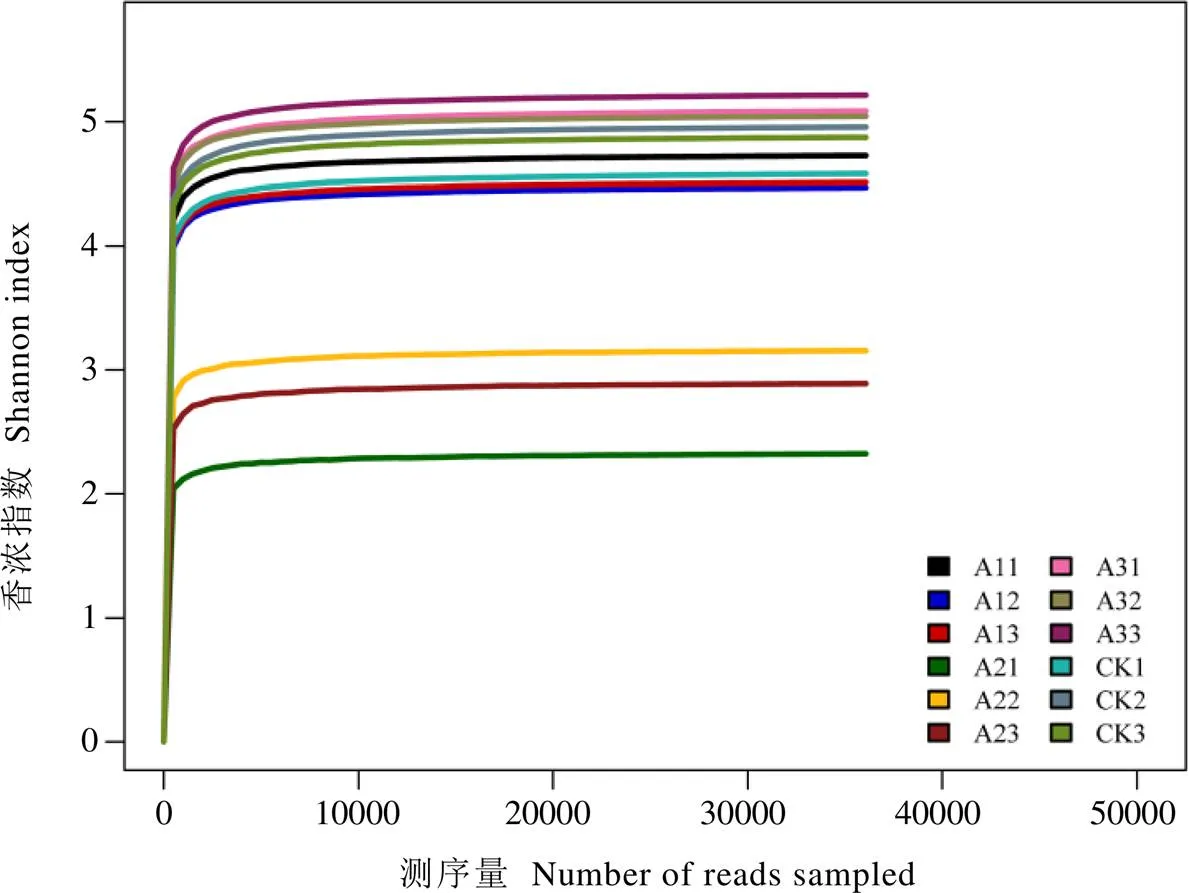
图1 不同处理茶树根际土壤真菌群落Shannon-Wiener曲线
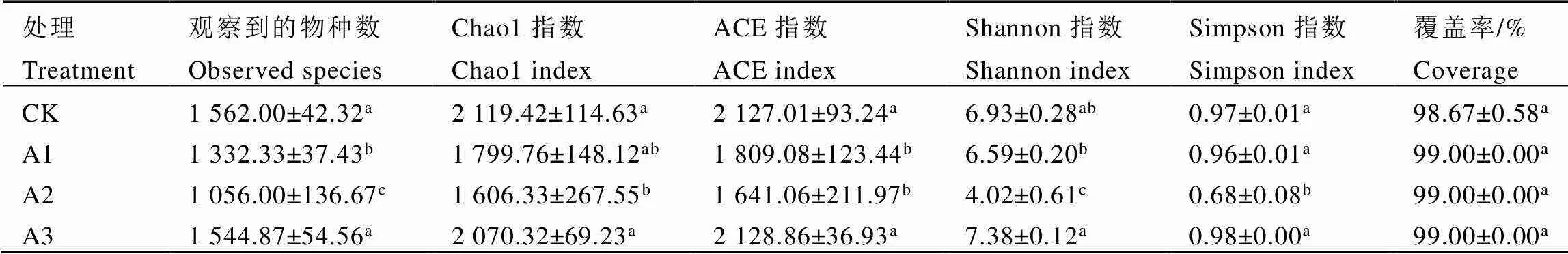
表2 不同处理茶树根际土壤真菌群落多样性指数
注:每列不同字母表示差异达显著水平(<0.05,n=3)
Note: Different letters in each column indicate significant differences (< 0.05, n=3)
2.3 套种灵芝后茶树根际土壤真菌群落β多样性分析
基于OTU的茶树根际土壤真菌群落PCA分析如图2所示,相同颜色的3个重复样本聚集在一起,说明不同处理组内生物学重复性较好。主成分1(PC1)与主成分2(PC2)分别解释变量方差的45.64%和25.21%,两者累计贡献率达70.85%。PC1将A2的OTU群落与CK、A1、A3明显区分开,PC2将A1、A2的OTU群落与CK、A3明显区分开。CK与A3距离较近,与A1、A2距离较远,说明套种灵芝菌棒1年和2年对茶树根际土壤真菌群落多样性的影响较大,套种3年影响程度减小。由层次聚类分析可知(图3),CK土壤的OTU群落首先与A3聚集为1个群体,之后再与A1聚集,最后与A2聚集形成系统发生树。多样性分析结果表明,不同处理的茶树根际土壤真菌群落组成结构存在较大差异,尤其是CK土壤与A2土壤的真菌群落多样性差异较为明显。
2.4 套种灵芝后茶树根际土壤真菌群落组成结构变化
2.4.1 基于门水平不同处理茶树根际土壤真菌群落结构
在茶树根际土壤真菌群落中共检测到18个门,其中,相对丰度前5位的优势类群依次是子囊菌门(Ascomycota,29.01%~71.28%)、担子菌门(Basidiomycota,13.51%~64.48%)、未定义菌门(unidentified,3.55%~9.28%)、被孢霉门(Mortierellomycota,1.01%~3.19%)和球囊菌门(Glomeromycota,1.39%~2.78%)(表3)。子囊菌门是CK、A1和A3土壤的优势菌门,相对丰度分别为71.28%、68.74%和51.79%;而A2土壤的优势菌门为担子菌门,相对丰度为64.48%。

图2 不同处理茶树根际土壤真菌群落PCA分析
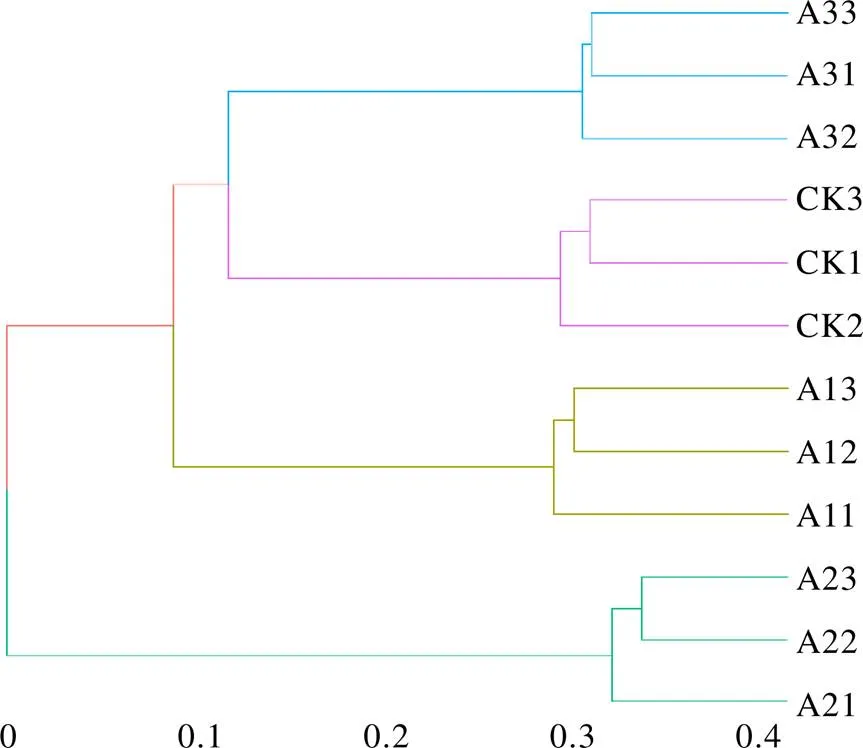
图3 不同处理茶树根际土壤真菌群落的层次聚类分析
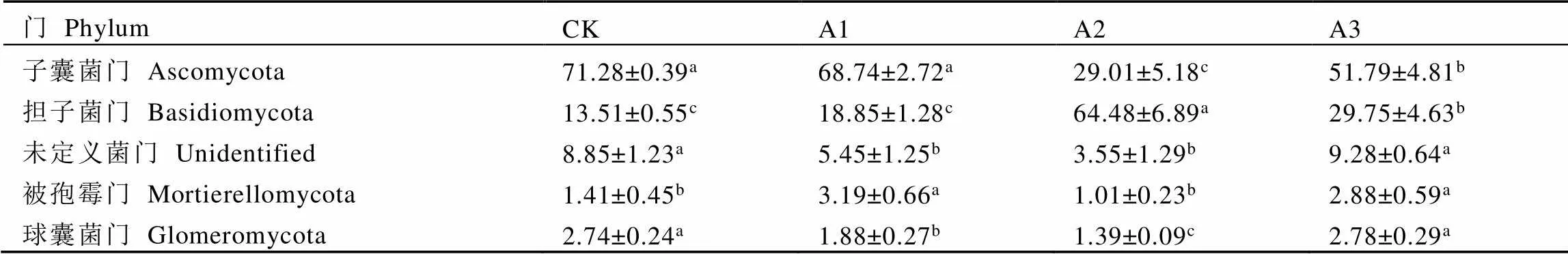
表3 不同处理茶树根际土壤真菌优势菌门相对丰度
注:每行不同字母表示差异达显著水平(<0.05,n=3)
Note: Different letters in each line indicate significant differences (< 0.05, n=3)
2.4.2 基于属水平不同处理茶树根际土壤真菌群落结构
由表4可知,基于属水平上,未定义菌属(unidentified)、古根菌属()、棉革菌属()、角担菌属()和支孢瓶霉属()是套种灵芝茶树根际土壤的优势菌属(前5)。其中,CK、A1和A3土壤中丰度最高的是未定义菌属,相对丰度分别为45.02%、29.70%和53.63%;而A2土壤中棉革菌属丰度最高,相对丰度为55.26%。与CK相比,A1土壤中角担菌属、被孢霉属()、毛孢子菌属()和三形菌属()分别显著上升59.14、1.34、3.70倍和1.92倍(<0.05);A2土壤的古根菌属显著下降76.81%,而棉革菌属和支孢瓶霉属分别显著上升788.43倍和36.24倍(<0.05);A3土壤的被孢霉属和灵芝属()分别显著上升1.09倍和0.81倍(<0.05)。此外,热图结果也表明,不同处理茶树根际土壤真菌群落组成结构发生明显变化(图4)。
2.4.3不同处理茶树根际土壤真菌群落差异物种分析
多级物种差异判别分析(Linear discriminant analysis effect size,LEfSe)可实现多个分组之间的比较,还可在分组内部进行亚组比较分析,从而找到组间在丰度上有显著差异的物种(即生物标志物,Biomaker)(LDA score≥4,<0.05)。由门到属的分类层级可知,部分真菌群落类群富集特征显著。如子囊菌门、被孢霉门和担子菌门分别可作为CK、A1和A2根际土壤真菌群落的生物标志物,而罗兹菌门(Rozellomycota)和未定义菌门在A3土壤中丰度最高(图5)。在CK、A1、A2和A3土壤中分别有10个(1门2纲3目4科)、20个(1门4纲8目7科)、6个(1门1纲2目2科)、16个(2门3纲6目5科)具有统计学差异的生物标志物。
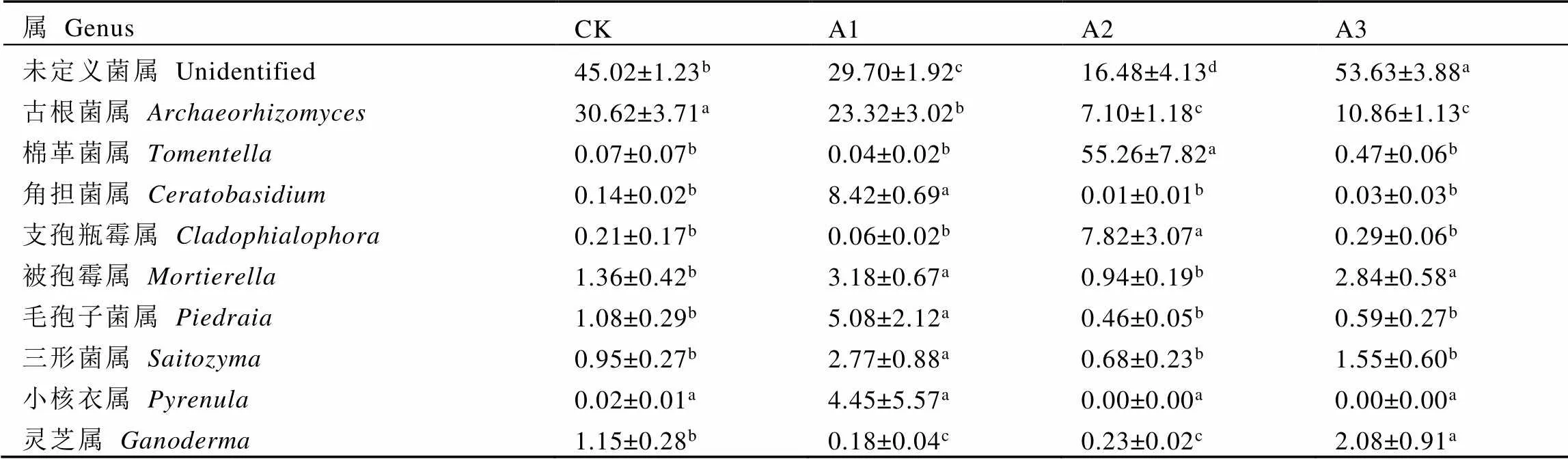
表4 不同处理茶树根际土壤优势真菌相对丰度(属水平)
注:每行不同字母表示差异达显著水平(<0.05,n=3)
Note: Different letters in each line indicate significant differences (< 0.05, n=3)
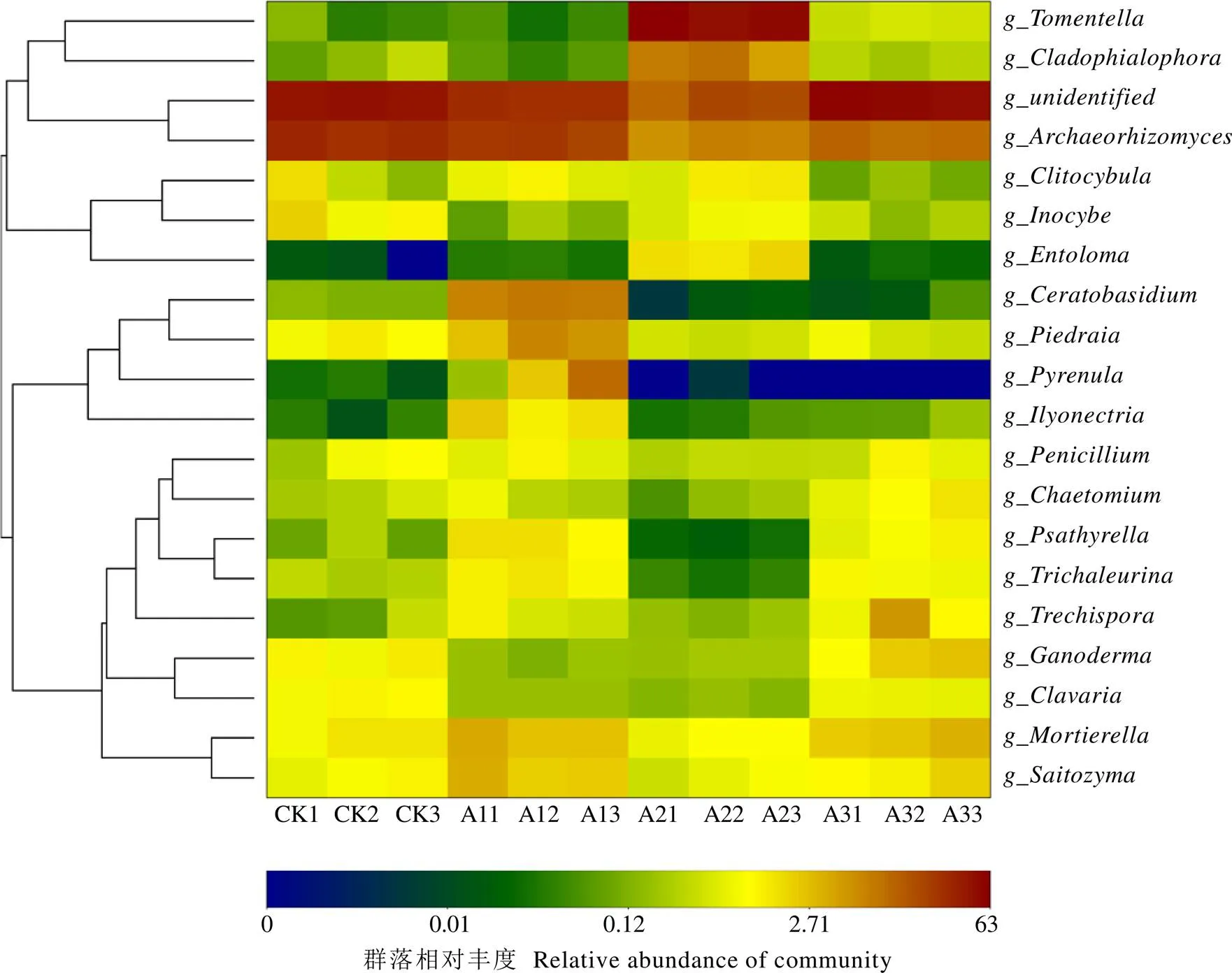
图4 不同处理茶树根际土壤真菌群落热图分析(属水平)
3 讨论
3.1 套种灵芝提高茶树根际土壤肥力
茶树根际土壤理化性质结果表明,套种灵芝的栽培模式提高了茶树根际土壤pH值,即茶园套种灵芝在一定程度上可能会缓解土壤酸化进程;茶树根际土壤碱解氮、速效磷、速效钾及有机碳含量在套种灵芝后显著提高(表1),研究结果与蒋玉兰等[11]和李振武等[14]通过茶园间套作食用菌的结果相似。这可能是因为食用菌采收后的菌棒中仍含有大量菌丝残体,可为土壤提供蛋白质、氨基酸和矿物质等营养成分,进而促进茶树根系吸收营养物质。可见,茶园套种灵芝的生态栽植模式在平衡土壤酸碱度、改善土壤肥力方面具有调节作用。
3.2 套种灵芝改变茶树根际土壤真菌群落多样性
根际土壤微生物多样性是植物生长和土壤健康的重要驱动力,与植物生长、养分循环、病害抑制、污染物降解等土壤生态功能息息相关[15],丰富度和均匀度较高的微生物群落拥有更广泛的生活史策略,可以提高土壤生态系统应对外界负面干扰的抵抗力和恢复力[16]。前人研究表明,合理的间套作可显著提高根际土壤微生物群落多样性及稳定性,改善植物根际微环境进而提高作物产量及品质[17-18]。本研究中,由不同处理茶树根际土壤真菌群落多样性指数可知,套种灵芝后A1和A2的茶树根际土壤真菌群落多样性指数显著降低,而A3土壤中真菌群落多样性指数与CK相比无显著性差异(表2)。傅海平等[19]探究绿肥间作对茶树根际土壤真菌群落多样性的影响,其结果与本研究相似。研究表明,栽植于地表的植被是驱动根际土壤真菌群落多样性变化的主要因素[20]。因此,我们推测茶树套种灵芝后,其根际微域可能形成了“茶—灵芝—土壤”紧密互作的共生网络,进而影响土壤真菌群落结构多样性。此外,本研究采用UPGMA方法对样本进行层次聚类分析,通过树枝结构描述和比较多个样本间的相似性与差异性,分枝长度越短,样本相似度越高[21]。结果表明,套种灵芝的A2茶树根际土壤与CK、A1、A3的真菌群落组成结构差异相对较大(图2和图3)。大量研究证实,根际土壤特性是影响土壤真菌群落结构多样性的关键因素,尤其是土壤pH值[22-23],推测套种灵芝后茶树根际土壤真菌群落结构多样性的差异可能受土壤pH值影响较大。
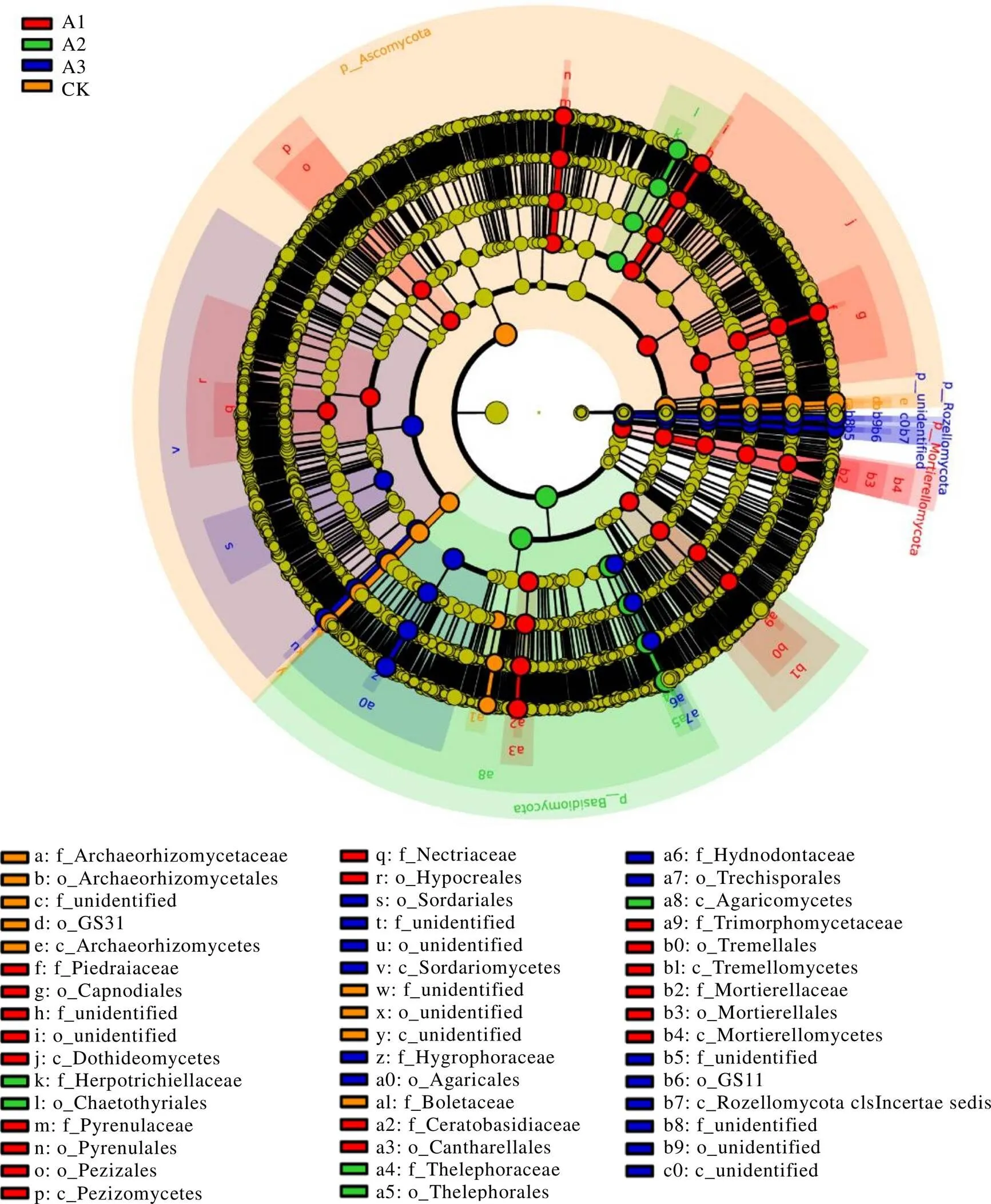
图5 不同处理茶树根际土壤真菌群落LEfSe生物标志物
3.3 套种灵芝改善茶树根际土壤真菌群落结构
根际微生物是土壤生态系统能量流动、物质循环和信息传递的主要驱动者,对维持土壤生产力至关重要[24]。相较于细菌,真菌具有更强的吸收营养物质和降解复杂有机物的能力[25]。研究表明,目前已知98%的土壤生态系统真菌均属于子囊菌门和担子菌门,且属于子囊菌门的真菌数量大于担子菌门[26]。本研究中,土壤真菌门水平分布特征为常见类群比例较高,其中子囊菌门和担子菌门的相对丰度之和达81.54%~93.49%,其余门类仅占6.51%~18.46%。担子菌门大多为腐生菌,可以分解木质素、纤维素等大分子化合物[27]。套种灵芝显著提高了担子菌门的相对丰度。灵芝子实体采收后,将其菌棒覆土归埋的栽培模式为茶树根际土壤提供大量营养源,进而为担子菌门菌群定殖及发展提供了较好的营养物质基础。基于属水平而言,套种灵芝显著提高茶树根际土壤角担菌属、被孢霉属、毛孢子菌属、三形菌属、棉革菌属、支孢瓶霉属和灵芝属的相对丰度,而古根菌属的相对丰度显著降低。有研究表明,被孢霉属具有溶磷性[28]、分解纤维素及木质素[29]、提高土壤酶活性[30]、增加土壤养分含量[31]的潜力。棉革菌属是常见的可与共生植物根系形成外生菌根(Ectomycorrhiza,ECM)的类群,菌根共生体具有提高宿主植物对土壤矿质营养元素的吸收和累积、增强植物抗逆性等特征[32]。可见,灵芝采收后其菌棒覆土回归茶园的栽培模式可富集有益菌加速菌棒降解或形成菌根共生体,有利于茶树土壤养分均衡供给,促进植株生长发育。大量研究证实,套种模式必然会改变土壤温度、光照、水分、孔隙度、养分等一系列土壤环境因子,植物根系分泌物和组织脱落物、凋落物等也会随之改变,对根际微生物的代谢和生长发育产生直接或间接影响,进而对根际微生物种类、数量和分布产生影响[33-34]。因此,推测套种灵芝后茶树根际产生的生态效应对土壤真菌具有一定选择性作用,最终导致茶树真菌群落组成结构产生差异。然而,根际土壤环境因子与微生物的互作对影响土壤微生物群落结构是否具有协同效应仍需进一步研究。
本研究揭示了茶树根际土壤真菌群落多样性及组成结构对灵芝不同套种年限的响应,为恢复茶园生态系统多样性及根际土壤环境质量提供绿色途径。
[1] 李艳姣, 林春桃, 范水生, 等. 福建茶产业发展与供给侧结构性改革互动协调研究[J]. 农业展望, 2021, 17(9): 108-114.Li Y J, Lin C T, Fan S S, et al. Study on the interaction and coordination between tea industry development and supply-side structural reform in Fujian [J]. Agricultural Outlook, 2021, 17(9): 108-114.
[2] 廖万有, 王宏树, 苏有键, 等. 我国茶园土壤的退化问题及其防治[C]//中国茶叶学会. 茶叶科技创新与产业发展学术研讨会论文集, 重庆: [出版者不详], 2009: 185-193. Liao W Y, Wang H S, Su Y J, et al. Soil degeneration and its prevention in Chinese tea gardens [C]//China Tea Science Society. Proceedings of the symposium on technological innovation and industrial development of tea. Chongqing: [s.n.], 2009: 185-193.
[3] 史凡, 黄泓晶, 陈燕婷, 等. 间套作功能植物对茶园生态系统服务功能的影响[J]. 茶叶科学, 2022, 42(2): 151-168. Shi F, Huang H J, Chen Y T, et al. Effects of intercropping functional plants on the ecosystem functions and services in tea garden [J]. Journal of Tea Science, 2022, 42(2): 151-168.
[4] 齐龙波, 周卫军, 郭海彦, 等. 覆盖和间作对亚热带红壤茶园土壤磷营养的影响[J]. 中国生态农业学报, 2008, 16(3): 593-597. Qi L B, Zhou W J, Guo H Y, et al. Phosphorus nutrient characteristics of tea plantation soils under rice-straw mulch and white-clover intercropping in hilly red-soils of South China [J]. Chinese Journal of Eco-Agriculture, 2008, 16(3): 593-597.
[5] 宋莉, 廖万有, 王烨军, 等. 套种绿肥对茶园土壤理化性状的影响[J]. 土壤, 2016, 48(4): 675-679. Song L, Liao W Y, Wang Y J, et al. Effects of interplanting green manure on soil physico-chemical characters in tea plantation [J]. Soils, 2016, 48(4): 675-679.
[6] 沈程文, 肖润林, 徐华勤. 覆盖与间作对亚热带丘陵区茶园土壤微生物量的影响[J]. 水土保持学报, 2006, 20(3): 141-144. Shen C W, Xiao R L, Xu H Q.Effects of cover and intercropping on soil microbial biomass of tea plantations in subtropical hilly region [J]. Journal of Soil and Water Conservation, 2006, 20(3): 141-144.
[7] 徐华勤, 肖润林, 宋同清, 等. 稻草覆盖与间作三叶草对丘陵茶园土壤微生物群落功能的影响[J]. 生物多样性, 2008, 16(2): 166-174. Xu H Q, Xiao R L, Song T Q, et al. Effects of mulching and intercropping on the functional diversity of soil microbial communities in tea plantations [J]. Biodiversity Science, 2008, 16(2): 166-174.
[8] 林黎. 草种组合套种对山地茶园土壤性状及茶叶品质的影响[J]. 茶叶学报, 2017, 58(4): 174-178. Lin L. Physiochemical properties of soil and quality of tea affected by combination inter-cropping in hilly tea plantation [J]. Acta Tea Sinica, 2017, 58(4): 174-178.
[9] Li Y C, Li Z, Li Z W, et al. Variations of rhizosphere bacterial communities in tea (L.) continuous cropping soil by high-throughput pyrosequencing approach [J]. Journal of Applied Microbiology, 2016, 121(3): 787-799.
[10] 黄伟. 浅论食用菌返生态野生栽培[J]. 中国食用菌, 2008, 27(5): 33-34. Huang W. Superficial view on ecological wild cultivation of edible fungi [J].Edible Fungi of China, 2008, 27(5): 33-34.
[11] 蒋玉兰, 张海华, 潘俊娴, 等. 茶树和长根菇间作试验研究[J]. 中国食用菌, 2018, 37(6): 32-35, 39. Jiang Y L, Zhang H H, Pan J X, et al. Experiment study on intercropping of tea trees and[J]. Edible Fungi of China, 2018, 37(6): 32-35, 39.
[12] 李艳春, 林忠宁, 陆烝, 等. 茶园间作灵芝对土壤细菌多样性和群落结构的影响[J]. 福建农业学报, 2019, 34(6): 690-696.Li Y C, Lin Z N, Lu Z, et al. Microbial diversity and structure in soil under tea bushesintercropping [J]. Fujian Journal of Agricultural Sciences, 2019, 34(6): 690-696.
[13] 严丽君, 王普, 施启龙, 等. 动物食性分析在生态学中的应用研究进展——基于DNA宏条形码技术[J]. 生态学报, 2023, 43(8): 3007-3019. Yan L J, Wang P, Shi Q L, et al.Applications of animal diet analysis based on DNA metabarcoding in ecological research [J]. Acta Ecologica Sinica, 2023, 43(8): 3007-3019.
[14] 李振武, 韩海东, 陈敏健, 等. 套种食用菌对茶园土壤和茶树生长的效应[J]. 福建农业学报, 2013, 28(11): 1088-1092. Li Z W, Han H D, Chen M J, et al. Effects of intercroppingon tea garden soil and tea growth [J]. Fujian Journal of Agricultural Sciences, 2013, 28(11): 1088-1092.
[15] Labouyrie M, Ballabio C, Romero F, et al. Patterns in soil microbial diversity across Europe [J]. Nature Communications, 2023, 14(1): 3311. doi: 10.1038/s41467-023-37937-4.
[16] Saleem M, Hu J, Jousset A. More than the sum of its parts: microbiome biodiversity as a driver of plant growth and soil health [J]. Annual Review of Ecology, Evolution, and Systematics, 2019, 50(1): 145-168.
[17] 赵佳佳, 李季, 杜相革. 不同生产模式对土壤微生物种群数量的影响[J]. 华北农学报, 2011, 26(s1): 220-224. Zhao J J, Li J, Du X G. Dynamics of soil microbial community in the experiment of organic, green and conventional vegetable production systems [J]. Acta Agriculturae Boreali-Sinica, 2011, 26(s1): 220-224.
[18] 林雁冰, 薛泉宏, 颜霞. 不同栽培模式下玉米根系对土壤微生物区系的影响[J]. 西北农林科技大学学报(自然科学版), 2008, 36(12): 101-107. Lin Y B, Xue Q H, Yan X. Effects of the maize root on soil microbial flora under different cultivation patterns [J]. Journal of Northwest A&F University (Natural Science Edition), 2008, 36(12): 101-107.
[19] 傅海平, 周品谦, 王沅江, 等. 绿肥间作对茶树根际土壤真菌群落的影响[J]. 茶叶通讯, 2020, 47(3): 406-415. Fu H P, Zhou P Q, Wang Y J, et al. Effects of intercropping different green manures on fungal community characteristics in rhizosphere soil of tea plant [J]. Journal of Tea Communication, 2020, 47(3): 406-415.
[20] Christopher W S, Anna R. Comment on “global diversity and geography of soil fungi” [J]. Science, 2015, 348(6242): 1438-1438.
[21] Wei Z, Yu D. Analysis of the succession of structure of the bacteria community in soil from long-term continuous cotton cropping in Xinjiang using high-throughput sequencing [J]. Archives of Microbiology, 2018, 200(4): 653-662.
[22] Zhang T, Wang N F, Liu H Y, et al. Soil pH is a key determinant of soil fungal community composition in the Ny-Ålesund region, Svalbard (High Arctic) [J].Frontiers in Microbiology, 2016, 7: 227. doi: 10.3389/fmicb.2016.00227.
[23] Lauber C L, Strickland M S, Bradford M A, et al. The influence of soil properties on the structure of bacterial and fungal communities across land-use types [J]. Soil Biology and Biochemistry, 2008, 40(9): 2407-2415.
[24] Prakash J, Mishra S. Role of beneficial soil microbes in alleviating climatic stresses in plants [M]//Kumar A, Singh J, Ferreira L F R. Microbiome under changing climate: implications and solutions. Cambridge:Woodhead Publishing, 2022: 29-68.
[25] Peroh D. Plant-associated fungal communities in the light of meta'omics [J]. Fungal Diversity, 2015, 75: 1-25.
[26] Wang H Y, Guo S Y, Huang M R, et al. Ascomycota has a faster evolutionary rate and higher species diversity than Basidiomycota [J]. Science China life Sciences, 2010, 53(10): 1163-1169.
[27] Lynch M D J, Thorn R G. Diversity of Basidiomycetes in Michigan agricultural soils [J].Applied and Environmental Microbiology, 2006, 72(11): 7050-7056.
[28] Osorio N W, Habte M. Soil phosphate desorption induced by a phosphate-solubilizing fungus [J]. Communications in Soil Science & Plant Analysis, 2014, 45(4): 451-460.
[29] 陈力力, 刘金, 李梦丹, 等. 水稻-油菜双序列复种免耕、翻耕土壤真菌多样性[J].激光生物学报, 2018, 27(1): 60-68, 59. Chen L L, Liu J, Li M D, et al.Diversity of filamentous fungus community in paddy fields with different tillage methods [J]. Acta Laser Biology Sinca, 2018, 27(1): 60-68, 59.
[30] Zhang H, Wu X, Li G, et al. Interactions between arbuscular mycorrhizal fungi and phosphate-solubilizing fungus (sp.) and their effects ongrowth and enzyme activities of rhizosphere and bulk soils at different salinities [J]. Biology and Fertility of Soils, 2011, 47(5): 543-554.
[31] Li F, Chen L, Redmile-Gordon M, et al.roles in organic agriculture and crop growth promotion in a mineral soil [J]. Land Degradation and Development, 2018, 29(6): 1642-1651.
[32] 林双双, 孙向伟, 王晓娟, 等. 我国菌根学研究进展及其应用展望[J]. 草业学报, 2013, 22(5): 310-325. Lin S S, Sun X W, Wang X J, et al. Mycorrhizal studies and their application prospects in China [J]. Acta Prataculturae Sinica, 2013, 22(5): 310-325.
[33] Li S M, Fan W, Xu G, et al. Bio-organic fertilizers improvegrowth by remolding the soil microbiome and metabolome [J]. Frontiers in Microbiology, 2023, 14: 1117355. doi: 10.3389/fmicb.2023.1117355.
[34] Zhou X G, Zhang J Y, Rahman M K U, et al. Interspecific plant interaction via root exudates structures the disease suppressiveness of rhizosphere microbiomes [J]. Molecular Plant, 2023, 16(5): 849-864.
The Characteristics of Fungal Community Structure in Tea Rhizosphere Soil Interplanted withBased on High-throughput Sequencing Technology
HAN Haidong, ZHOU Liuting*, HUANG Xiaoyun, YU Chengran, HUANG Xiusheng*
Agricultural Ecology Institute, Fujian Academy of Agricultural Sciences. Fujian Engineering and Technology Research Center for Recycling Agriculture, Fuzhou 350013, China
The tea plantation withis an ecological cycle intercropping model of resource utilization of tea processing waste, and the composite community formed can cover the ground more thoroughly and play an important role in improving the soil microbial community structure and maintaining the balance of soil microbiological system. In this study, we investigated the changes of tea rhizosphere soil fungal community structure in uncropped (CK), intercropping 1 year (A1), intercropping 2 years (A2) and intercropping 3 years (A3) using Miseq PE300 high-throughput sequencing technology. The results show that: (1) compared with CK, interplantingsignificantly increased the contents of available nitrogen, available phosphorus, available potassium and organic carbon in tea rhizosphere soil, with soil of A3 having the highest increase, reaching 32.36%, 13.01%, 69.21% and 9.56%, respectively. (2) Thediversity index shows that the observed species and Chao1 index of tea rhizosphere soil fungal community were CK>A3>A1>A2. ACE index, Shannon index and Simpson index showed A3>CK>A1>A2. (3) Thediversity index shows that the composition and structure of fungal community in tea rhizosphere soil of A2 were relatively different from those of CK, A1 and A3. (4) Through taxonomic analysis, it is found that tea rhizosphere soil fungi were distributed in 18 phyla, 48 classes, 135 orders, 309 families and 632 genera. At phylum level, Ascomycota was the dominant phylum of CK, A1 and A3, with relative abundances of 71.28%, 68.74% and 51.79%, respectively. Basidiomycota was the dominant phylum of A2 with a relative abundance of 64.48%. At the genus level, compared with CK, the contents of,,andin A1 were significantly increased by 59.14, 1.34, 3.70 and 1.92 times, respectively (<0.05). The relative abundance ofin A2 decreased significantly by 76.81%, while that ofandincreased by 788.43 and 36.24 times, respectively (<0.05). Theandin A3 soil significantly increased 1.09 and 0.81 times, respectively (<0.05). In summary, the interplantingin tea gardens can effectively regulate the composition and structure of tea rhizosphere soil fungal community, improve the soil micro-ecological environment and this study provided a theoretical basis for the technical model to promote the sustainable green development of tea plantation.
tea plantation, intercropping, rhizosphere soil, fungal community structure
S571.1;S154.3
A
1000-369X(2023)04-513-12
2023-05-24
2023-07-10
福建省公益类科研院所专项(2020R1021004、2020R1021002、2023R1019002)、福建省人民政府-中国农业科学院“5511”协同创新工程(XTCXGC2021010)、福建省农业科学院项目(CXTD2021009-1)
韩海东,男,副研究员,主要从事生态循环农业与山地茶园有机种植研究。*通信作者:zlt0616@126.com;hxs706@163.com

