运动和白藜芦醇预处理对脑缺血再灌注大鼠脑损伤及内质网应激的影响
郭静洁,张引红
1.山西传媒学院,山西 030619;2.山西医科大学
缺血性脑卒中是世界范围内引起行动障碍和运动障碍的主要原因之一,通过药物干预或器械取栓快速恢复脑血流是缺血性脑卒中的首选治疗方法[1]。然而,尽管再灌注可恢复脑组织所必需的营养和氧气,但灌注区不可避免地会造成血脑屏障通透性增加及脑水肿的发生和大量细胞死亡及组织破坏,称为脑缺血再灌注(cerebral ischemia-reperfusion,CI/R)损伤,其常引起迟发性神经元损伤,严重影响病人的日常活动和预后,给社会和家庭带来了沉重的经济压力[2]。因此,有必要进一步探索其潜在的病理机制,研究新的干预措施。
研究认为,CI/R 损伤和复杂的病理过程与多种不同的机制有关,包括氧化应激、细胞内钙超载、炎症和细胞凋亡等[3]。最近的证据表明,内质网应激是CI/R损伤进展的关键决定因素[4]。在一些病理状态下,严重且持续的内质网应激可能导致细胞凋亡信号通路中必需分子CAAT 区/增强子结合蛋白同源蛋白(C/EBP homologous protein,CHOP)转录增加,进而触发细胞凋亡,从而加剧病理过程,最终导致神经元死亡[5]。缺血预处理作为一种有效的脑缺血保护策略,已备受学者广泛关注。而在众多的预防措施中,运动预处理被认为是一种临床可操作的、成本较低且易于被病人接受的有效预防缺血性脑卒中的方法,被证明可有效诱导缺血耐受性,减轻脑损伤,从而发挥神经保护作用[6]。动物实验研究发现,运动预处理可通过降低谷氨酸兴奋性毒性、抑制神经炎症及细胞凋亡,改善大鼠CI/R 后的神经功能缺损[7]。白藜芦醇是一种多酚,在多种植物中大量表达,具有保护心脏、抗癌、抗炎和神经保护作用。Lei 等[8]研究发现,白藜芦醇(100 mg/kg)预处理可降低CI/R 炎症反应、改善神经功能缺损评分、减少大鼠脑梗死体积及脑水肿含量,提示白藜芦醇可能是一种很有前途的神经保护剂。逯冉冉等[9]研究发现,CI/R 前30 min 灌服白藜芦醇可以缩小脑梗死体积,对CI/R 损伤具有神经保护作用。然而对CI/R 大鼠的神经保护作用机制尚不明确;并且运动联合白藜芦醇是否对CI/R 大鼠的脑神经损害具有更有效的保护效应,目前尚缺乏充足的研究。因此,本研究对CI/R大鼠分别进行4 周有氧跑台运动或白藜芦醇干预以及有氧运动联合白藜芦醇干预,通过测量CI/R 大鼠脑梗死体积、脑水肿含量及缺血再灌注区神经凋亡细胞的变化和脑组织内质网应激相关蛋白表达的变化,从分子学角度进一步探讨运动和白藜芦醇预处理对CI/R大鼠脑损伤保护的可能机制。
1 材料与方法
1.1 实验动物
无特定病原体(SPF)级6~7 周龄(体质量210~230 g)雄性SD 大鼠114 只,被饲养在标准实验室环境中。适应实验室环境1 周后,将114 只大鼠随机分为假手术组(n=22)、CI/R 模型组(n=22)、CI/R 运动组(n=23)、CI/R 白藜芦醇组(n=23)、CI/R 白藜芦醇+运动组(n=23)。实验中所有大鼠均按照《实验动物护理和使用指南》的原则进行。
1.2 主要试剂与仪器
原位末端转移酶标记技术(TUNEL)染色试剂盒(批号:KGA7045);葡萄糖调节蛋白78(glucoseregulated protein78,GRP78)一抗(批号:12G34)、CHOP 一抗(批号:B0S5476BP2307)、β-actin 一抗(批号:B2801)、HRP标记山羊抗兔IgG(批号:B0201),均购于武汉博士德生物工程有限公司;白藜芦醇购于上海阿拉丁试剂公司(批号P109978);酶标仪(型号:RT-6000)购自深圳Rayto 公司;凝胶成像仪(型号:Tanon 4600)购自北京原平皓生物技术有限公司;电子天平(型号:FA1004)购自上海舜宇恒科技仪器有限公司;动物跑台(型号:FT-200),购自成都泰盟科技有限公司。
1.3 实验方法
1.3.1 跑台运动预干预[10]
正式跑台训练前,CI/R 运动组及CI/R 白藜芦醇+运动组大鼠以5~7 m/min 的速度进行2 d、每天30 min 的适应性训练。正式训练时,第1 周大鼠跑台速度18 m/min(坡度为0o),每天持续运动35 min;第2周跑台速度18 m/min(坡度为5o),每天持续运动40 min;第3 周跑台速度18 m/min(坡度为5o),每天持续运动45 min;第4 周跑台速度18 m/min(坡度为5o),每天持续运动50 min;每周均运动5 d,连续运动4 周。
1.3.2 白藜芦醇给药方法
依据药理学方法,将白藜芦醇充分溶于双蒸水中制成(6 mg/mL)悬浊液,对CI/R 白藜芦醇组及CI/R白藜芦醇+运动组进行称重后每天早上08:00 灌胃白藜芦醇40 mg/kg,CI/R 模型组大鼠给予同体积的双蒸水灌胃。连续灌胃4 周,每周7 d[11]。
1.4 CI/R 模型制备
跑台运动及灌服白藜芦醇4 周后,采用大脑中动脉(MCAO)闭塞(90 min)再灌注法(24 h)诱导大鼠CI/R 模型[12]。假手术组大鼠不进行MCAO 缺血再灌注。
1.5 神经功能评分
再灌注24 h 后对所有大鼠的神经功能缺损进行评估。无神经功能缺损计0 分;提尾时大鼠不能完全伸展左前爪计1 分;大鼠行走时向左侧转圈计2 分;行走困难,行走时向左侧转圈、倾倒计3 分;大鼠不能自发行走和/或失去意识计4 分。本研究共排除6 只大鼠,其中CI/R 模型组死亡1 只大鼠及CI/R 白藜芦醇+运动组大鼠死亡2 只大鼠,CI/R 模型组1 只大鼠评分为4分、CI/R 运动组及CI/R 白藜芦醇组各有1 只大鼠神经功能评分为0 分。
1.6 神经细胞凋亡观察
神经功能评分结束后,各组随机取5 只大鼠,常规灌注后取脑,梯度乙醇脱水、二甲苯透明后石蜡包埋,连续切片(4 μm),用于TUNEL 染色。
1.7 脑梗死体积的测量
神经功能评分结束后,每组随机取5 只大鼠,麻醉后立即取脑,冠状切片用2,3,5-三苯基氯化四氮唑(TTC)法染色并计算大鼠的脑梗死体积。
1.8 脑组织含水量的测定
采用干湿法测量大鼠脑组织含水量。神经功能评分后,取每组6 只大鼠断头取脑,分离出右侧大脑。冰生理盐水冲洗右侧脑组织,滤纸粘吸脑组织表面的水及血迹后用电子分析天平称缺血半球的湿重(右),置于110 °C 烤箱中孵育24 h 后立即称干重。脑组织含水量=(湿重-干重)/湿重×100%。
1.9 蛋白免疫印迹法(Western Blot)检测脑组织内质网应激相关蛋白
将每组剩余大鼠取缺血区脑组织50 mg,用Western Blot 法检测大鼠脑组织GRP78 及CHOP 蛋白表达。
1.10 统计学处理
用SPSS Statistics 21.0 软件进行数据分析与统计,所有数据均用均数±标准差(±s)表示,各组间数据比较采用单因素方差分析,组间差异比较采用最小显著差异法(LSD)法,以P<0.05 表示差异有统计学意义。
2 结果
2.1 各组大鼠神经功能评分比较
脑缺血再灌注24 h,与假手术组比较,CI/R 模型组大鼠神经功能评分提高(P<0.05);与CI/R 模型组比较,CI/R 运动组、CI/R 白藜芦醇组及CI/R 白藜芦醇+运动组大鼠神经功能评分均降低(P<0.05);与CI/R 运动组及CI/R 白藜芦醇组比较,CI/R 白藜芦醇+运动组大鼠神经功能评分降低(P<0.05),而CI/R运动组及CI/R 白藜芦醇组脑缺血再灌注24 h 神经功能评分差异无统计学意义(P>0.05)。详见表1。
表1 各组大鼠神经功能评分比较(±s)单位:分
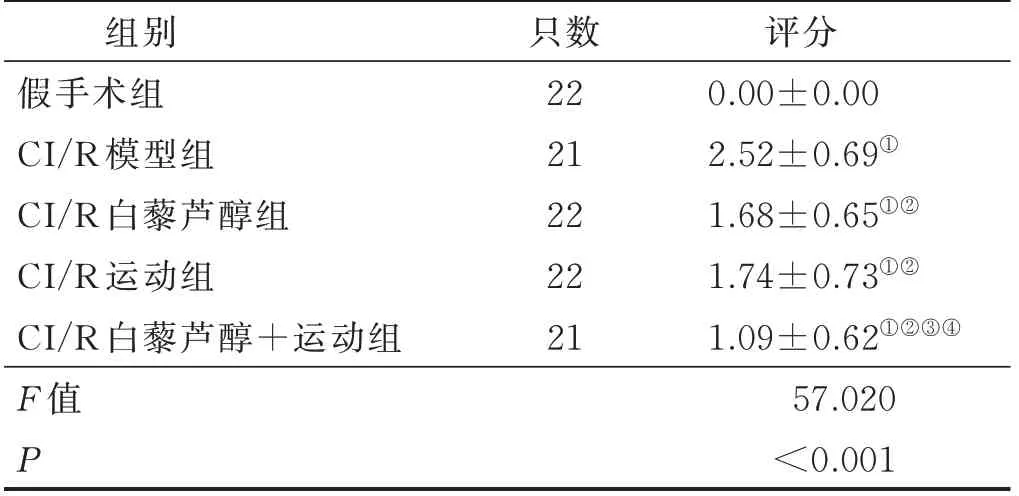
表1 各组大鼠神经功能评分比较(±s)单位:分
注:与假手术组比较,① P<0.05;与CI/R 模型组比较,②P<0.05;与CI/R 白藜芦醇组比较,③ P<0.05;与CI/R运动组比较,④ P<0.05。
组别假手术组CI/R 模型组CI/R 白藜芦醇组CI/R 运动组CI/R 白藜芦醇+运动组F 值P评分0.00±0.00 2.52±0.69①1.68±0.65①②1.74±0.73①②1.09±0.62①②③④57.020<0.001只数22 21 22 22 21
2.2 各组大鼠脑梗死体积比较
脑缺血再灌注24 h,与假手术组比较,CI/R 模型组大鼠脑梗死体积增加(P<0.05);与CI/R 模型组比较,CI/R 运动组、CI/R 白藜芦醇组及CI/R 白藜芦醇+运动组大鼠脑梗死体积均降低(P<0.05);与CI/R运动组及CI/R 白藜芦醇组比较,CI/R 白藜芦醇+运动组大鼠脑梗死体积降低(P<0.05),而CI/R 运动组及CI/R 白藜芦醇组脑梗死体积差异无统计学意义(P>0.05)。详见表2。
表2 各组大鼠脑梗死体积比较(±s)单位:%
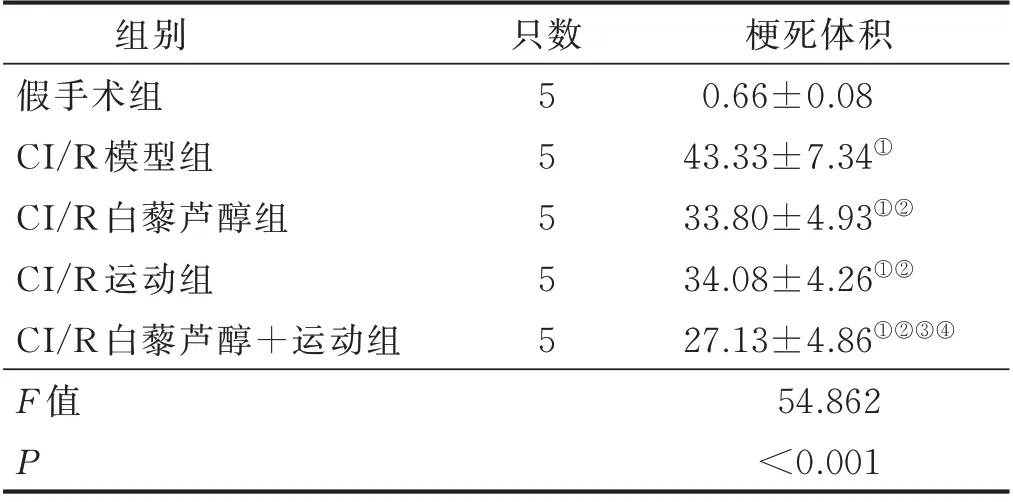
表2 各组大鼠脑梗死体积比较(±s)单位:%
注:与假手术组比较,① P<0.05;与CI/R 模型组比较,②P<0.05;与CI/R 白藜芦醇组比较,③ P<0.05;与CI/R运动组比较,④ P<0.05。
组别假手术组CI/R 模型组CI/R 白藜芦醇组CI/R 运动组CI/R 白藜芦醇+运动组F 值P梗死体积0.66±0.08 43.33±7.34①33.80±4.93①②34.08±4.26①②27.13±4.86①②③④54.862<0.001只数55555
2.3 各组大鼠缺血侧大脑半球脑组织含水量比较
脑缺血再灌注24 h,与假手术组比较,CI/R 模型组大鼠脑组织含水量明显增加(P<0.05);与CI/R 模型组比较,CI/R 运动组、CI/R 白藜芦醇组大鼠脑组织含水量差异无统计学意义(P>0.05),CI/R 白藜芦醇+运动组大鼠脑组织含水量下降(P<0.05);CI/R运动组、CI/R 白藜芦醇组及CI/R 白藜芦醇+运动组组间大鼠脑组织含水量比较差异无统计学意义(P>0.05)。详见表3。
表3 各组大鼠缺血侧大脑半球脑组织含水量比较(±s)单位:%

表3 各组大鼠缺血侧大脑半球脑组织含水量比较(±s)单位:%
注:与假手术组比较,① P<0.05;与CI/R 模型组比较,② P<0.05。
组别假手术组CI/R 模型组CI/R 白藜芦醇组CI/R 运动组CI/R 白藜芦醇+运动组脑组织含水量76.47±5.86 82.77±4.30①79.65±3.94 80.16±2.36 77.65±3.53②只数66666
2.4 各组大鼠缺血半暗带区神经元凋亡细胞计数比较
与假手术组比较,CI/R 模型组大鼠神经元中凋亡细胞增加(P<0.05)。与CI/R 模型组比较,CI/R 运动组、CI/R 白藜芦醇组及CI/R 白藜芦醇+运动组大鼠神经元中凋亡细胞减少(P<0.05);与CI/R 运动组及CI/R 白藜芦醇组比较,CI/R 白藜芦醇+运动组大鼠神经元中凋亡细胞减少(P<0.05),CI/R 运动组及CI/R白藜芦醇组神经元中凋亡细胞计数比较,差异无统计学意义(P>0.05)。详见表4。
表4 各组大鼠缺血半暗带神经元阳性细胞计数结果比较(±s)
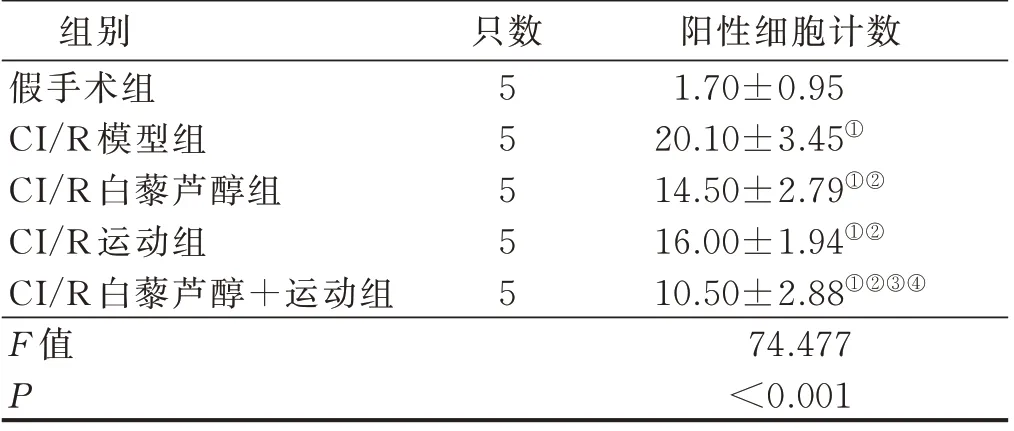
表4 各组大鼠缺血半暗带神经元阳性细胞计数结果比较(±s)
注:与假手术组比较,① P<0.05;与CI/R 模型组比较,②P<0.05;与CI/R 白藜芦醇组比较,③ P<0.05;与CI/R运动组比较,④ P<0.05。
组别假手术组CI/R 模型组CI/R 白藜芦醇组CI/R 运动组CI/R 白藜芦醇+运动组F 值P阳性细胞计数1.70±0.95 20.10±3.45①14.50±2.79①②16.00±1.94①②10.50±2.88①②③④74.477<0.001只数55555
2.5 各组大鼠脑组织GRP78 及CHOP 蛋白表达比较
与假手术组比较,CI/R 模型组大鼠脑组织GRP78 及CHOP 蛋白表达量增加(P<0.05);与CI/R模型组比较,CI/R 运动组、CI/R 白藜芦醇组及CI/R白藜芦醇+运动组大鼠脑组织GRP78 蛋白表达量进一步增加(P<0.05),CHOP 蛋白表达量减少(P<0.05)。与CI/R 运动组及CI/R 白藜芦醇组比较,CI/R白藜芦醇+运动组大鼠脑组织GRP78 蛋白表达量增加(P<0.05),CHOP 蛋白表达量减少(P<0.05);而CI/R 运动组及CI/R 白藜芦醇组大鼠脑组织GRP78及CHOP 蛋白表达比较差异无统计学意义(P>0.05)。详见表5。
表5 各组大鼠脑组织GRP78 及CHOP 蛋白表达结果(±s)
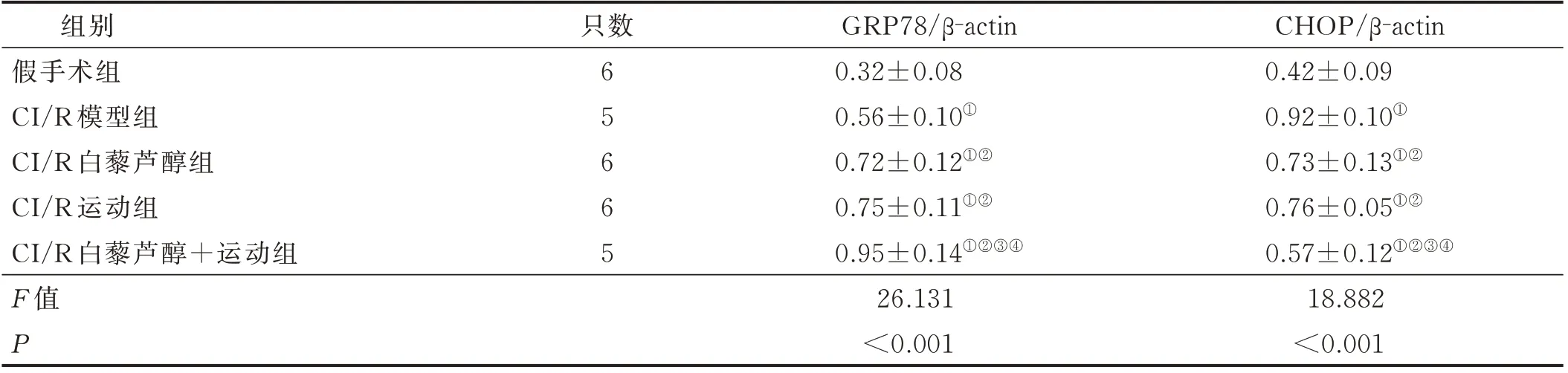
表5 各组大鼠脑组织GRP78 及CHOP 蛋白表达结果(±s)
注:与假手术组比较,① P<0.05;与CI/R 模型组比较,② P<0.05;与CI/R 白藜芦醇组比较,③ P<0.05;与CI/R 运动组比较,④ P<0.05。
组别假手术组CI/R 模型组CI/R 白藜芦醇组CI/R 运动组CI/R 白藜芦醇+运动组F 值P CHOP/β-actin 0.42±0.09 0.92±0.10①0.73±0.13①②0.76±0.05①②0.57±0.12①②③④18.882<0.001只数65665 GRP78/β-actin 0.32±0.08 0.56±0.10①0.72±0.12①②0.75±0.11①②0.95±0.14①②③④26.131<0.001
3 讨论
3.1 运动和白藜芦醇对CI/R 大鼠脑组织损伤的影响
缺血性脑卒中是致命性疾病之一,具有快速起病、高死亡率和高致残率的特点,严重威胁病人的健康和生命,并导致病人生活质量明显下降。恢复缺血半暗带血流是目前治疗该病的主要策略,可恢复脑供氧,清除有害代谢物,然而在某些情况下,再灌注本身会引发细胞死亡过程,导致脑出血和脑水肿,诱发更严重的脑损伤[13]。研究认为,CI/R 是影响缺血性卒中的重要病理生理过程,可导致脑梗死体积增加及对侧肢体运动及感觉功能障碍或伴意识丧失[14]。多数学者通过动物实验证实,CI/R 可使大鼠出现脑缺血病变,血脑屏障破坏严重,脑水肿明显增加,而脑水肿是导致神经细胞死亡和脑损伤发展的重要因素之一[14]。MCAO 是一种经典的、被广泛接受的缺血性脑血管病动物模型,因此本研究采用结扎MCAO 90 min、再灌注24 h 的方法制备大鼠CI/R 模型。研究结果显示,大鼠再灌注后24 h 出现明显的神经功能缺损及脑梗死体积、脑含水量均明显增加,提示本研究建立的大鼠局灶性脑缺血再灌注模型是成功的。近来研究发现,缺血预处理可对大脑产生显著的神经保护作用,有效减轻CI/R 损伤,改善病人预后[15]。本研究分别给予CI/R 大鼠4 周递增强度跑台运动和白藜芦醇灌胃给药干预,结果发现,单独运动、单独灌服白藜芦醇及联合干预均可显著降低CI/R 大鼠脑梗死体积,且神经运动障碍明显改善;并且单独运动及单独灌服白藜芦醇在改善CI/R 大鼠的脑神经保护方面具有相同的益处,而运动与白藜芦醇共同干预的预处理方式对CI/R 引起的脑损伤和运动功能障碍的神经保护作用方面优于单纯运动和单纯灌服白藜芦醇,且只有联合干预使CI/R 大鼠脑含水量显著降低,但具体机制尚不清楚。
3.2 运动和白藜芦醇对CI/R 大鼠脑组织GRP78 及CHOP 蛋白表达的影响
研究认为,内质网应激是CI/R 损伤的发病机制之一,而抑制内质网应激可作为治疗CI/R 损伤的有效策略[16]。GRP78 是热休克蛋白70 家族成员,位于内质网。在内质网应激信号通路中,GRP78 表达上调是内质网应激激活的标志,其高表达可减少内质网内未折叠蛋白聚集,并且GRP78 的激活已经被证明可以改善内质网应激损伤及保护神经元免受损害[17]。CHOP 是一种多功能转录因子,在内质网应激诱导的细胞凋亡中起核心作用。黄澈等[18]观察到大鼠MCAO 闭塞恢复血流3 h 模型组大鼠GRP78 的表达迅速升高,至12 h达到高峰,之后逐渐下降,但仍高于假手术组;而CHOP 表达逐渐增加,至24 h 达到高峰,表明CI/R 后引起的内质网应激首先是减少内质网应激损伤,但后期由于应激时间过长导致细胞由抗凋亡向促凋亡转换,加重细胞死亡。本研究的观察时间点为CI/R 后24 h,与假手术组比较,CI/R 大鼠缺血再灌注区GRP78 及CHOP 表达均增高,TUNEL 染色显示神经凋亡细胞增多,说明CI/R 导致了内质网应激的启动,并启动了由内质网应激所介导的细胞凋亡通路。同时本研究还发现CI/R 大鼠脑梗死体积、脑组织含水量及神经功能评分均显著增加,说明CI/R 可能通过增强内质网应激促凋亡蛋白CHOP 的表达从而加重了CI/R损伤。因此,可以认为,本研究CI/R 大鼠脑损伤可能与脑细胞内质网应激相关因子GRP78、CHOP 的表达水平上调诱导神经细胞凋亡有关,具体机制需进一步研究。
研究认为,缺血前预处理可通过降低内质网应激及细胞凋亡对CI/R 大鼠起到脑保护作用。白藜芦醇是一种天然的多酚(化学名称为3,4,5-三羟基二苯乙烯),在虎杖、葡萄、黎芦、决明、花生等植物中含量较为丰富[19]。越来越多的研究表明,白藜芦醇可能通过其抗氧化、抗炎、抗凋亡及抗内质网应激等特性在人类健康中发挥潜在的治疗作用[20]。有研究发现,白藜芦醇预干预(缺血前7 d 腹腔注射)可通过增强CI/R 大鼠前额叶皮质GRP78 蛋白的表达恢复内质网稳态,减少脑含水量及脑梗死体积从而发挥神经保护作用[21]。在本研究中,对CI/R 大鼠进行为期4 周的白藜芦醇预处理,结果显示其脑缺血再灌注区GRP78 显著增加,CHOP 表达水平下降,并且TUNEL 染色显示,白藜芦醇组大鼠凋亡细胞显著减少,与前期学者研究结果一致。
与其他预处理方法比较,运动预处理操作简单,更容易被病人接受;并且运动预处理可通过多途径、多靶点包括调节炎症反应、氧化应激、抑制凋亡及促进神经发生等保护CI/R 导致的脑损伤[6]。有学者研究发现,4 周跑台运动预干预(60 min/d,每周5 d)对CI/R 引起的脑水肿和运动障碍有神经保护作用,被认为是预防脑缺血性损伤的一种有用的策略[7]。本研究结果显示,CI/R 运动组大鼠脑缺血再灌注区GRP78 及CHOP 表达水平及凋亡细胞变化趋势与白藜芦醇组一致,说明白藜芦醇及运动预处理均可进一步上调GRP78 蛋白的表达,下调CHOP 蛋白的表达,说明两者均可促进CI/R 大鼠内质网结构和功能的恢复,减轻神经细胞损伤。
近年来,人们热衷于将运动与白藜芦醇联合起来研究二者的协同效应。Broderick 等[22]研究发现,白藜芦醇、跑台运动及联合干预均可通过抑制神经元自噬、减少细胞凋亡和上调突触相关蛋白的表达对老年痴呆大鼠产生神经保护作用,但联合干预效果更好。本研究也发现,跑台运动与白藜芦醇共同干预,比单纯运动、单纯白藜芦醇给药能更进一步增强CI/R 大鼠缺血半暗带区GRP78 的表达,CHOP 表达及神经细胞凋亡率下降幅度更大,说明联合预干预更能有效抑制CI/R大鼠内质网应激及细胞凋亡,出现功效叠加效应,与上述学者研究结果一致。因此,本研究4 周跑台运动和白藜芦醇均能降低CI/R 大鼠脑梗死体积及神经功能评分,两者联合干预较单一干预效果更为显著,且只有联合干预降低了CI/R 大鼠脑水肿,其机制可能是运动和白藜芦醇促进细胞未折叠及错误折叠蛋白的正确组装,抑制内质网应激,同时减少细胞凋亡,但内质网应激诱导凋亡的具体调控通路尚需进一步深入研究。

