基于网络药理学和分子对接技术探讨沙棘活性成分对非酒精性脂肪肝作用机制
高 健,吴胜男,王晓静,纪景馨,张 然,程景民*
1.山西医科大学管理学院,山西 030001;2.山西医科大学公共卫生学院
非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)包括脂肪变性、脂肪肝炎(non-alcoholic steatohepatitis,NASH)、肝纤维化,最终导致肝硬化及肝细胞癌症的广泛性系列疾病[1]。据流行病学调查数据显示,全球成人非酒精性脂肪肝病的患病率高达23%~25%,其中20%非酒精性脂肪肝病病人受脂肪肝炎的影响[2]。现阶段,在“二次打击”学说不断发展的基础上,针对除脂肪变性、氧化应激以外的胰岛素抵抗、线粒体功能紊乱、脂质毒性等多重平行打击在致病机制方面表明,非酒精性脂肪肝病为多种危险因素的相互作用导致[3-4]。考虑到非酒精性脂肪肝病受基因遗传、表观遗传和环境暴露等诸多复杂因素的相互影响,除使用非针对性药物治疗或接受身体运动的建议以外[5],现阶段提出的“营养遗传学”和“营养表型基因组学”,通过研究饮食暴露与基因组的相互作用,改善临床与健康营养实践[5]。同时,植物提取物的多种活性成分、多种药理作用在非酒精性脂肪肝病实验模型中展现潜在多靶向效应[3]。于是,膳食管理和植物营养干预非酒精性脂肪肝病应运而生。沙棘果、沙棘叶和沙棘籽包含多糖、多酚和氨基酸等活性物质种类丰富,药理作用明显[6-8]。沙棘叶和沙棘果的提取物抑制糖基化终产物的形成[9],沙棘油富含的山柰酚可减弱细胞的氧化应激和脂质积累[10],沙棘汁在抑制炎症和预防代谢性综合征、神经退行性疾病中发挥重要作用[8]。
随着非酒精性脂肪肝病和沙棘相关研究的不断深入,单靶点-单成分的研究模式已无法完全解释其治疗作用。本研究通过构建多成分-多靶点-多信号通路的关联网络探究沙棘对非酒精性脂肪肝病的综合干预方式,对非酒精性脂肪肝病的发病、进展以及沙棘活性成分干预机制有着重要意义,为后续进一步探索沙棘治疗非酒精性脂肪肝病相关作用机制提供理论依据。
1 资料与方法
1.1 沙棘成分的获取
在TCMSP数据库(https://old.tcmsp-e.com/tcmsp.php)检索沙棘主要成分并转化为相关干预的蛋白质,同时剔除未检索到靶点蛋白的成分。参考Uniprot 数据库(https://www.uniprot.org/)规范蛋白质名称后将其转化为基因名称(gene symbol)。考虑检索到的沙棘成分以及成分对应靶点数目较少,且沙棘作为食品可直接食用,故暂不考虑使用常用参数药物相似度(DL)、口服生物利用度(OB)等对其进行过滤筛除。
1.2 非酒精性脂肪肝差异表达基因的筛选
在GEO 数据库(https://www.ncbi.nlm.nih.gov/geo/)中选择表达谱GSE126848 高通量测序数据集做差异表达分析。将数据矩阵中“健康人群(healthy normal weight)”和“健康肥胖(obese)”作为对照组,“单纯性脂肪变性(NAFL)”和“非酒精性脂肪性肝炎”作为试验组。对照组与试验组的测序数据统一为基因名称(gene symbol)后,使用R(4.1.3)“limma”包以P<0.05、|LogFC|≥1 为临界阈值筛选差异基因并绘制火山图。其中,数据集中体重正常和肥胖受试者显示正常的肝脏组织学。
1.3 沙棘影响非酒精性脂肪肝病的潜在靶点预测
沙棘成分的对应靶点基因与非酒精性脂肪肝病差异表达的基因在JVENN 在线网站(http://jvenn.toulouse.inra.fr/app/example.html)绘制韦恩图(Venn),其中交集基因即沙棘干预非酒精性脂肪肝病的潜在靶点。
1.4 构建蛋白质互作网络(PPI)
将沙棘干预非酒精性脂肪肝病的潜在靶点导入STRING 网站(https://cn.string-db.org/)构建靶点蛋白之间的关系网络图(medium confidence:0.4)。将PPI 网络关系图导入Cytoscapev 3.9.0 平台可视化并借助Cytohubba 工具计算Degree 度值。
1.5 基因本体(GO)功能富集与基因组百科全书(KEGG)通路富集
将潜在靶点的gene symbol 使用org.Hs.eg.db R 包转化为Entrez ID 后,clusterprofiler、enrichplot R 包对潜在靶点进行生物过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF)做GO 功能富集和KEGG 通路富集(FDR<0.05)。筛选BP、CC 和MF 三者富集数量排序均居前10 位的结果通过ggpubr 包绘制GO 功能富集的条形图。借助ggplot 2 包将KEGG 信号通路的全部结果可视化绘制气泡图。
1.6 成分-靶点-通路网络的构建
沙棘成分、靶点信息和信号通路的相互关系导入Cytoscape(v 3.9.0)平台构建成分-基因-通路分析网络。
1.7 分子对接验证分析
使用网络拓扑分析Degree 算法筛选出前10 个基因作为核心靶点,并利用RCSB 数据库(https://www.rcsb.org/)、AlphaFold 数据库(https://alphafold.ebi.ac.uk/)和TCMSP 数据库(http://tcmspw.com/tcmsp.php)获取10 个活性分子的三维结构信息。有效成分和经PyMOL 2.2.5 去除多余配体的靶点蛋白在AutoDock Tools 1.5.7 软件分别去除水分子、补全氢分子,选定受体、配体后输出为PDBQT 文件。调整靶点蛋白Grid Box 参数使其对接范围包含全部的蛋白质结构。在AutoDock Vina 软件中完成核心成分与靶点之间的对接,记录其亲和性并用pheatmap R 包绘制对接结果热图进行分析。沙棘的10 种活性成分与其亲和性最高的非酒精性脂肪肝病核心靶点在PyMol 中进行分子对接的可视化。
2 结果
2.1 沙棘干预非酒精性脂肪肝病潜在靶点的获取
在TCMSP 数据库检索到沙棘有效成分223 种,剔除未检索到靶点的成分和删除重复选项后,得到138 种活性成分与574 个靶点蛋白的关系信息。GSE126848 测序数据包含健康群体(14 例)、健康肥胖(12 例)、单纯非酒精性脂肪变性(15 例)和非酒精性脂肪肝炎(16 例)4 组信息。将对照组(健康群体和健康肥胖)26 例样本与试验组(脂肪变形和脂肪肝炎)31例样本的表达谱信息转化为13 569 个基因矩阵信息后,以P<0.05、|LogFC|≥1 为过滤条件筛选非酒精性脂肪肝病的差异表达基因。非酒精性脂肪肝病差异表达基因共1 188 个,其中上调表达627 个,下调表达561 个,采用limma R 包对数据矩阵进行差异分析,代表上调基因的红色圆点共627 个,代表下调基因的蓝色圆点共561 个,灰色部分代表的基因被认为差异表达不显著。详见图1。574 个沙棘靶点与1 188 个非酒精性脂肪肝病靶点的交集,共61 个关联靶点。详见图2。
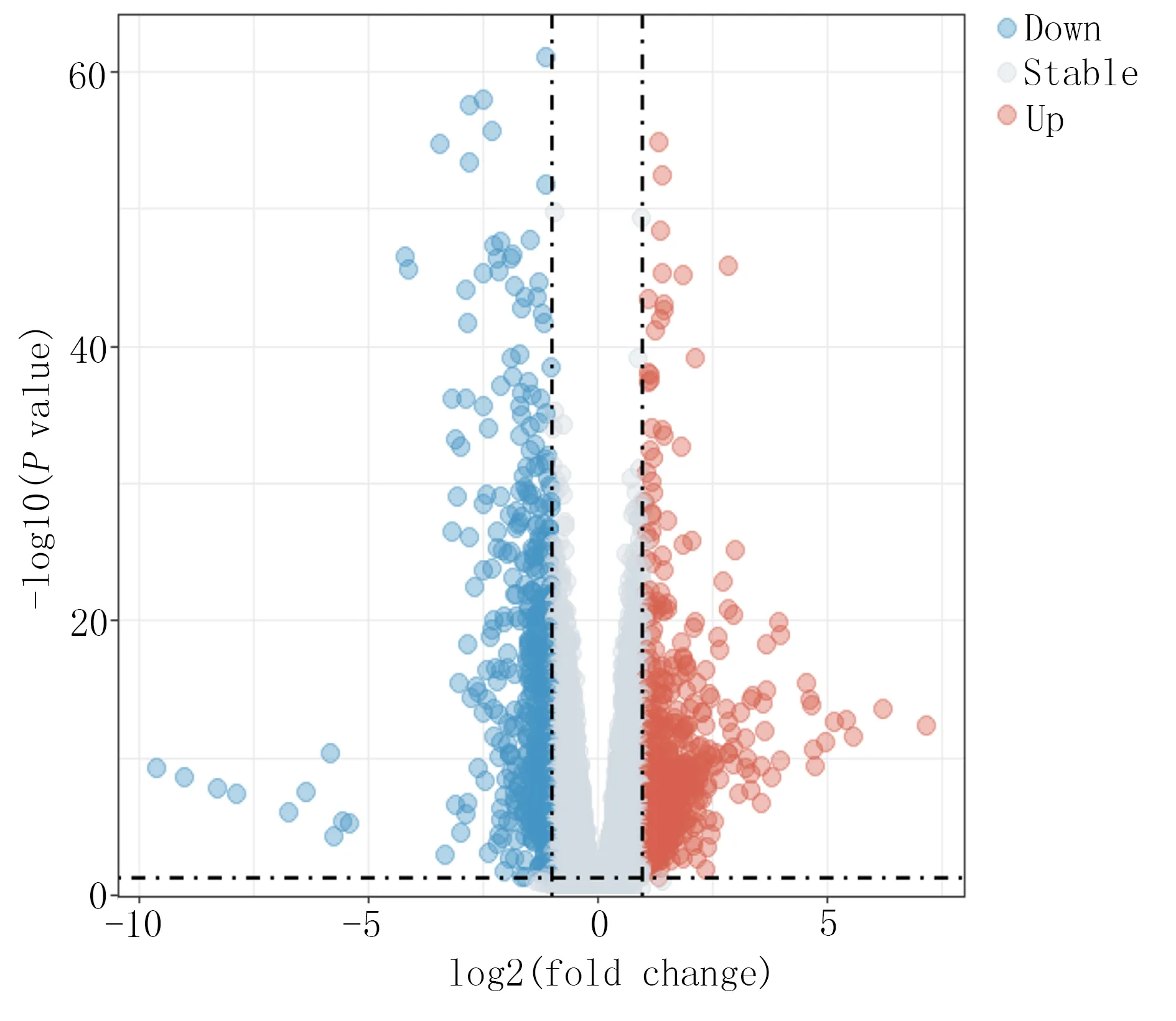
图1 沙棘干预非酒精性脂肪肝病潜在靶点火山图

图2 沙棘干预非酒精性脂肪肝病潜在靶点韦恩图
2.2 蛋白质互作网络的构建
61 个影响非酒精性脂肪肝病的潜在基因在STRING 网站检索后蛋白质互作网络关系图见图3。将网络关系导入Cytoscape 平台,其中TCF7L1、PCDH12、PDXP、B3GAT1、MAPK8IP2、HS3ST3A1、NT5M、SLC16A6 和CBS 这9 个靶点基因由于独立于主要网络关系暂不纳入分析。按照网络拓扑分析计算Degree 值排序,选取Degree 值居前10 位的基因(JUN、MMP9、FGF2、VCAM1、CDKN1A、ACE、SERPINE1、SPP1、NOS3、CCNA2)作为核心靶点做深入研究分析,详见图4,图中颜色深浅反映网络拓扑分析Degree 关系强弱。

图3 沙棘干预非酒精性脂肪肝病潜在靶点蛋白质互作网络图(基于STRING 网站)

图4 沙棘干预非酒精性脂肪肝病潜在靶点蛋白质互作网络图(基于Cytoscape 平台)
2.3 GO 功能富集与KEGG 通路富集
利用clusterprofiler 包富集61 个潜在靶点主要的细胞功能与信号通路并将其可视化,GO 功能富集主要富集到对异源刺激反应、活性氧反应、镉离子的反应、营养反应、调节血管形成、脉管系统发展相关生物过程,详见图5;KEGG 信号通路主要富集到细胞周期、p53 信号通路、动脉粥样硬化、AGE-RAGE 信号通路、细胞衰老、缺氧诱导因子-1(HIF-1)信号通路等信号通路。详细见图6。
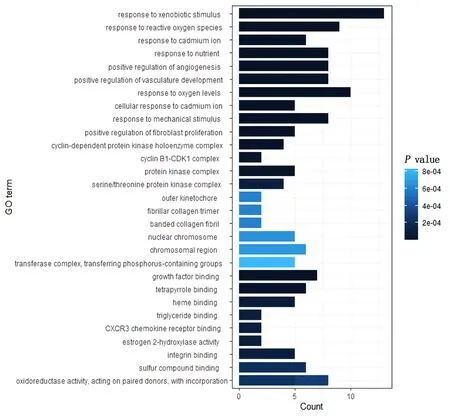
图5 沙棘干预非酒精性脂肪肝病潜在靶点GO 富集分析柱状图
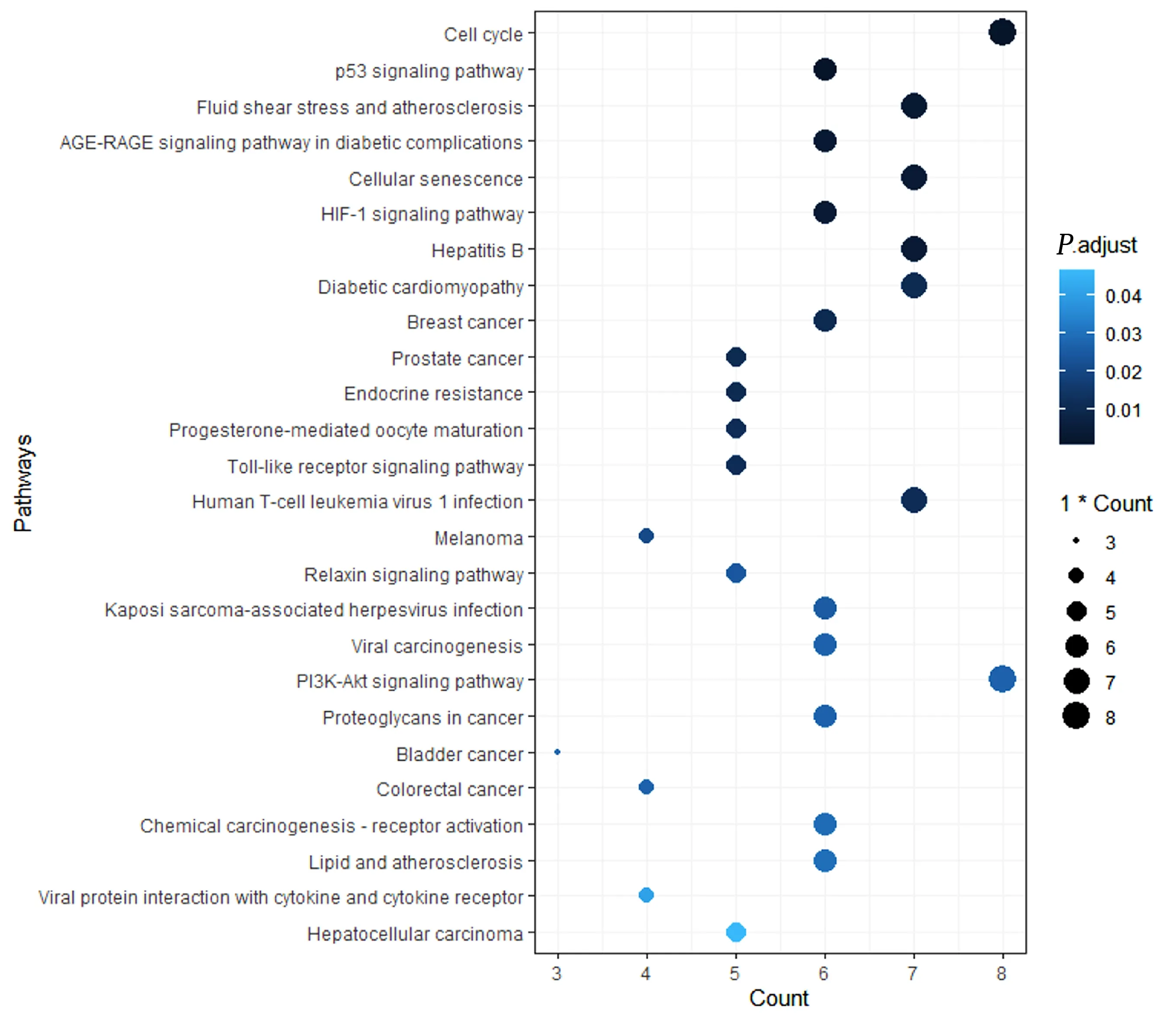
图6 沙棘干预非酒精性脂肪肝病潜在靶点KEGG 富集分析气泡图
2.4 成分-靶点-通路网络的构建
沙棘中62 种活性成分显示,通过调节转录因子JUN 等61 个靶点影响干预非酒精性脂肪肝病的发展。将基因与信号通路的关系导入Cytoscape 平台进行可视化处理,62 种沙棘成分、61 个靶点基因、10 条GO 功能富集(生物过程)和26 条KEGG 信号通路,共159 个节点和表示其相互关系的387 条边共同构成成分-靶点-信号通路关系网络。详见图7。

图7 沙棘干预非酒精性脂肪肝病的成分-靶点-通路网络关系图
2.5 分子对接验证分析
筛选到的核心基因与主要成分进行进一步分子学验证,以研究成分靶点之间具体的结合分子机制。核心靶点(JUN、MMP9、FGF2、VCAM1、CDKN1A、ACE、SERPINE1、SPP1、NOS3、CCNA2)与各核心成分[槲皮素(quercetin)、黄酮(flavone)、山柰酚(kaempferol)、亚麻酸(linolenic acid)、异鼠李素(isorhamnetin)、杨梅黄酮(myricetin)、香豆素(coumarin)、熊果酸(ursolic acid)、芦丁(rhein)、豆甾醇(stigmasterol)]一一进行分子对接,利用pheatmap 包绘制对接亲和性热图,详见图8。其中,结合能(Vina 评分)越低则表示靶点与活性成分对接后越稳定。在Autodock Vina 分子对接中,配体和受体之间对接结果若结合能≤-5.0 kcal/mol,则被认为是对接的良好标准品[11-12]。同时也有经验法则(rule of thumb)认为,结合能≤-7.0 kcal/mol 为结合力强的体现。沙棘活性成分芦丁与核心靶点NOS3亲和性结合能=-8.8 kcal/mol 为100 次对接结果中亲和性最高的组合。分子对接结果显示,槲皮素、黄酮、山柰酚、亚麻酸、异鼠李素、杨梅黄酮、香豆素、熊果酸、芦丁和豆甾醇共10 种活性物质与JUN、MMP9、FGF2、VCAM1、CDKN1A、ACE、SERPINE1、SPP1、NOS3 和CCNA2 10 个核心靶点有较高亲和性。详见图9。

图8 10 个核心靶点与10 个核心成分之间的Autodcok vina 对接亲和性热图

图9 沙棘主要活性物质与亲和性最高的靶点的分子对接可视化图
3 讨论
在全球流行肥胖的背景下,非酒精性脂肪肝病患病率不断上升[13]。目前,“多重打击”解释非酒精性脂肪肝病发病过程中多种可能的平行作用,其中氧化应激被认为是肝损伤和疾病发展的主要因素[14]。脂类代谢紊乱导致肝脏脂质积累,影响线粒体、内质网和NADPH 氧化酶等活性氧的发生器,从而影响胰岛素敏感性和脂类代谢关键酶的活性与表达[15]。尽管肥胖是非酒精性脂肪肝病公认的风险因素,但也有瘦弱个体的患病报道[16]。所以在本研究中,GSE126848 数据集中14 例正常健康样本与12 例健康肥胖(肝脏样本正常)样本一同纳入本研究的对照组,有效排除单纯肥胖对非酒精性脂肪肝病研究的影响。
由于非酒精性脂肪肝病的多种危险因素的相互作用,来自草药或饮食的天然活性物质由于对应的众多靶点而成为非酒精性脂肪肝病潜在的治疗方法[17]。从构建的网络中发现,不同化合物对应的多个靶点、多个信号通路重合,预测对非酒精性脂肪肝病可发挥协同干预作用。槲皮素诱导超氧化物歧化酶(SOD)催化分解反应中供氢体谷胱氨肽的合成,从而发挥清除自由基和活性氧的作用[18]。除此之外,槲皮素还可以通过激活FXR1/TGR5 信号通路改善脂质代谢[19],或通过抑制脂肪酸的从头合成途径减少脂质积累[20]。山柰酚缓解细胞中脂质储存和内质网应激[21],介导磷酸腺苷酸活化蛋白激酶(AMPK)/西罗莫司靶蛋白(mTOR)的磷酸化诱导细胞自噬从而发挥对脂毒细胞的保护作用[22]。作为过氧化物酶增殖物激活受体γ(PPARγ)天然配体,异鼠李素通过抑制受体信号传递改善胰岛素抵抗、抑制脂肪细胞的分化并减轻肝脏的脂肪变性以及纤维化程度[23-24]。
61 个沙棘干预非酒精性脂肪肝病潜在靶点构建蛋白质互作网络确定了其中10 个核心基因参与疾病的发生、发展。转录因子JUN(transcription factor JUN)在61 个潜在干预靶点的网络拓扑分析中Degree度值最高。JUN 识别激活蛋白-1(activator protein-1,AP-1)特定序列并与之结合成转录复合物,可增强其结合活性与转录活性[25-26]。构成AP-1 的系列蛋白特别是c-Jun 已被证明在肝脏生物学和疾病的许多方面起着至关重要的作用[27]。与对照组小鼠相比,饮食诱导的非酒精性脂肪肝病小鼠在组织阵列和免疫组化分析中JUN 信使核糖核酸(mRNA)表达水平及磷酸化水平升高[28]。与正常肝组织相比,非酒精性脂肪肝病病人mRNA 的表达水平显著增强,且c-JUN 的表达与炎性评分、脂肪变性分级显示显著相关性[28]。在与JUN靶点对应的多个沙棘活性成分中,杨梅黄酮与熊果酸通过抑制可磷酸化激活c-jun 的酶类(jun N-terminal kinase,JNK)表现抑制JUN 作用[29-30]。与其他核心基因相比,内皮细胞一氧化氮合酶(nitric oxide synthase,endothelial NOS3)与沙棘多个活性成分展现高亲和性。内皮一氧化氮合酶(eNOS)介导血管张力并在心血管系统中提供抗炎信号,而缺乏eNOS 的小鼠线粒体周转和自噬的相关标志物减少,更容易受到西方饮食诱导的肝脏炎症和纤维化的影响[31]。在筛选的沙棘活性成分中,芦丁可通过NOS 介导的核转录因子-κB(NF-κB)信号通路抑制氧化应激和抗炎效应[32],同时对卡非佐米(carfilzomib,CFZ)诱导的肾毒性表现出保护作用[32],在肝脏相关研究中也可能有类似功效潜力。有统计学研究显示,重塑金属蛋白酶9(matrix metalloproteinase-9,MMP9)在内脏脂肪组织中表达增加,且促炎糖蛋白TNC 与MMP9 的表达水平呈现明显正相关[33]。而在本研究中MMP9 受沙棘中槲皮素的调控表达同样在相关研究中得到验证。槲皮素可降低MMP9、MMP2 和血管内皮生长因子-A(VEGF-A)的表达阻止癌细胞的侵袭和血管形成[34]。MMP9 对非酒精性脂肪肝病的直接影响相对较少,仍处于研究更新状态,但是MMP9 在肥胖症中的表达异常或活性改变强调其在肥胖及相关肥胖并发症的病理生理的参与[33]。
61 个沙棘干预非酒精性脂肪肝病的靶点在GO 功能富集中收集到多种生物学相关过程,其中活性氧(ROS)、活性氮(RNS)等促氧化剂与抗氧化剂之间的平衡维持着细胞正常生理状态下的增殖、分化、迁移和收缩[35]。正常生理状态下,基础水平的ROS 参与氧化还原反应信号的传导[36]。细胞通过分解脂滴回收受损的内质网和线粒体,抑制氧化应激和有害ROS 的生成[37],维持肝脏功能代谢和能量需求,预防非酒精性脂肪肝病或非酒精性脂肪性肝炎[38-39]。高脂饮食和脂质代谢失调导致肝游离脂肪酸和三酰甘油的积累[40]。线粒体β 氧化水平降低和脂肪生成增加导致肝细胞中的脂质积累,生成过多的ROS[39]。除线粒体外,内质网中细胞色素P450 活性反应、微粒体代谢、CHOP 表达也是ROS 的来源[41]。ROS 异常生成时,通过抑制线粒体呼吸链酶、诱导脂质过氧化、促进促纤维化细胞迁移,造成肝细胞的损伤和纤维化[42]。同时ROS 不利于线粒体自噬对肝脏的保护。ROS 诱导线粒体膜电位增加不利于线粒体自噬的发生[43],不利于凋亡降解维持线粒体功能结构[39]。可见,ROS 参与细胞多种反应过程,对维持肝细胞微环境非常重要。
除此之外,在KEGG 富集通路中也有丰富的生物信号通路体现。P53 调节细胞应激、代谢和周期,已成为肝脏稳态和功能障碍的重要调节剂[44]。P53 参与脂质代谢相关基因的表达促进脂质分解,或抑制脂质合成蛋白质来调控脂质积累。但是也有相关报道称表示抑制P53 的转录活性可以降低肝脏脂肪变性相关的氧化应激[45]。其中,P53 与非酒精性脂肪肝病的双重关系可能与激活状态、细胞内分布和突变相关[46]。
10个核心靶点与10个核心成分之间的Autodcok Vina对接亲和性热图显示,沙棘活性成分与非酒精性脂肪肝病核心靶点亲和性几乎全部结合能≤-5.0 kcal/mol,且部分对接组合结果结合能≤-7.0 kcal/mol 展示高亲和性。
沙棘主要的活性物质与亲和性最高的靶点的分子对接可视化图显示,受体与配体间接触面积较大,活性分子基本被蛋白分子接触包绕。除去NOS3 与豆甾醇之间的结合为疏水作用力,其余核心靶点与活性成分展现高亲和性则以亲水氢键连接。通过分子对接亲和力热图层次聚类分析,NOS3、MMMP9、ACE、SERPINE1 和CCNA2 与沙棘活性成分亲和力明显高于其余核心基因而被分为不同模块。其中NOS3 与众多沙棘核心成分亲和性最高,沙棘成分可能主要通过与NOS3 的相互作用发挥抗炎抗非酒精性脂肪肝病功效。与其他沙棘成分相比,熊果酸与多个核心基因也显示较高亲和性。除熊果酸以外,沙棘中其他种类及含量丰富的有机酸也可能在非酒精性脂肪肝病干预过程中发挥潜在作用。
总而言之,本项目研究GEO 公开数据库收集非酒精性脂肪肝病的特征基因,并筛选与之对应匹配的沙棘活性成分。研究结果表明沙棘可通过多靶点和多通路影响干预非酒精性脂肪肝病,为以后非酒精性脂肪肝病的相关病理或药理研究提供参考。

