雪莲果叶UPLC-ECD指纹图谱及其抗氧化活性成分研究
丁小倩,李姿瑶,王 艳,何 婷,陈荣祥,袁晓艳
(遵义医科大学 药学院 分析化学教研室,贵州 遵义 563099)
雪莲果(Smallanthus Sonchifolius),又称亚贡(yacon),是菊科Smallanthus属多年生草本植物,原产于安迪斯山脉的中高原地带,目前在日本、巴西、韩国、中国等多个国家均有引种,我国境内主要分布于云南、贵州、四川等地区[1]。研究表明,雪莲果中含丰富的酚酸、黄酮和低聚果糖类成分[2-3],该类成分被认为具有抗氧化、降血脂、抗菌、抗肿瘤等药理作用[4-5]。雪莲果叶研究及应用较少,民间将其加工为饮料或糖浆用于降血脂及预防因自由基过剩引起的慢性疾病[6]。事实上酚酸黄酮类物质主要集中在雪莲果的叶子中,Khajehei 等[7-8]的研究显示,雪莲果叶的总酚含量在(53.39±1.94) mg/g~(76.67±21.67) mg/g范围内,远高于其块茎中的酚酸含量,因此雪莲果叶具有较强的抗氧化能力。已有研究人员将其研制为清咽含片[9],研究其降血糖含片工艺[10]、制茶工艺[11],因而筛选雪莲果叶的抗氧化成分有利于雪莲果叶进一步开发应用。
电化学检测器(electrochemical detector,ECD),用于选择性检测具有氧化还原性的物质,灵敏度高,能辅助筛选中药中的抗氧化成分[12],如带有硝基、巯基、酚羟基等基团的有机化合物,因此适用于检测含大量酚酸类成分的雪莲果叶。前期研究发现,所建ECD分析方法得到的药材谱图中峰面积与其抗氧化能力具有相关性,同时图谱中的成分均有较强的抗氧化能力[13-14],因此采用ECD筛选抗氧化成分的方法具有可靠性。本研究通过UPLCECD法建立指纹图谱,寻找雪莲果叶抗氧化活性成分。
1 仪器与试药
1.1 仪器
ACQUITY UPLC-Xevo TQ-S超高效液相色谱串联三重四极杆质谱仪(配有MassLynx V.4.1工作站软件,美国Waters);Thermo UltiMate 3000 bio-RS超高效液相色谱仪(配有Chromeleon 7.2工作站,ECD-3000 RS电化学检测器,赛默飞世尔);SB-5200DT型超声波清洗机(宁波新芝);ME104E/02型电子天平(梅特勒-托利多);ThermoST8R小型台式离心机(赛默飞世尔);埃尔格Purelab Chorus 2超纯水系统(英国埃尔格);Multiskan FC酶标仪(赛默飞世尔)。
1.2 试药
雪莲果叶药材采集于四川、云南、贵州多个产地,具体信息见表1。经遵义医科大学药学院生药学教研室张玉金副教授鉴定为菊科Smallanthus属亚贡(Smallanthus Sonchifolius)的新鲜叶子。
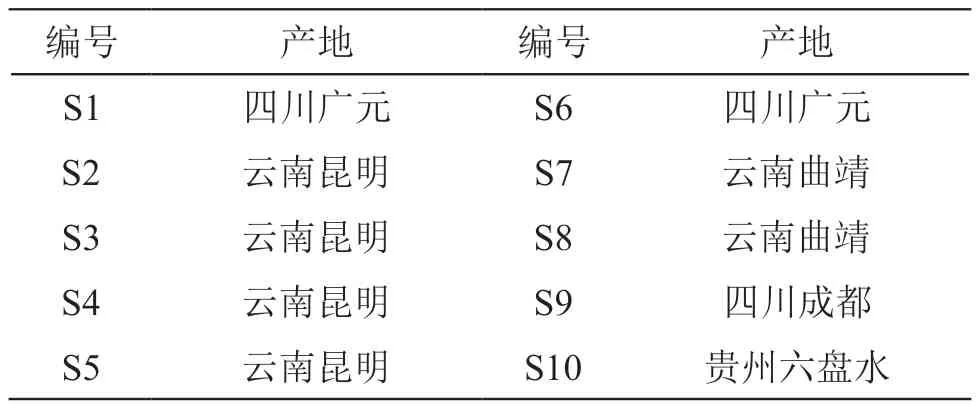
表1 雪莲果叶药材来源
乙腈(色谱纯,北京伊诺凯);甲酸(分析纯,赛默飞世尔);无水乙酸钠(分析纯,重庆川东化工);3, 7-二-O-甲基异槲皮苷对照品(HPLC纯度≥98 %,成都埃法);芦丁,异槲皮苷,异绿原酸A对照品(HPLC纯度≥98 %)以及福林酚,三氯化铁六水合物,氢氧化钠,无水碳酸钠,亚硝酸钠,硝酸铝,硫酸亚铁七水合物,过硫酸钾,冰乙酸,生育酚,柠檬酸钾,2, 2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS),4, 4’-二(1H-1, 2, 4-三唑-1-基)-1, 1’-联苯(TPTZ),1, 1-二苯基-2-三硝基苯肼(DPPH)等试剂均为分析纯(上海阿拉丁)。
2 方法与结果
2.1 指纹图谱建立
2.1.1 供试溶液制备 将10批新鲜雪莲果叶置烘箱,50 °C烘干至恒重,取适量干燥雪莲果叶,粉碎,分别称取1 g粉末,加入70 %乙醇10 ml,超声提取30 min,10 000 r/min离心5 min,取5 ml上清,用70 %乙醇定容至20 ml,0.22 μm滤膜过滤得样品溶液。分别取10批药材样品溶液0.1 ml,混匀得混合样品溶液。
2.1.2 混合对照品溶液的配制 分别取芦丁、异槲皮苷、异绿原酸A对照品1 mg,用70 %乙醇定容至100 ml量瓶,得0.01 mg/ml混合对照品溶液。
2.1.3 色谱条件 色谱柱:XBrigde BEH Shield RP18(3 mm×150 mm,2.5 μm);流动相:0.1 %甲酸(A)-乙腈(B),梯度洗脱(0~14 min,95 %A~77 %A;14~24 min,77 %A~72 %A;24~32 min,72 %A~57 %A;32~37 min,57 %A~0 %A;37~39 min,0 %A~0 %A;39~43 min,0 %A~95 %A);因ECD需要高浓度的盐[15],所以将100 mmol/L柠檬酸钾溶液以0.1 ml/min的流速于色谱柱后,检测器前的位置补充;流速:0.4 ml/min;柱温:30 ℃;进样量:3 μl;电化学检测池电流:600 nA。
2.1.4 指纹图谱分析方法 取2.1.1项下10批样品溶液和2.1.2项下混合对照品溶液,按2.1.3项下色谱条件进样检测,记录43 min的色谱图。UPLC指纹图谱见图1,采用《中药色谱指纹图谱相似度评价系统》(2012版)进行分析,得UPLC对照指纹图谱(见图2)。以UPLC对照指纹图谱为参照图谱,进行10批样品的相似度评价,结果见表2,10批样品的相似度在0.983~0.754之间。10批雪莲果叶样品共有12个共有峰,选取共有峰中分离度大,峰形好,峰面积适中的6号峰作为参照峰,计算其余峰的相对峰面积,结果见表3。
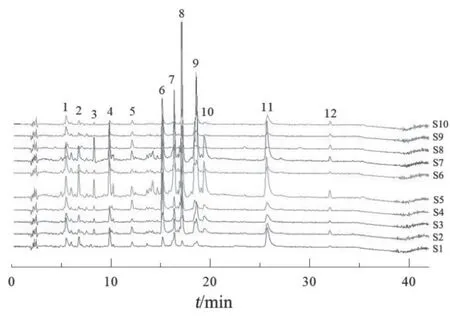
图1 10批雪莲果叶样品UPLC-ECD指纹图谱
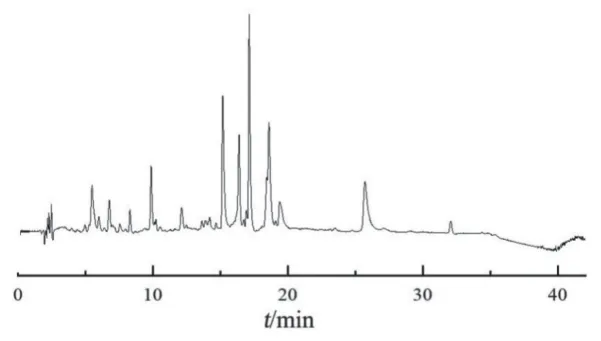
图2 雪莲果叶UPLC对照指纹图谱
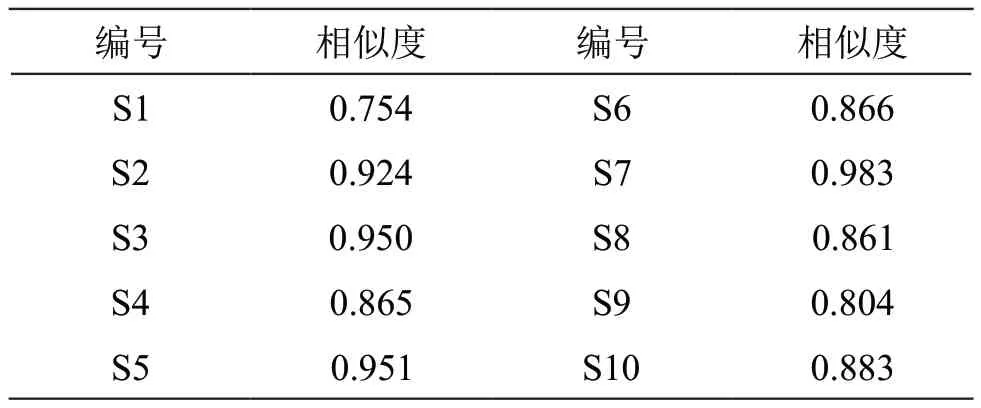
表2 10批雪莲果叶样品相似度评价结果
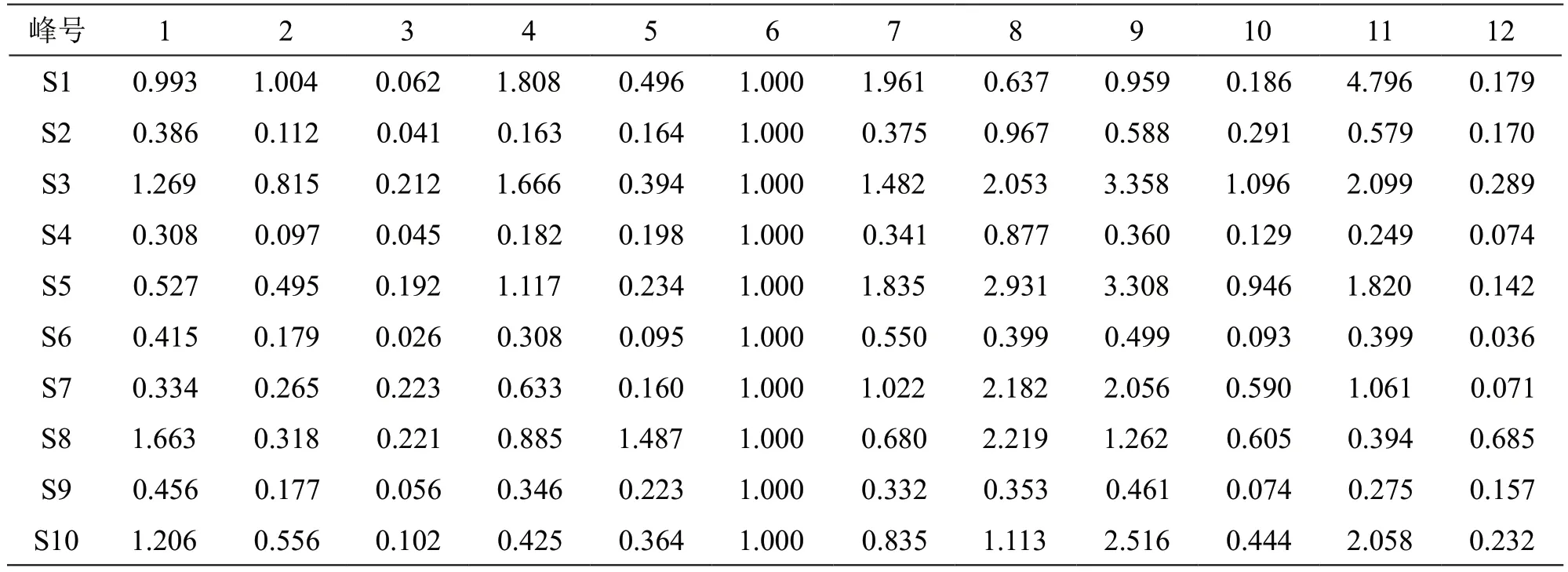
表3 10批雪莲果叶样品UPLC图谱共有峰相对峰面积
2.2 共有峰的鉴别
2.2.1 质谱条件 电喷雾离子源,负离子检测模式下多反应监测模式检测;毛细管电压:3.5 kV;蒸发温度:600 °C;气流量:750 L/h。
2.2.2 鉴别方法及结果 根据对照品离子对并参考文献中报道的离子对[16],得化合物质谱参数,见表4。取2.1.2项下混合对照品溶液和2.1.1项下混合样品溶液,按2.1.3项下色谱条件进样检测。通过对比UPLC-ECD混合对照品色谱图(图3)、UPLCECD指纹图谱(图1)、UPLC-MS所得混合样品和混合对照品的图谱(图4、图5),将1,6,7,8,9,11号峰分别指认为咖啡酰葡萄糖二酸、双咖啡酰太洛黏酸、芦丁、异槲皮苷、异绿原酸A和2, 3,5-或2, 4, 5-三咖啡酰太洛黏酸。
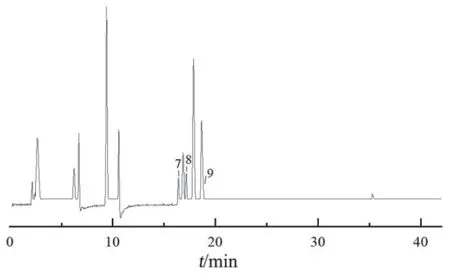
图3 混合对照品UPLC图谱
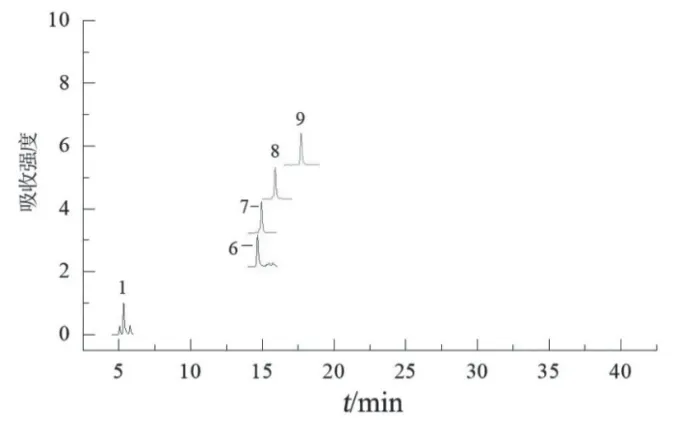
图4 混合样品UPLC-MS图谱
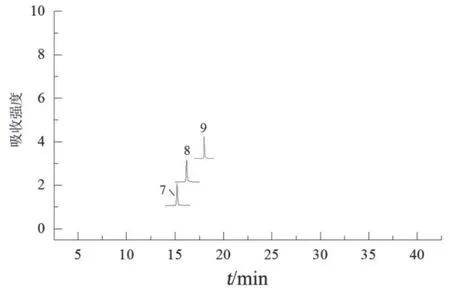
图5 混合对照品UPLC-MS图谱
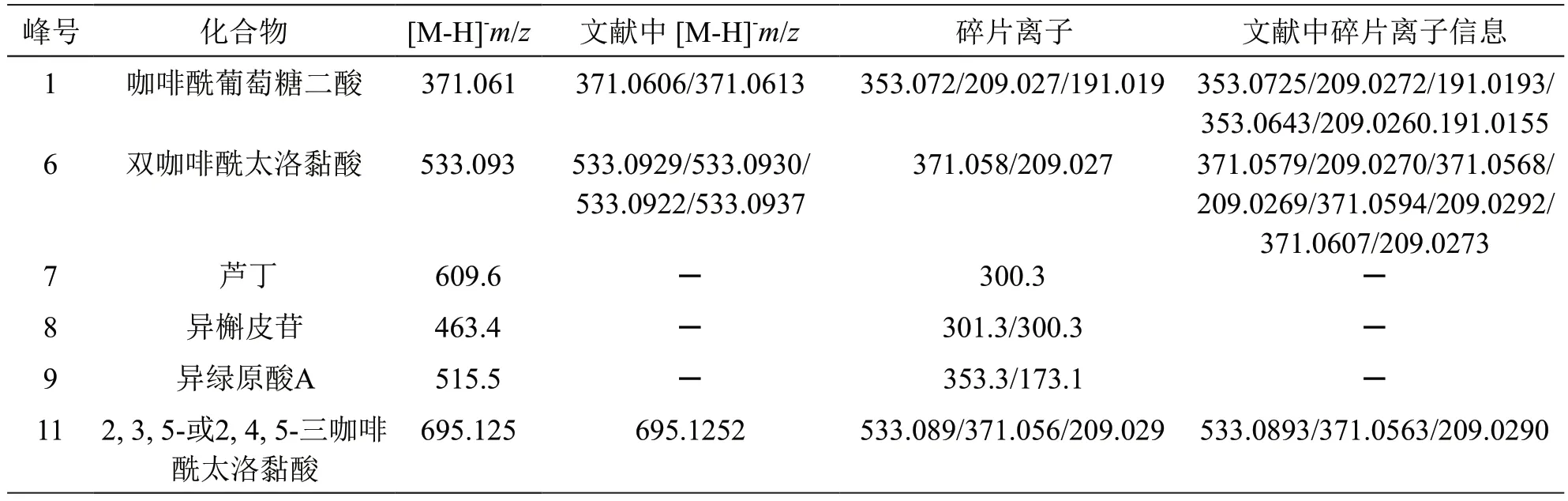
表4 UPLC-MS鉴定雪莲果叶中的成分
2.3 聚类分析
采用SPSS 26软件进行聚类分析。以10批药材样品12个共有峰的峰面积为变量,采用组间连接法,当欧式距离为12时,10批雪莲果叶药材可分为两类,S5、S7为一类,S1~S4、S6、S8~S10为第二类,提示这两类雪莲果叶样品存在质量差异,详见图6。
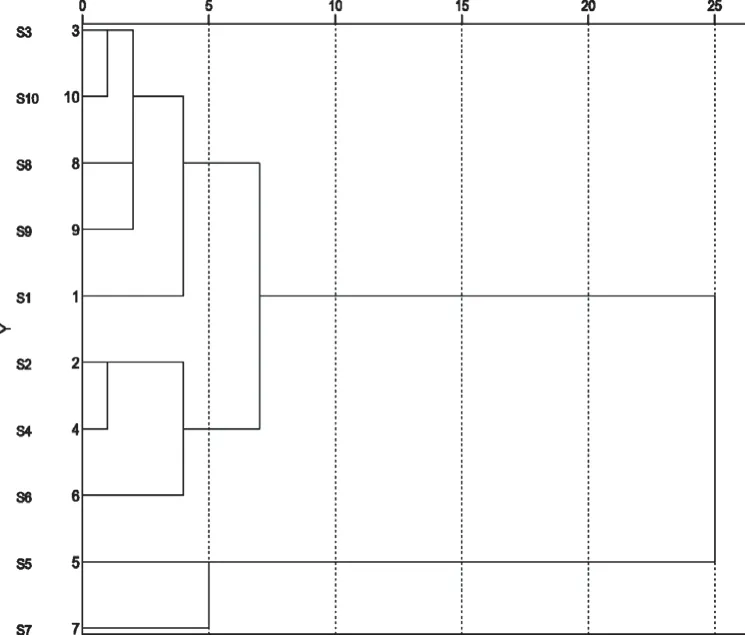
图6 聚类分析树状图
2.4 总酚含量分析
总酚含量的测定采用福林-酚比色法。分别取2.1.1项下供试品溶液0.5 ml,加入0.5 ml福林酚试剂(0.25 mol/L),反应3 min,加15 % Na2CO31 ml,混匀,反应30 min后,3500 r/min离心3 min,取上清,760 nm下测得吸光度。配制浓度为0.1,0.2,0.5,1,2,5,10,20,50 mg/L的没食子酸标准曲线溶液,按上述方法测定,得回归方程y=115.77x+0.074,R²=0.9988。总酚结果表示为每克雪莲果叶中所含没食子酸当量(mg/g),由结果可知,第一类雪莲果叶S5、S7的总酚含量明显高于第二类雪莲果叶,详见表5。此外,将Origin软件中不同批次雪莲果叶UPLC指纹图谱的总峰面积和总酚含量结果进行线性回归,发现二者呈正相关,说明在所采用的色谱条件下,ECD检测器检测到的主要化合物为酚酸类化合物。
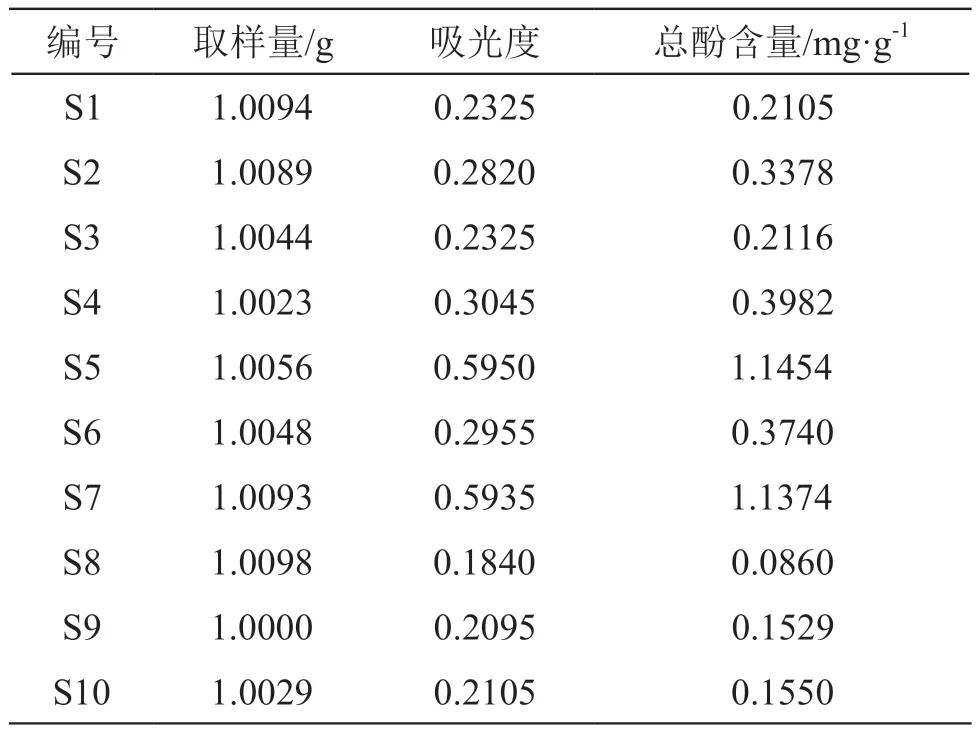
表5 不同产地雪莲果叶总酚含量测定结果
2.5 抗氧化活性成分
2.5.1 DPPH自由基清除实验 DPPH自由基清除率的测定基于Abbas等[17]的方法并稍作修改。取适量DPPH,用80 %甲醇溶液溶解并稀释至0.1 mg/ml,得DPPH工作液。取10批药材粉末,加10倍量70 %乙醇(w/v),超声提取30 min后得样品溶液。样品溶液S5、S7用80 %甲醇稀释10倍,其余样品溶液稀释5倍后,分别取40 μl,用80 %甲醇稀释至200 μl,混匀后加入DPPH工作液400 μl,摇匀,室温下避光反应30 min,使用酶标仪在517 nm处测定溶液的吸光度,平行操作3次。结果见表6。
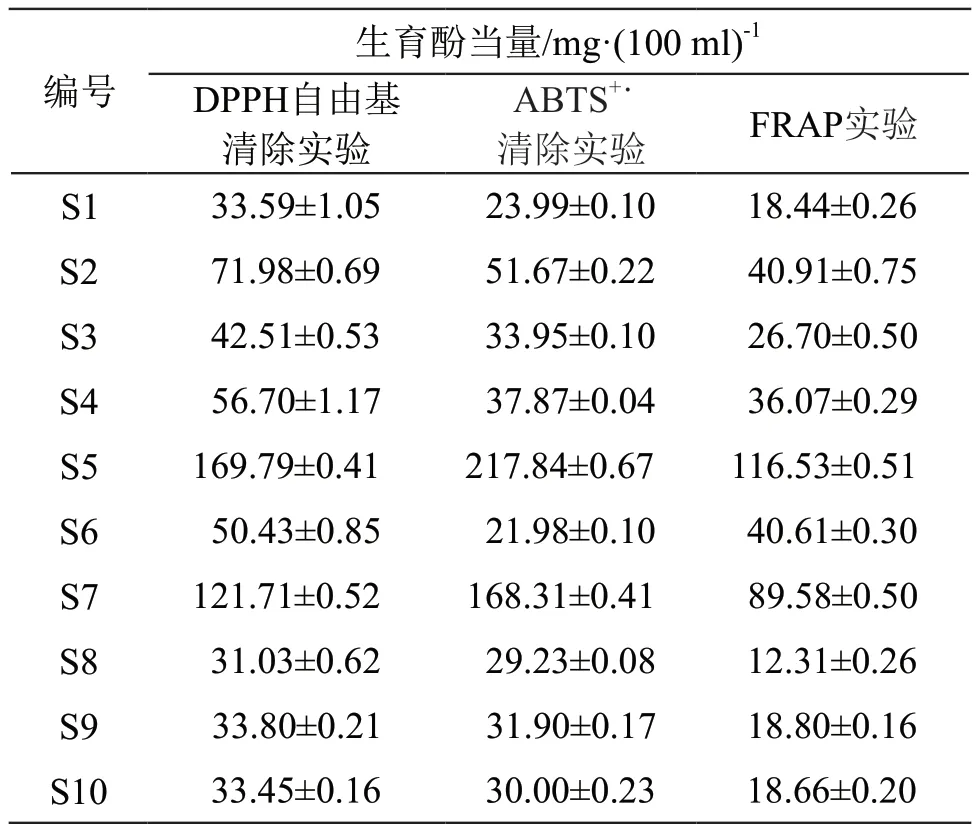
表6 抗氧化活性测定结果
2.5.2 ABTS+˙清除实验 ABTS+˙清除能力测定参考Rajakumari等[18]的方法并稍作修改。取3.75 mg/ml ABTS溶液1.6 ml和0.67 mg/ml的过硫酸钾溶液各3 ml,混合,室温、避光条件下静置反应12~16 h,制备成ABTS+˙储备液。将ABTS+˙储备液用水稀释,使其在734 nm波长处的吸光度在0.7~0.8之间,得ABTS+˙工作液。取10批药材粉末,加10倍量70 %乙醇(w/v),超声提取30 min后得样品溶液,将S1、S2、S4、S6用水3:7(v/v)稀释,S3、S8~S10用水稀释5倍,S5、S7用水稀释10倍。测定时取0,20,60,100,140,200 μl稀释后的样品溶液,加水稀释至200 μl,摇匀,加400 μl ABTS+˙工作液,混匀后于室温下反应30 min,734 nm波长处测定吸光度,重复操作3次。
2.5.3 Fe3+还原能力实验(FRAP实验) Fe3+还原能力参考Adedayo等[19]的方法并稍作修改。TPTZ溶液由5 mmol/L醋酸盐缓冲液(pH 3.6)、9 mmol/L TPTZ工作液(用40 mmol/L盐酸溶解,37 ℃提前预热30 min)、20 mmol/L FeCl3溶液(10:1:1,v/v/v)组成,现配现用。取10批药材粉末,加10倍量70 %乙醇(w/v),超声提取30 min后得样品溶液,分别用水稀释30倍,准确量取100 μl样品稀释液,加入300 μl TPTZ工作液,混匀后反应5 min,于593 nm波长处测定吸光度,重复操作3次。
DPPH、ABTS、TRAP实验结果均表示为生育酚当量。DPPH自由基清除实验中标准曲线拟合为y=-0.0202x+0.817,R2=0.9918;ABTS+˙清除实验中标准曲线拟合为y=-0.0217x+1.3891,R2=0.9958;FRAP实验中标准曲线拟合为y=0.0396x+0.0489,R2=0.9998。抗氧化活性测定结果详见表6 。
2.5.4 灰色关联度分析 参考文献[20]方法,采用均值法对10批样品的抗氧化结果进行无量纲化处理,将雪莲果叶抗氧化结果作为母序列[记为Y(k)],共有峰峰面积作为子序列[记为X(k)],按下式计算母序列与子序列的关联度系数[p(k)]。
式中ρ为分辨系数,通常情况下取0.5;Δ(k)为母序列与子序列差的绝对值;Δ(k)min为第二级最小差;Δ(k)max为第二级最大差。
按下式计算关联度。
式中,n为样品数量。
采用SPSS软件计算得灰色关联度,12个共有峰的关联度均大于0.6,详见表7、表8。
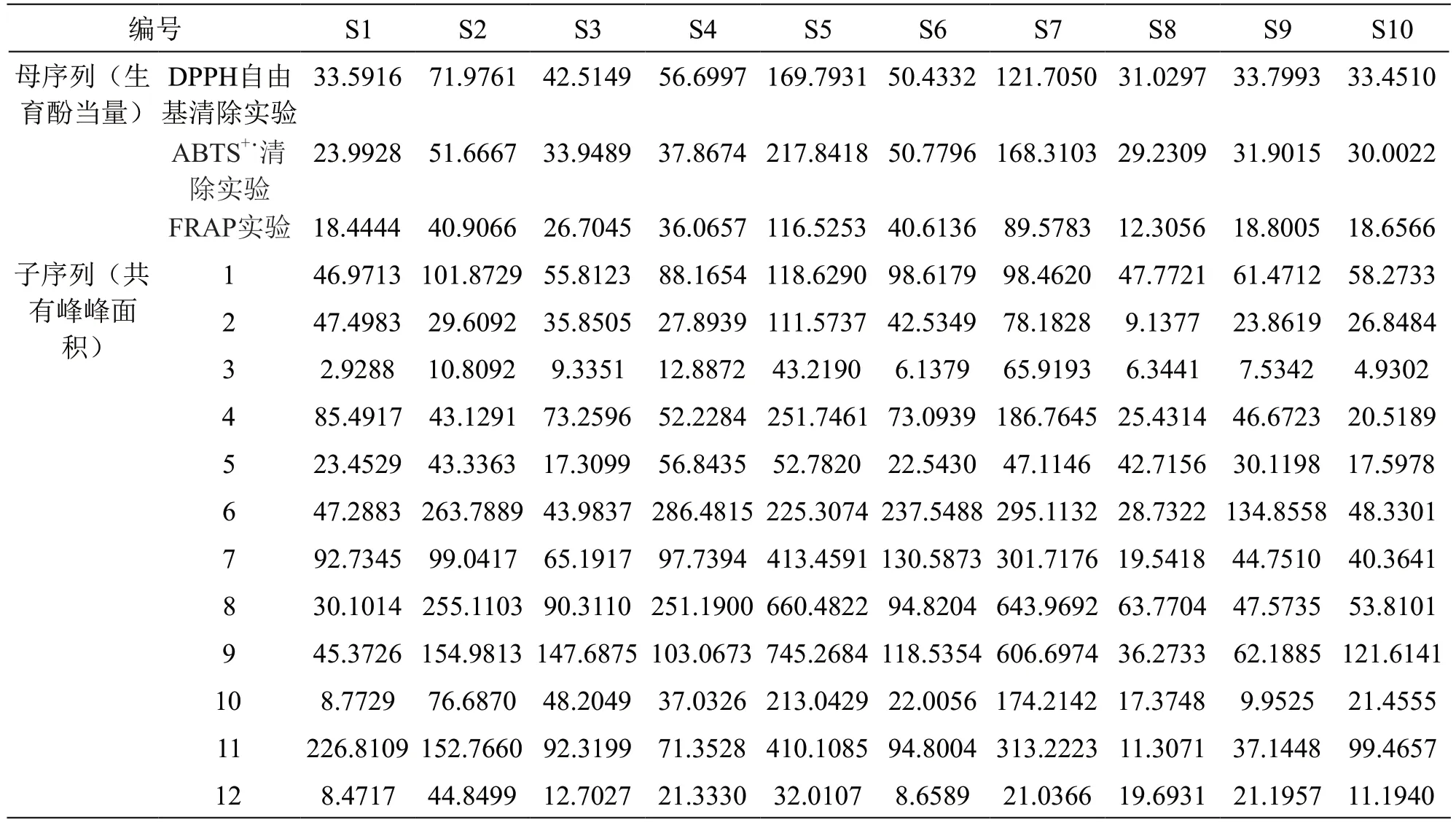
表7 灰色关联母序列及子序列
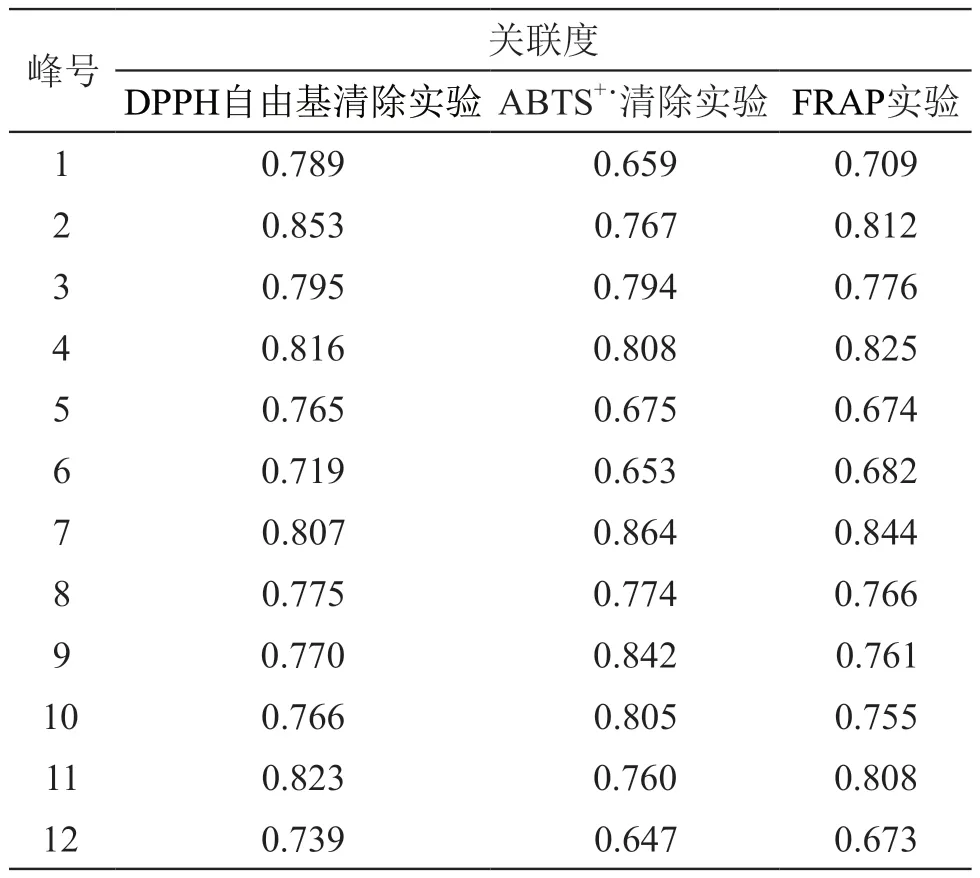
表8 雪莲果叶12种共有成分抗氧化活性与峰面积的关联度
抗氧化活性检测中S5和S7清除DPPH自由基的能力高出其余批次1.69~5.47倍,清除ABTS+˙能力高出3.26~9.08倍,Fe3+还原能力高出2.19~9.47倍,说明第一类雪莲果叶质量较好,抗氧化能力优于第二类。
在灰色关联分析中,关联度R介于0~1之间,该值越大代表其与母序列之间的相关性越强,当R>0.6时,表示该成分与药效指标有关联性,当R>0.8时,表示该成分与药效指标有较大关联性[21]。在灰色关联分析结果中,12个共有峰的关联度均大于0.6,说明ECD所建指纹图谱中所有共有成分均具有抗氧化能力,再次证明了使用ECD筛查抗氧化成分的有效性和可靠性。
3 讨论
本研究建立了10批雪莲果叶的UPLC-ECD指纹图谱,并结合UPLC-MS鉴定出6种成分。聚类分析结果显示,10批雪莲果叶样品可分为两类,S5、S7为第一类,其余样品为第二类,结合总酚结果和抗氧化结果可知,第一类雪莲果叶的总酚含量高于第二类,抗氧化能力也高出第二类,证明第一类雪莲果叶的质量优于第二类。前期研究中曾使用PDA 2695、DAD等紫外检测器,但所得谱图复杂,有诸多杂峰,且分析时间长。本文采用的方法具有选择性,能大幅改善上述情况,即通过ECD突出的筛选能力,仅留下抗氧化成分,从而使图谱简化,分析时间缩短。本实验中不同批次雪莲果叶总酚的含量与其对应的色谱图总峰面积具有相关性,同时灰色关联度分析结果显示12个共有峰与抗氧化活性均具有相关性,证明了该方法的有效性与可靠性。
综上,所建ECD筛选分析方法能有效筛选药材中的抗氧化成分,所建指纹图谱及聚类分析可用于雪莲果叶的质量评价。

