废磷酸系刻蚀液制备电池级磷酸铁
贾 婧,王秋帏,王小赫,胡馨尹,吴 旭
(1. 华中科技大学 环境科学与工程学院,湖北 武汉 430074;2. 湖北永绍科技股份有限公司,湖北 潜江 433122)
随着科技的发展,液晶显示器(LCD)以其体积小、能耗低、图像质量高等优点逐渐取代阴极射线显像管(CRT),广泛用于电视、计算机、智能手机和各种电子设备中[1]。液晶显示面板生产过程中,刻蚀工序常根据电极材料的不同而选择特定的刻蚀液,如氧化铟锡(ITO)刻蚀液、铝刻蚀液、铜刻蚀液、缓冲氧化物刻蚀液等,其中铝、铜刻蚀液均属于磷酸系刻蚀液[2],使用失效后的废磷酸系刻蚀液中含有30%~75%(w)的磷酸、4%~20%(w)的醋酸和1%~10%(w)的硝酸[3],具有产量大、酸度高、危险性强的特点。为了减少废磷酸系刻蚀液对环境的危害,同时对其中的磷资源加以利用,需要对该刻蚀液进行回收处理。
随着新能源汽车、电子产品制造等行业的发展,锂离子电池的需求量剧增,FePO4作为LiFePO4正极材料的前驱体,其合成与制备是影响LiFePO4材料性能的关键因素。2015年以来,全球LiFePO4的年产量约10万吨[4],预计今后锂离子电池的需求还将大幅增长。因此确保锂与FePO4的供给尤为重要。废磷酸系刻蚀液中富含磷,若能将其回收并用于制备FePO4,既可以解决FePO4的供应问题,又可以降低环境与生态风险。
本工作以废磷酸系刻蚀液为原料、铁粉为铁源、H2O2为氧化剂,采用氧化沉淀法一步制备电池级FePO4。考察了铁磷摩尔比、反应温度、H2O2投加量、pH和煅烧温度对FePO4制备的影响,利用XRD、SEM表征了FePO4的形貌和晶体结构,以期为废磷酸系刻蚀液的资源化利用提供一条新途径。
1 实验部分
1.1 材料与试剂
废磷酸系刻蚀液取自湖北省某企业,其中磷酸、硝酸和醋酸的质量浓度分别为505.05,35.31,387.44 g/L,此外还含有少量Al、Fe、Pb、Ba、Cr和Cd等金属元素。
铁粉、30%(w)H2O2、NaOH:分析纯。
1.2 FePO4的制备
1.2.1 FePO4的制备原理
铁粉首先与废磷酸系刻蚀液中的硝酸、磷酸和部分醋酸反应生成Fe2+,硝酸转化为NO3-和NO,NO随后转化为NO2,磷酸逐步分解,反应方程式见式(1)~(3)。
随后加入氧化剂H2O2,一部分H2O2与Fe(H2PO4)2反应生成FePO4·2H2O,FePO4·2H2O煅烧后生成无水FePO4[5];另一部分H2O2与Fe2+组成芬顿试剂,将醋酸逐步氧化成甲醇、甲醛、甲酸等小分子物质,最终形成CO2和水[6],反应方程式见式(4)~(6)。
1.2.2 FePO4的制备方法
FePO4的制备在反应釜中进行。将40 mL废磷酸系刻蚀液与去离子水以体积比1∶5进行混合,在一定温度、搅拌转速为400 r/min的条件下预热10 min;向溶液中投加一定量的铁粉,反应30 min后,加入一定量的H2O2(以H2O2与反应液中磷酸的摩尔比进行投加),用浓度为10 mol/L的NaOH溶液调节pH,反应4 h,陈化5 h;将得到的沉淀过滤、洗涤、干燥,在一定温度下煅烧脱水,得到无水FePO4;滤液测定成分后重新注入反应釜,补加一定量的废刻蚀液和去离子水进行循环操作。考察铁磷摩尔比、反应温度、H2O2投加量、pH、煅烧温度对FePO4制备的影响。
1.3 分析与表征
采用DX-27mini型X射线衍射仪(丹东浩元仪器有限公司)分析FePO4的晶体结构;采用TM3030型扫描电子显微镜(日立高新技术公司)观察FePO4的形貌;采用Nano Measurer软件分析FePO4的粒径。
采用钼酸铵分光光度法[7]测定滤液中PO43-的质量浓度;采用紫外分光光度法[8]测定滤液中NO3-的质量浓度;采用NaOH标准溶液中和滴定法[9]测定滤液的总酸度,计算醋酸的质量浓度。
2 结果与讨论
2.1 影响FePO4制备的因素
2.1.1 铁磷摩尔比
图1为铁磷摩尔比对FePO4制备的影响。由图1a可见:当铁磷摩尔比为0.900~0.950时,NO3-、醋酸的去除率均大于90%,但PO43-的去除率较低,为74.29%~81.82%;当铁磷摩尔比为0.975~1.025时,PO4
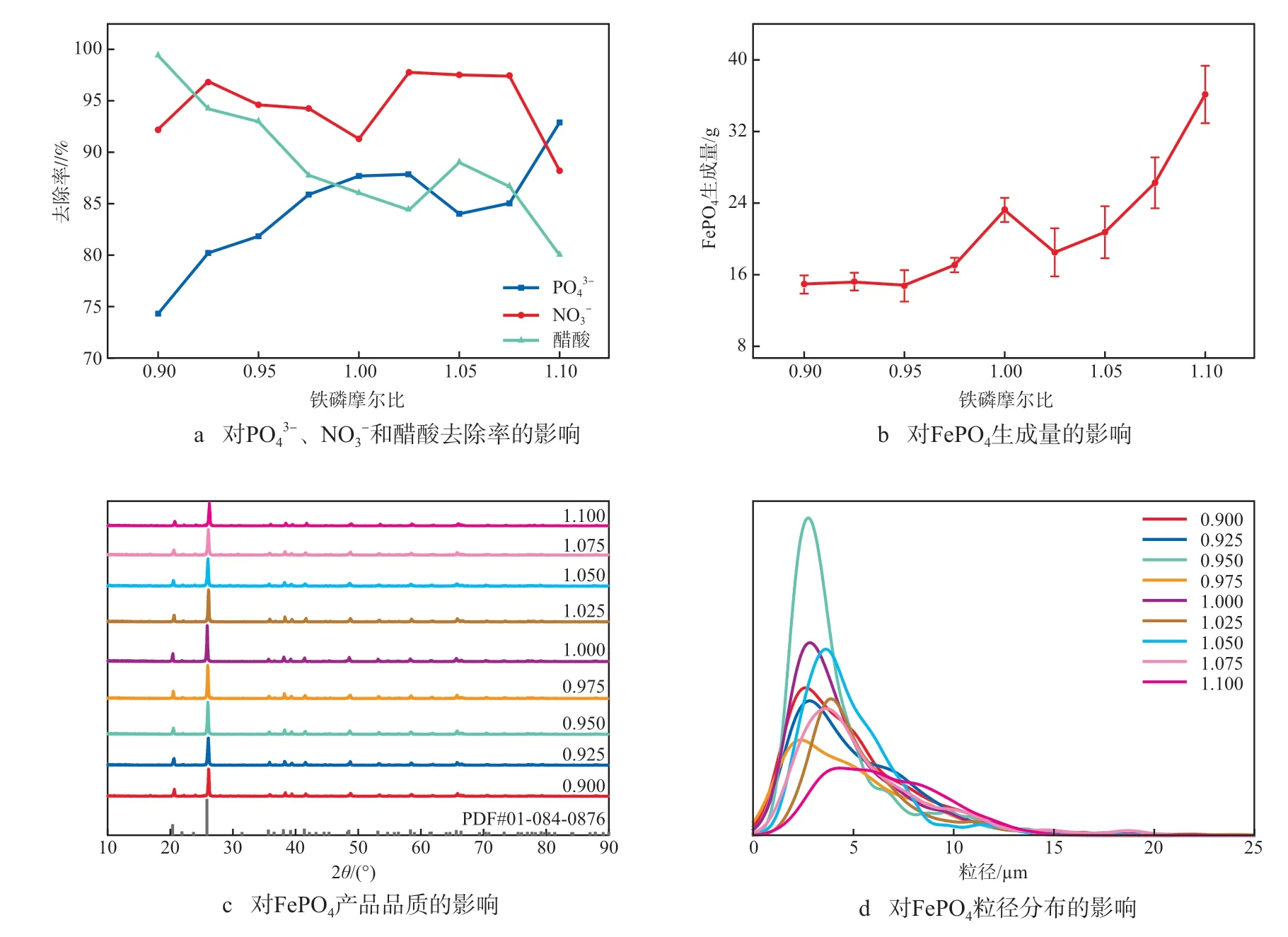
图1 铁磷摩尔比对FePO4制备的影响
3-去除率为85.87%~87.85%,NO3-去除率为91.29%~97.76%,醋酸去除率为86.38%~87.76%;当铁磷摩尔比大于1.025时,一方面NO3-、醋酸浓度有所上升,去除效果减弱,另一方面,溶液中PO43-和醋酸的去除率呈现出相反的变化趋势,表明FePO4生成与醋酸被氧化的反应可能存在竞争关系,因此,适宜的铁磷摩尔比为0.975~1.025。
由图1b可见:随着铁磷摩尔比的增大,FePO4的生成量不断增加;当铁磷摩尔比为1.000时,FePO4的生成量为23.24 g,经计算,此时FePO4的产品转化率74.74%;当铁磷摩尔比为1.100时,FePO4的生成量为36.14 g。
由图1c可见:FePO4的谱图与标准卡片01-084-0876图谱基本一致,衍射峰尖锐,特征峰明显,说明所制备的FePO4纯度较高,结晶度良好;当铁磷摩尔比为1.000时,FePO4的衍射峰强度最大;当铁磷摩尔比大于1.000时,FePO4衍射峰强度逐渐降低,表明FePO4的品质有所下降。
由图1d可见:FePO4产品的粒径总体分布在2.5~7.5 μm;当铁磷摩尔比为1.000~1.050时,FePO4颗粒较为均匀,平均粒径为2.5~5.0 μm。综上,选择最适宜的铁磷摩尔比为1.000。
2.1.2 反应温度
在铁磷摩尔比为1.000的条件下,考察反应温度对FePO4制备的影响,结果见图2。由图2a可见:反应温度低于90 ℃时,PO43-、NO3-和醋酸的平均去除率分别为86.95%、89.34%和88.63%;当反应温度为90 ℃时,PO43-、NO3-和醋酸的去除率分别为88.04%、91.76%和86.81%;当反应温度为100 ℃时,PO43-、NO3-和醋酸的去除率分别为89.87%、91.29%、86.12%。由图2b可见:随着反应温度的升高,FePO4的生成量不断增加,当反应温度为90℃时,FePO4的生成量为23.24 g,继续升高反应温度至100 ℃,FePO4的生成量变化不大。由图2c可见:当反应温度为90 ℃时,FePO4的衍射峰强度最强,峰型更加尖锐,表明该条件下所制备的FePO4品质最好。由图2d可见:当反应温度低于80 ℃时,FePO4的粒径分布范围较宽,为1~10 μm;随着反应温度的升高,FePO4成核速度加快且晶核数目增加,当反应温度为90 ℃时,FePO4的粒径分布范围变窄,为2.0~5.0 μm,颗粒更均匀;进一步升高反应温度,随着反应体系内黏度的增加,加剧了颗粒间的团聚作用,二次粒径增大[10],同时能耗也增大。综上,选择适宜的反应温度为90 ℃。
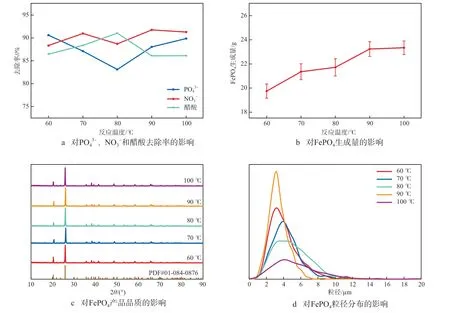
图2 反应温度对FePO4制备的影响
2.1.3 H2O2投加量
在铁磷摩尔比为1.000、反应温度为90 ℃的条件下,考察H2O2投加量对FePO4制备的影响,结果见图3。由图3a可见:当n(H2O2)∶n(H3PO4)为1.00时,PO43-、NO3-及醋酸的去除率分别为82.23%、97.34%和87.17%;当n(H2O2)∶n(H3PO4)为1.05时,及醋酸的去除率分别为83.39%、94.55%和90.25%;当n(H2O2)∶n(H3PO4)大于1.05时,及醋酸的去除率变化较大,平均去除率分别84.49%、86.74%和87.93%,这是因为过量的H2O2可能会生成过氧羟基自由基(·OOH)[11],这种自由基对磷酸分解、Fe2+氧化与FePO4生成均起到不利影响。由图3b可见:当n(H2O2)∶n(H3PO4)为1.05时,FePO4的生成量最多,为23.29 g,继续增加H2O2投加量,FePO4的生成量有所降低。由图3c可见:当n(H2O2)∶n(H3PO4)为1.00时,FePO4的特征峰与标准卡片01-084-0876相比有偏移,峰强较低,表明FePO4品质较差;当n(H2O2)∶n(H3PO4)为1.05~1.20时,FePO4特征峰的峰强较高,表明FePO4产品质量稳定;当n(H2O2)∶n(H3PO4)为1.20时,FePO4峰型变宽,表明FePO4产品质量变差。由图3d可见:H2O2的添加对FePO4粒径分布的影响较小,总体在2.5~7.5 μm,特别是当n(H2O2)∶n(H3PO4)为1.05~1.15时,颗粒分布更为均匀。综上,选择适宜的n(H2O2)∶n(H3PO4)为1.05。
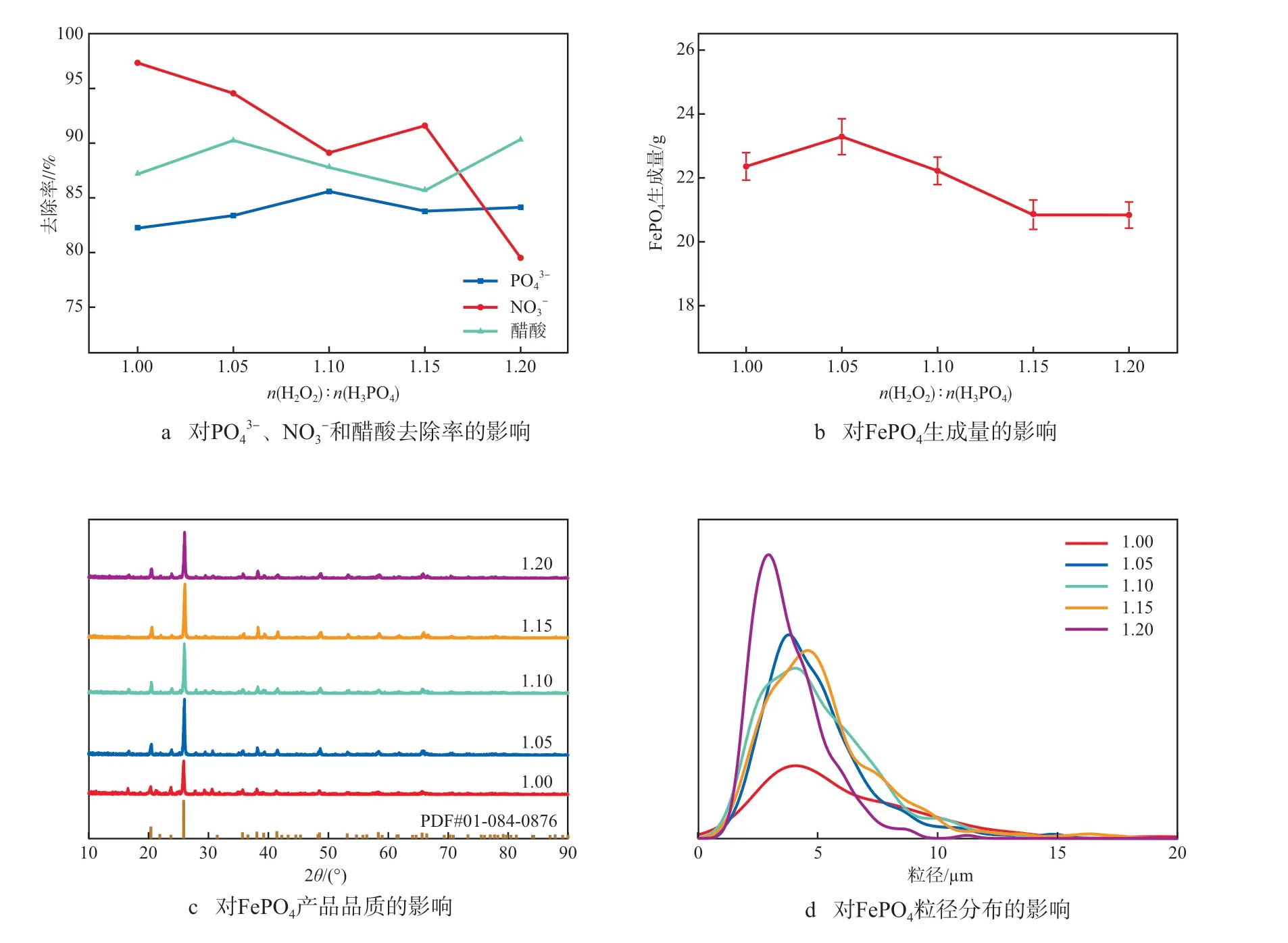
图3 H2O2投加量对FePO4制备的影响
2.1.4 pH
在铁磷摩尔比为1.000、反应温度为90 ℃、n(H2O2)∶n(H3PO4)为1.05的条件下,考察pH对FePO4制备的影响,结果见图4。有文献报道:当pH低于2.0时,溶液可能会生成杂质碱式磷酸铁(Fe3(PO4)2(OH)2);当pH为2.2~2.4时,碱式磷酸铁的生成受到抑制,适宜生成FePO4[12]。由图4a可见:当pH为2.2~2.4时,和醋酸的平均去除率分别为86.78%、89.75%和92.41%;pH升至2.6时,Fe3+的水解作用增强,FePO4·2H2O与Fe(OH)3同时生成,PO43-消耗量减少,浓度上升,和醋酸的去除率分别为85.26%、91.29%和94.40%。由图4b可见:随着pH的升高,FePO4的生成量不断增加,当pH为2.4时,FePO4的生成量最大,为24.35 g,继续增加pH至2.6,FePO4的生成量明显降低。由图4c可见:当pH为2.2~2.4时,FePO4的衍射峰强度最强,峰型尖锐,表明该条件下所制备的FePO4品质最好。由图4d可见:pH为1.8~2.0时,FePO4粒径为3.0~7.0 μm,此时较低的pH导致FePO4成核速度慢,反应时间长[13];pH在2.2~2.4时,FePO4颗粒粒径均匀,为2.0~5.0 μm;pH为2.6时,FePO4粒径为1.0~3.0 μm,此时除Fe(OH)3杂质外,刻蚀液中所含的其他重金属离子也可能会干扰FePO4晶体形成。综上,选择适宜的pH为2.2~2.4。
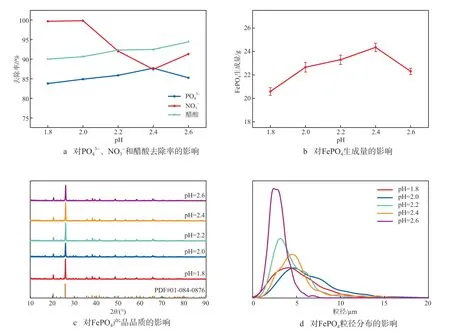
图4 pH对FePO4制备的影响
2.1.5 煅烧温度
在铁磷摩尔比为1.000、反应温度为90 ℃、n(H2O2)∶n(H3PO4)为1.05、pH为2.2~2.4的条件下,考察煅烧温度对FePO4制备的影响,结果见图5。由图5a可见:随着煅烧温度的升高,FePO4的生成量逐渐降低,煅烧温度为450 ℃、600℃、750 ℃和900 ℃时,FePO4的生成量分别为24.73,24.25,23.78,21.94 g。由图5b可见:煅烧温度为450 ℃时,所生成的FePO4没有表现出FePO4的特征峰,这是因为该条件下样品中的结晶水尚未完全脱除;当煅烧温度高于600 ℃时,FePO4特征峰明显可见,该条件下,FePO4会从单斜晶系转变为六方晶系或α-石英型晶系,这种结构上的转变有利于锂离子嵌入到FePO4中,生成由图5c可见:煅烧温度对FePO4粒径分布的影响较小,FePO4粒径基本在1.0~10.0 μm。
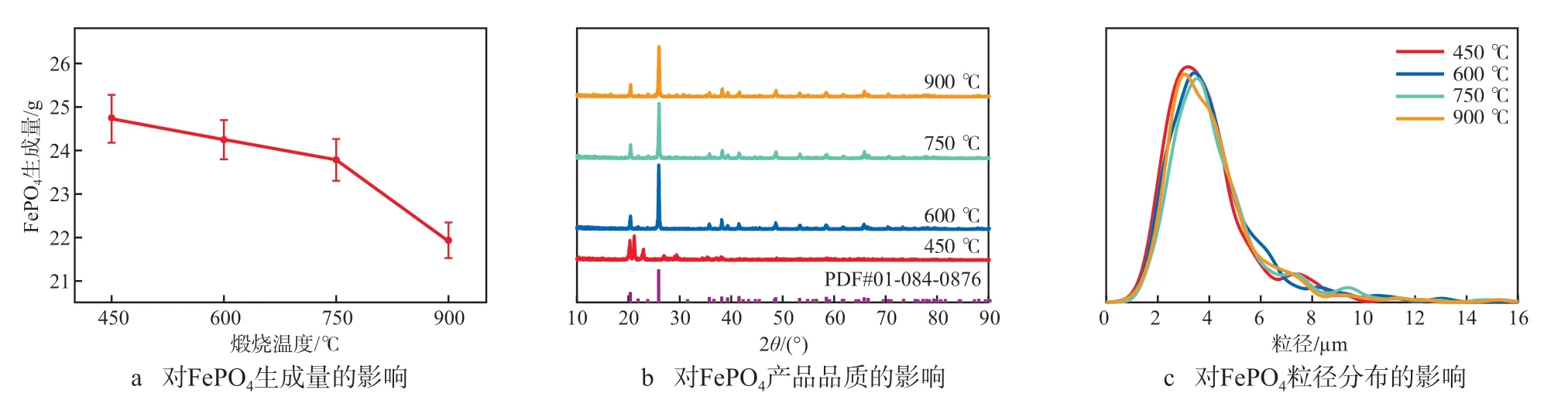
图5 煅烧温度对FePO4制备的影响
图6为不同煅烧温度下FePO4的SEM照片。由图6可见:煅烧温度为450 ℃时,FePO4中大部分颗粒呈类球状,仅部分颗粒初具晶体形态;600 ℃时,FePO4颗粒的晶体结构规则,大小均匀,形貌清晰;750 ℃时,颗粒粒径略微增大,晶体规则,但少许大颗粒出现裂纹,团聚现象较为明显;900 ℃时,颗粒破裂的现象较为严重,同时有很多细小颗粒附着在较大晶体的表面,影响FePO4的品质。综上,选择适宜的煅烧温度为600 ℃。

图6 煅烧温度为450 ℃(a)、600 ℃(b)、750 ℃(c)和900 ℃(d)时FePO4的SEM照片
综上所述,采用废磷酸系刻蚀液制备FePO4的最佳工艺条件为:铁磷摩尔比为1.000、反应温度为90 ℃、n(H2O2)∶n(H3PO4)为1.05、pH为2.2~2.4、煅烧温度为600 ℃。
2.2 实际应用
在最佳工艺条件下,利用废磷酸系刻蚀液制备FePO4,结果见表1、表2和图7。由表1可见:废磷酸系刻蚀液中PO43-、NO3-和醋酸的去除率分别为87.70%、87.42%和90.25%。由表2可见:自制样品中铁磷质量分数、铁磷摩尔比、杂质元素含量均满足《电池用磷酸铁》(HG/T 4701—2021)[16]的要求。在废磷酸系刻蚀液用量为40 mL、铁粉投加量为11.51 g的条件下,FePO4的理论生成量为31.09 g,实际生成量为24.25 g,产品转化率为77.99%。
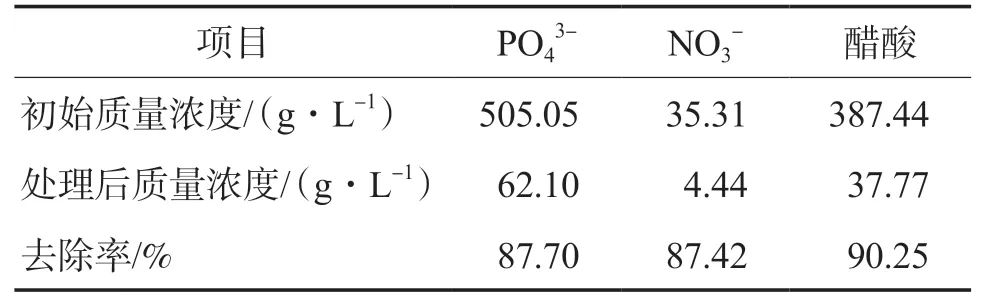
表1 废磷酸系刻蚀液中各组分的去除效果
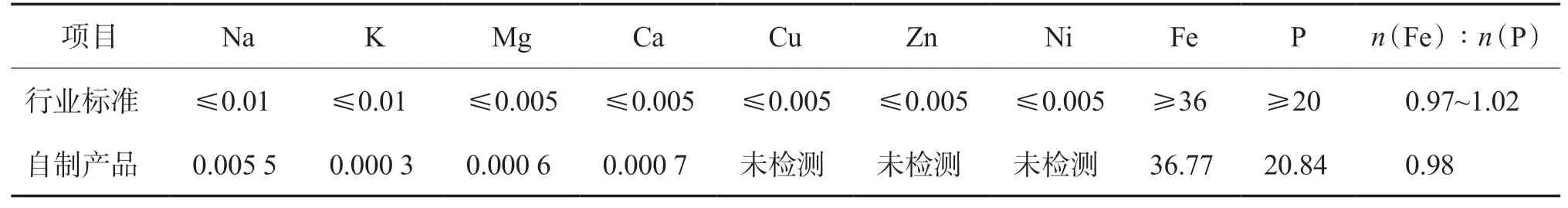
表2 FePO4的品质指标 w,%

图7 FePO4产品的SEM照片
由图7可见,所制备的FePO4产品晶体结构规则,颗粒粒径在2.0~6.0 μm,满足制备LiFePO4的要求。
3 结论
a)采用废磷酸系刻蚀液制备FePO4的最佳工艺条件为:铁磷摩尔比1.000、反应温度90 ℃、n(H2O2)∶n(H3PO4)为1.05、pH为2.2~2.4、煅烧温度600 ℃。在该条件下,废磷酸系刻蚀液中醋酸的去除率分别为87.70%、87.42%和90.25%,FePO4产品转化率为77.99%。所制备的FePO4晶体结构规则,粒径为2.0~6.0 μm,铁、磷质量分数和杂质元素含量等指标均满足《电池用磷酸铁》(HG/T 4701—2021)的要求。
b) 以废磷酸系刻蚀液为原料、铁粉为铁源、H2O2为氧化剂,采用氧化沉淀法一步制备电池级FePO4,既可以生产高附加值的FePO4,解决FePO4的供应问题,又能够降低废刻蚀液对环境与生态的风险,为废磷酸系刻蚀液的回收利用提供了一条新途径。

