泛癌中CCL18的差异表达、预后及其与免疫细胞浸润的相关性分析
董明右,王俊利,廖陆升,陈祥凤,罗艳红,吴艳柳
(1.右江民族医学院医学检验学院,广西 百色 533000;2.右江民族医学院生物医药与大健康现代产业学院,广西 百色 533000)
CCL18是来自β-趋化因子亚家族成员,它在N端具有-Cys-Cys-motif,主要在乳腺肿瘤相关巨噬细胞(TAMs)中表达,其别名包括:CKb7、PARC、AMAC1、DCCK1、MIP-4、AMAC-1、DC-CK1和SCYA18[1-5]。在多种癌症中已经观察到CCL18的上调,例如口腔鳞状细胞癌[6]、喉部鳞状细胞癌[7]、卵巢上皮细胞癌[8]、肺癌[9]、卵巢癌[10]和乳腺癌[11]。CCL18的高表达与癌症患者的较差生存率是相关的[6-8]。CCL18已经被证明在肿瘤微环境[12-13],上皮间质转化和转移[8-9,11,14]、肿瘤增殖[15]和血管生成[16]中发挥着重要的作用。然而,CCL18在肿瘤免疫学中的潜在机制仍不清楚。癌症是一种涉及肿瘤与免疫系统相互作用的复杂疾病,肿瘤微环境(TME)也已被公认为癌症发生和发展的主要因素[17]。采用细胞疗法、治疗性疫苗、免疫检查点抑制剂等治疗策略提高了恶性肿瘤患者的存活率[18]。许多研究表明,TME中各种浸润性免疫细胞的积累直接关系到患者的预后和免疫治疗效果,如肿瘤相关巨噬细胞、中性粒细胞、调节性T细胞、B细胞和自然杀伤细胞等,它们可以在癌症免疫逃逸中发挥重要作用[19-21]。免疫检查点(IC)与其配体之间的相互作用负向调节参与针对特定抗原的生理免疫反应的T细胞活化途径[22]。ICs及其配体在各种恶性肿瘤的肿瘤微环境 (TME) 中经常被上调以实现肿瘤免疫逃避[23]。
本研究分析了CCL18在泛癌中的表达模式、临床意义和预后价值。还分析了CCL18表达与潜在分子机制、肿瘤浸润免疫细胞、免疫相关基因、免疫新抗原、免疫检查点基因、癌症中TMB和微卫星不稳定性的关系。还研究了CCL18表达是否影响泛癌中DNA修复相关基因和DNA甲基化转移酶相关基因的表达。同时,还进行了基因集富集分析(GSEA)来研究CCL18在不同类型肿瘤中的生物学功能和信号转导通路。研究结果揭示了CCL18在癌症中的可能作用,表明CCL18是一种潜在的预后生物标志物。
1 材料与方法
1.1数据收集及整理 从GTEx数据库(https://gtexportal.org/)获得31个正常组织的CCL18表达数据,并通过 TCGA数据库(https://portal.gdc.cancer.gov/)下载所有癌症的临床信息和表达矩阵。21个肿瘤细胞系的CCL18表达数据从CCLE数据库(https://portals.broadinstitute.org/)获得。通过将来自the GTEx database的正常组织数据与the Cancer Genome Atlas(TCGA)的数据相结合,分析了癌症和正常组织之间CCL18表达的差异。所有表达数据均通过log2转换进行标准化。并使用limma R package进行差异表达分析。
1.2CCL18表达水平与生存或临床病理特征的相关性分析 单因素回归分析被用于分析33种癌症类型中CCL18表达水平与患者预后之间的相关性。用于患者预后的术语包括以下四个:总生存期(OS)、疾病特异性生存期(DSS)、无进展间隔期(PFI)和无疾病间隔期(DFI)。单变量生存分析用于计算危险比(HR)和95%置信区间。使用Log-rank test研究了CCL18表达与临床病理特征(年龄、性别和病理阶段)的相关性。在泛癌样本中检测6种免疫类型(C1~C6)。调整后的P<0.05被认为是显著的。
1.3CCL18表达与免疫相关因子的相关性 使用CIBERSORT[24]计算28种免疫细胞亚型的浸润比例,这是预测免疫细胞表型的工具。使用MCPCOUNTER、QUANTISEQ、TIMER和XCELL的算法对其进行了验证。使用ggplot2,ggpubr 和 ggExtra R packages分析CCL18 表达与免疫细胞浸润之间的相关性,P<0.001被用作截止值。使用ESTIMATE algorithm[25]计算所有癌症组织的免疫评分、基质评分和ESTIMATE评分。通过Spearman’s method分析CCL18表达水平与免疫评分、基质评分和ESTIMATE评分的相关性。P<0.05和|R|>0.3被视为筛选标准标准,并且|R|>0.6被认为是强相关的。此外,对CCL18和免疫相关基因进行了共表达分析,包括编码主要组织相容性复合体(MHC)、免疫激活、免疫抑制、趋化因子和趋化因子受体蛋白的基因,“limma”、“reshape2”和“RColorBreyer”R包被用于结果的可视化。
1.4CCL18表达与免疫新抗原和免疫检查点的相关性 肿瘤细胞中由突变基因编码的新抗原,主要由点突变、缺失突变和基因融合等生物学事件产生。使用scanneo R package分别统计每个肿瘤样本的新抗原数量,并分析CCL18表达与抗原数量的关系。此外,收集了40多个免疫检查点基因,并使用Spearman统计方法分析了CCL18基因表达与免疫检查点基因表达之间的关系。相关热图由reshape2和RColorBrewer R包绘制。
1.5CCL18与肿瘤突变负荷和微卫星不稳定性的相关性 肿瘤突变负荷(TMB)作为可量化的生物标志物,可用于反映肿瘤细胞中包含的突变数量[26]。微卫星不稳定性(MSI)是指与正常组织相比,在肿瘤中,由于重复单元的插入或缺失引起的微卫星长度的任何改变,都会出现新的微卫星等位基因现象[27]。在这里,本研究通过the Maftools R包分别计算了每个肿瘤样本的TMB和MSI,并基于Spearman统计方法分析了CCL18表达与TMB和MSI之间的关系。
1.6CCL18与DNA错配修复相关基因及DNA甲基转移酶相关基因的相关性 从TCGA数据库获得5个错配修复(MMR)基因(MLH1、MSH2、MSH6、PMS2和EPCAM)的突变水平。Spearman统计方法用于评估CCL18表达与MMR基因突变水平之间的关系。在本研究中,使用Spearman统计方法来估计CCL18表达与4种甲基转移酶(DNMT1、DNMT2、DNMT3A和DNMT3B)之间的关系。可视化分析由the ggplot R package执行。当P<0.05和|R|>0.20时,相关性被认为是显著的。
1.7功能富集分析 本研究计算了不同癌症组织的50个hallmark信号通路的GSVA评分,并使用Spearman统计方法来估计CCL18表达与这些途径评分之间的相关性(FDR<0.05)。
1.8统计学方法 Kruskal Wallis test用于分析CCL18在不同正常组织和不同肿瘤细胞系中的表达水平。在评估肿瘤组织和正常组织中CCL18表达水平的差异时,如果数据服从正态分布,采用t检验进行统计;如果数据不服从正态分布,采用Wilcoxon秩和检验。使用Log-rank test研究了CCL18表达与临床病理特征(年龄、性别和病理阶段)的相关性。采用Univariate survival分析CCL18表达与患者生存的相关性。The Spearman rank用于计算CCL18表达与肿瘤突变负荷、微卫星不稳定性、MMR基因突变水平、甲基转移酶水平和免疫检查点标志物水平之间的关系。当P<0.05和|R|>0.20时,被认为是显著且正相关的。对于所有统计分析,P<0.05 被认为差异具有统计学意义。
2 结果
2.1CCL18在泛癌中的差异表达 首先,本研究使用GTEx数据库分析了31个组织中CCL18的表达。研究发现CCL18在肺癌中高表达,在骨髓、大脑、子宫颈、肌肉和其他正常组织中低表达(见图1A)。此外,从CCLE数据库中下载了肿瘤细胞系的数据,并分析了21个肿瘤细胞中CCL18的表达。研究发现CCL18在所有 21 种肿瘤细胞中均有表达(见图1B)。为了确定肿瘤和正常组织中CCL18表达的差异,使用TCGA数据库分析了20种癌症类型的不同肿瘤和正常组织中的CCL18 mRNA水平。结果显示,BLCA、CHOL、COAD、ESCA、GBM、HNSC、KICH、KIRC、KIRP、LGG、LIHC、PRAD、STAD、THCA和UCEC中的CCL18 mRNA水平显著高于正常组织(见图1C)。考虑到TCGA中正常样本数量较少,本研究整合了GTEx数据库和TCGA数据库,分析了CCL18在27种癌症类型中的表达差异。本研究发现CCL18在24种肿瘤中存在显著差异表达,包括 BLCA、BRCA、CESC、CHOL、COAD、ESCA、GBM、HNSC、KICH、KIRC、KIRP、LAML、LGG、LIHC、LUSC、OV、PAAD、PRAD、SKCM、STAD、TGCT、THCA、UCEC 和 UCS(见图1D)。这些结果表明CCL18在人类泛癌中异常过表达。
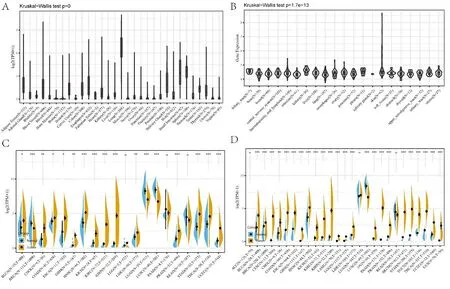
注:A.CCL18在包含31个组织的数据集中的表达水平,来源于GTEx;B.CCL18在包含21个组织的肿瘤细胞系的数据集中的表达水平,来源于CCLE数据库;C.CCL18在肿瘤和配对的邻近非癌症组织中的表达水平,包含20个组织,来自TCGA;D.整合GTEx数据库中正常组织数据和TCGA肿瘤组织数据的27个肿瘤中CCL18的表达差异。*P<0.05,**P<0.01,***P<0.001。
2.2CCL18与肿瘤临床特征及预后的相关性 使用TCGA dataset研究CCL18在泛癌预后中的作用。使用单因素回归分析CCL18-related survival OS,DSS,DFI和 PFI。结果发现,CCL18表达水平与ACC中的DFI相关,与ACC、CESC、DLBC、KIRP和UVM中的DSS相关,与ACC、DLBC和UVM中的OS相关,与ACC、CESC、KIRP和LGG中的PFI相关(见图2A~图2D)。同时,CCL18在UCS、OV、SARC、COAD、STAD和LUAD的老年患者中差异高表达,而在BRCA老年患者中表达较低(见图3A)。LAML、LGG、KIRP、KIRC 的男性中CCL18表达较高(见图3B)。此外,CCL18表达与某些癌症的肿瘤分期显著相关,包括CHOL、KICH、BLCA、THCA、COAD和KIRP(见图3C)。还研究了CCL18表达与泛癌中6种免疫亚型的关联。结果表明,CCL18与17种癌症类型的免疫亚型密切相关,包括BRCA、CHOL、UCS、KICH、PCPG、STAD、TGCT、UVM、CESE、BLCA、LIHC、UECE、SARC、COAD、READ、LUAD和LUSC(见图3D)。
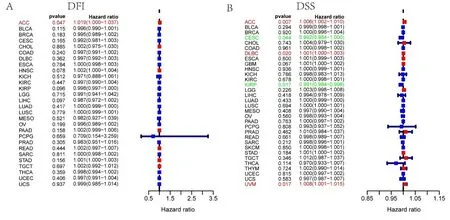
注:A为DFI;B为DSS;C为OS;D为PFI。红色表示CCL18属于风险基因。绿色表示CCL18是一个保护基因。
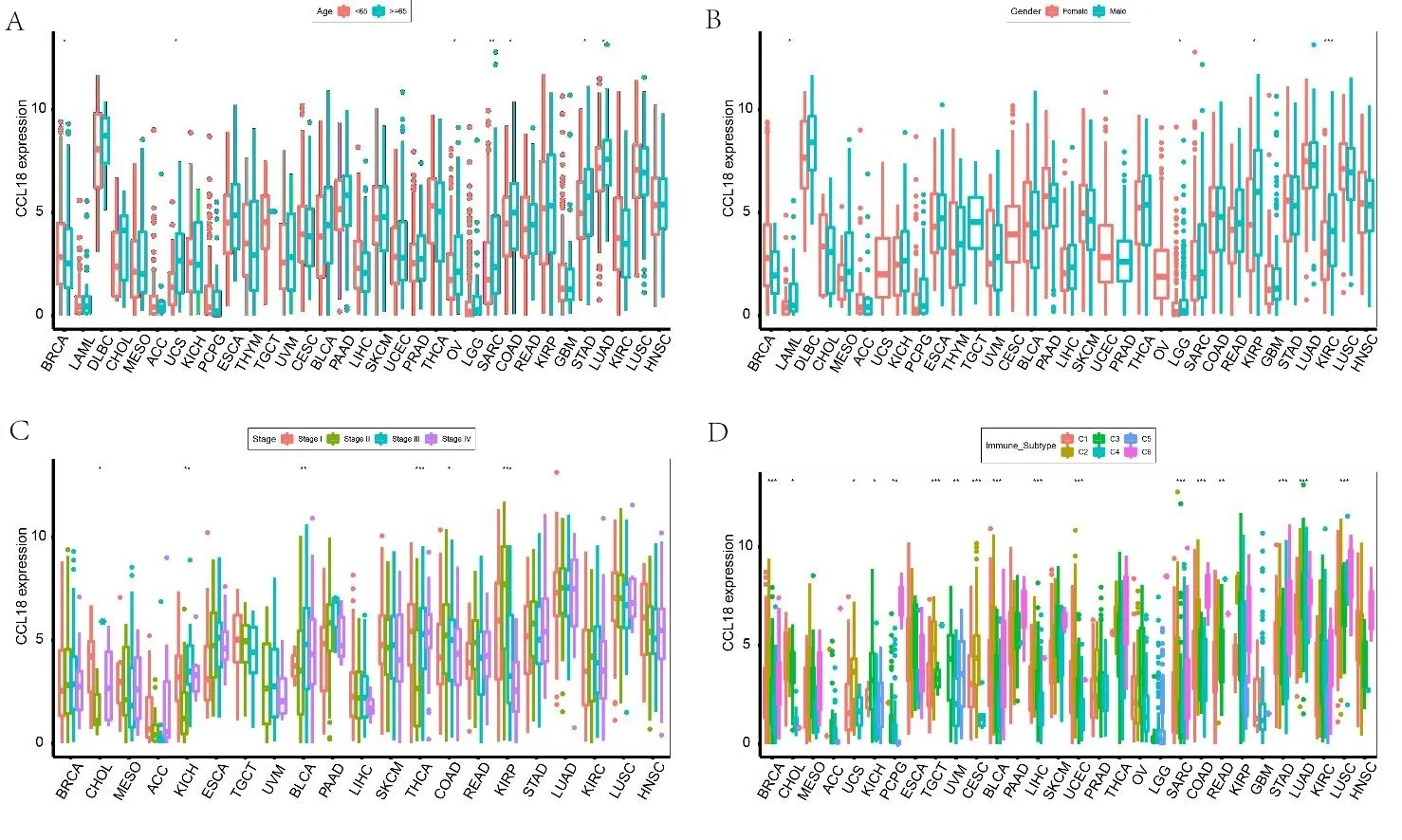
注:A.年龄与CCL18的相关性;B.性别与CCL18的相关性;C.肿瘤分期与CCL18的相关性;D.CCL18表达与免疫浸润亚型的关系。
2.3CCL18与免疫细胞浸润、免疫相关通路和免疫微环境的关系 本研究评估了CCL18表达与免疫细胞浸润,免疫相关通路,免疫微环境的关系。使用Sangerbox在线分析平台进一步分析28种免疫细胞亚型浸润与CCL18表达的相关性。除LAML和LGG外,CCL18表达水平与大多数浸润性免疫细胞水平显著相关,特别是在B细胞、CD4+T细胞、CD8+T细胞、树突状细胞、巨噬细胞、中性粒细胞、调节性T细胞、自然杀伤细胞和滤泡辅助T细胞中(见图4A)。随后,研究了33个肿瘤中CCL18表达与免疫相关通路之间的关联。在许多恶性肿瘤中,CCL18表达与APM,CD8 T效应器、免疫检查点、Pan F TBRs和TMEscoreA CIR途径呈正相关,但是与碱基切除修复、细胞周期、DDR、FGFR3相关、同源重组、组蛋白、错配修复、核苷酸切除修复和WNT目标途径呈负相关。此外,在PAAD、UVM、CHOL、COAD、READ、LUSC、ESCA、HNSC、KICH、OV、LIHC和LUAD中,CCL18表达与EMT1、EMT2、EMT3、pan F TBR和TMEscoreB CIR通路呈正相关(见图4B)。CCL18表达水平与除 LAML、LGG以外的31种癌症的免疫评分、25种癌症类型的基质评分和除LAML、LGG、THYM 以外的30种癌症类型的ESTIMATE score呈正相关(见图4C)。

注:A.CCL18的表达与泛癌中的免疫浸润水平的相关性;B.泛癌中CCL18的表达与免疫相关途径的相关性;C.CCL18的表达与肿瘤环境的相关性。
2.4CCL18与免疫激活剂、免疫抑制剂、趋化因子及趋化因子受体的相关性 本研究通过基因共表达分析在33个肿瘤中评估了免疫相关基因与CCL18表达的相关性。结果表明,除LAML和LGG外,大多数癌症中CCL18基因表达与CD244、CD274、CD96、CSF1R、CTLA4、HAVCR2、IL10、PDCD1LG2、TIGIT等免疫相关基因密切相关(见图5A)。在除DLBC、GBM、KIRC、LAML、THYM、ACC和LGG之外的大多数癌症中,CCL18基因表达与MHC显著相关,包括HLA-DMA、HLA-DMB、HLA-DOA、HLA-DOB、HLA-DPA1、HLA-DPB1、HLA-DQA1、HLA-DQB1(见图5B)。在除THYM、LAML和LGG之外的大多数癌症中,CCL18基因表达与包括CCR1、CCR2、CCR4、CCR5、CCR7、CCR8、CXCR3、CXCR4、CXCR6、XCR1在内的趋化因子受体密切相关(见图5C)。在许多癌症中,CCL18基因表达与包括CD27、CD28、CD48、CD80、CD86、ICOS、IL2RA、TNFRSF8、TNFRSF9、TNFSF13B、TNFSF14在内的免疫激活基因呈正相关(见图5D)。在BLCA、COAD、READ、DLBC、TGCT、HNSC、LUSC、STAD、UCEC、CESC、ESCA、CHOL、UVM、BRCA和UCS中,CCL18基因表达与趋化因子密切相关,包括CXCL10、CCL3、CCL4、CCL5、CCL8、CCL13(见图5E)。
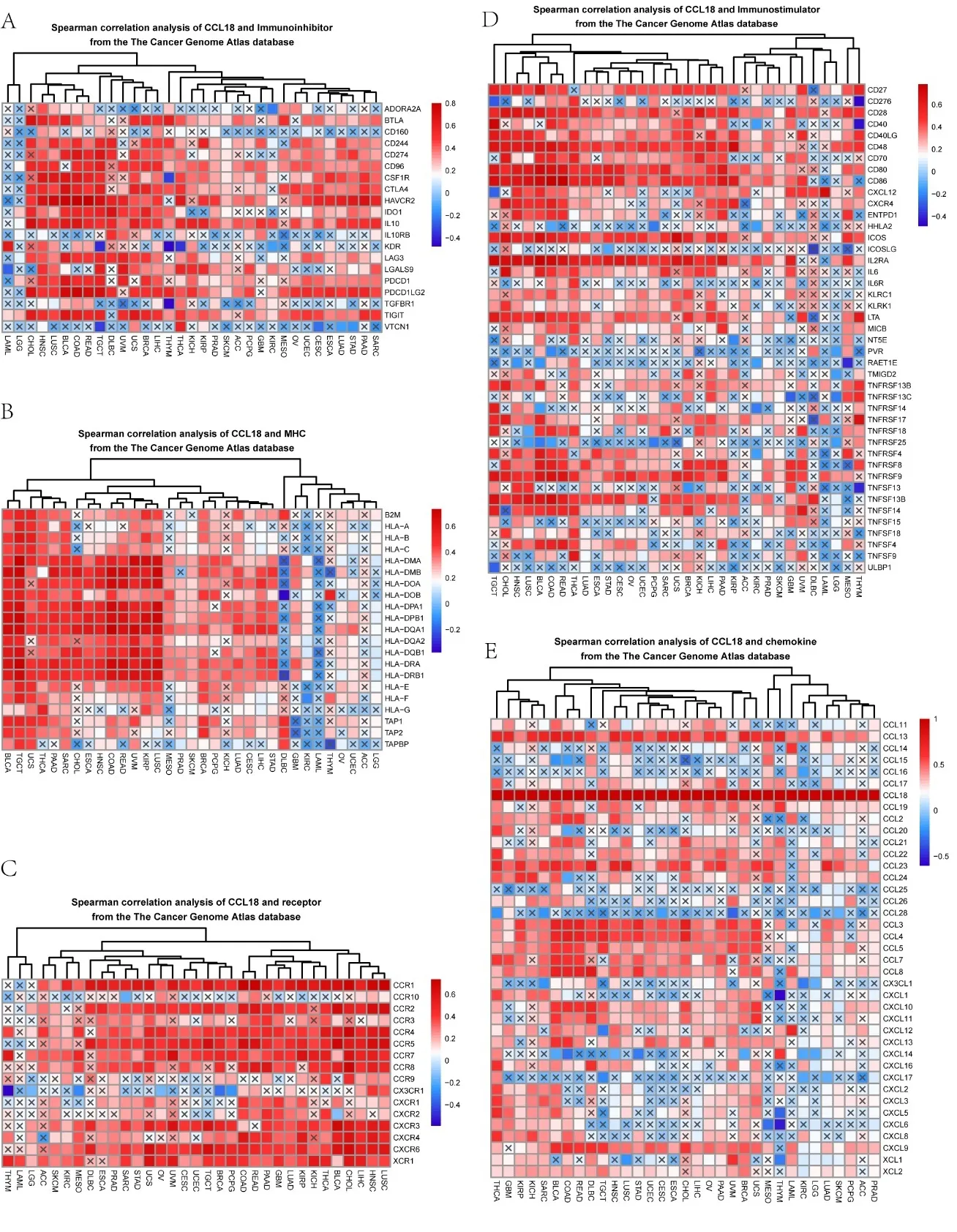
注:A.泛癌中CCL18的表达与免疫抑制物水平的相关性;B.CCL18的表达和MHC在泛癌中的相关性;C.泛癌中CCL18的表达与受体之间的相关性;D.泛癌中CCL18的表达与免疫刺激物水平的相关性;E.泛癌中CCL18的表达与趋化因子的相关性。
2.6CCL18与肿瘤突变负荷和微卫星不稳定性的相关性 肿瘤突变负荷(TMB)和微卫星不稳定性(MSI)被认为是影响肿瘤发生和进展的重要因素。本研究分析了33种常见癌症中TMB与CCL18表达的相关性,以探讨泛癌中CCL18活性与突变之间的关系。结果表明,在GBM、LIHC和THYM中,CCL18表达与TMB呈负相关。而在BLCA、BRCA、COAD、LAML、OV、PRAD、SARC、STAD、UCEC和UCS中,CCL18表达与TMB呈正相关(见图6A)。也发现COAD中CCL18表达与MSI呈正相关。而在HNSC、KIRC、LGG、LIHC、LUAD、LUSC和TGCT中,CCL18表达与MSI呈负相关(见图6B)。
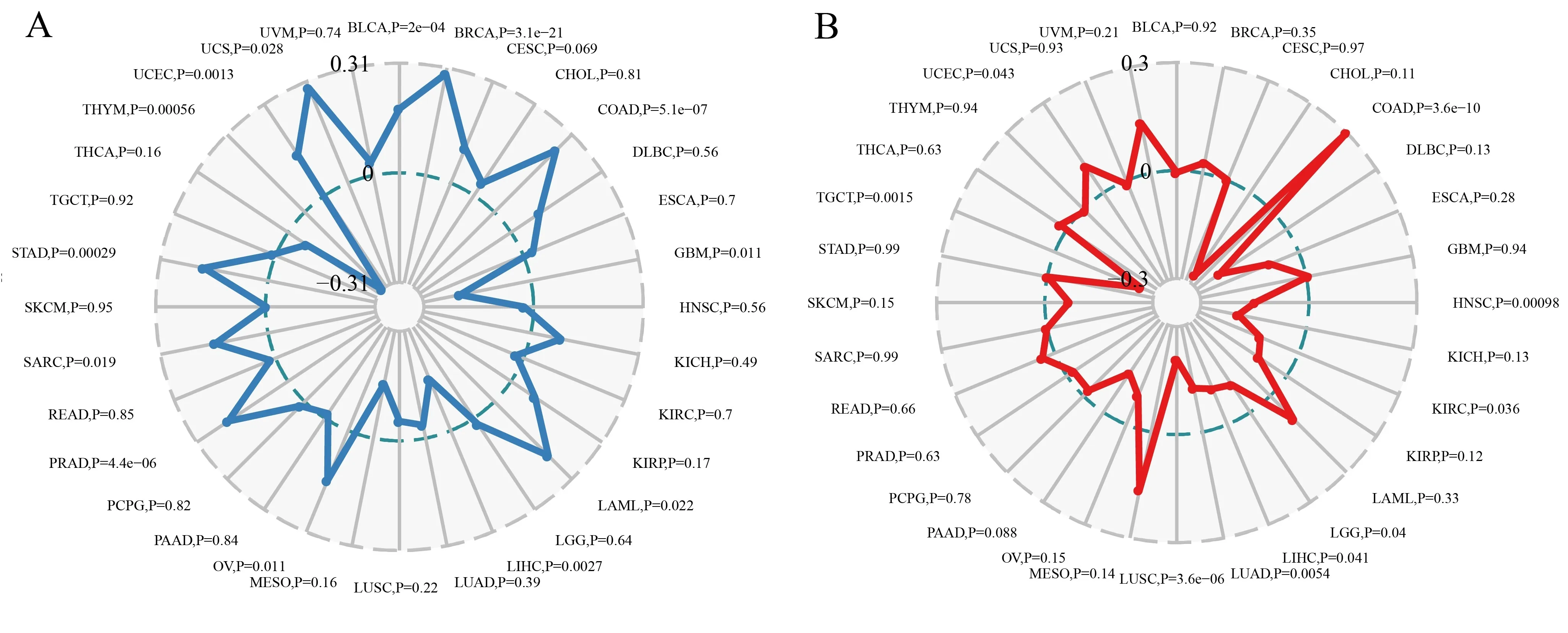
注:A.使用Spearman’s rank相关系数描述泛癌和TMB中CCL18表达的相关分析结果;B.使用Spearman’s rank correlation coefficient描述CCL18在泛癌和MSI中的表达的相关分析结果。
2.7CCL18表达与DNA错配修复相关基因及DNA甲基转移酶相关基因的相关性 为了评估CCL18在肿瘤发生中的作用,本研究分析了CCL18表达与DNA错配修复相关基因之间的相关性。结果表明,CCL18的表达与BRCA、COAD、HNSC、KIRP、LUAD、LUSC和THCA的5个MMR基因突变水平相关(见图7A)。结果发现接下来研究了CCL18表达与4种DNA甲基转移酶表达之间的相关性,结果发现CCL18表达与BLCA、BRCA、COAD、HNSC、LUAD、LUSC、PRAD、SKCM、STAD、TGCT和THCA中的DNA甲基转移酶表达密切相关(见图7B)。
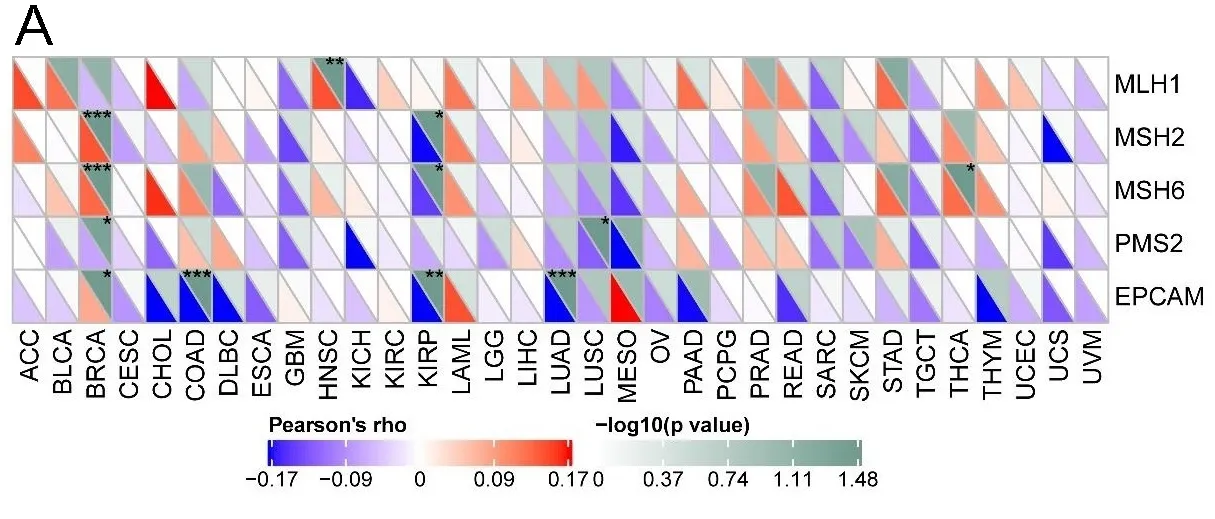
注:A.5个MMR的基因表达水平与CCL18表达的相关性分析;B.CCL18的表达与4种甲基转移酶的表达之间的相关性分析。DNMT1被染成红色,DNMT2被染,成蓝色DNMT3a被染成绿色,DNMT3b被染成紫色。
2.8泛癌中CCL18参与的信号通路 为了研究CCL18在癌症中的作用机制,计算了每位癌症患者的这50条通路的GSVA评分。结果发现大多数通路富集水平与多种癌症类型的异体移植排斥反应、血管生成、细胞凋亡、凝血、补体、上皮间质转化、IL2 STAT5标志、IL6 JAK STAT3标志、炎症反应、α干扰素反应、γ干扰素反应、KRAS信号传导等信号通路正相关(见图8)。
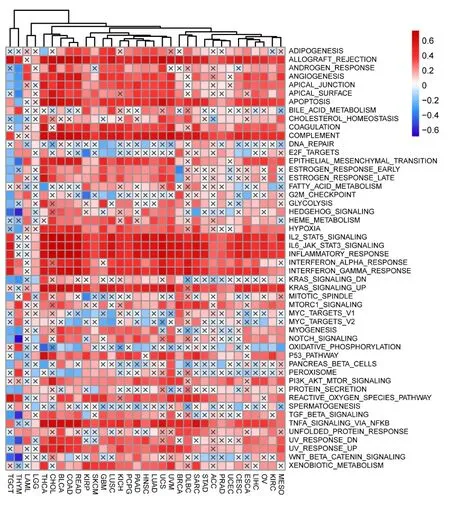
图8 不同癌症中CCL18和50条信号通路之间的关系
3 讨论
CCL18是以两个相邻的半胱氨酸为特征的蛋白质,该基因编码的细胞因子对新生T细胞、CD4+和CD8+T细胞和非活化淋巴细胞显示趋化活性,但对单核细胞或粒细胞不显示趋化活性。已有研究表明在癌症病人中,CCL18促进EMT[14]、细胞生长和转移[15]、和肿瘤进展[16]。尽管CCL18已在多种癌症中得到广泛研究,但其在泛癌中的作用以及是否可以用作生物标志物仍是未知数。本研究是基于TCGA数据库对恶性肿瘤中的CCL18进行了泛癌分析。
本研究发现了CCL18在24种肿瘤中存在差异表达。根据文献检索结果,在许多癌症患者中发现了较高的CCL18表达[6-8]。通过使用单因素回归分析表明,CCL18与CESC和KIRP具有更好的生存率,ACC、DLBC、LAML、UVM、CESC和LGG与更差预后相关。已有研究表明CCL18的高表达与口腔鳞状细胞癌[6],喉部鳞状细胞癌[7]和上皮性卵巢癌[8]更差的预后是相关的,这些结果与本次研究结果一致。
本次研究了CCL18与各种临床参数之间的相关性,年龄包括BRCA、STAD、UCS、OV、COAD、SARC和LUAD,性别包括LAML、LGG、KIRP、KIRC,肿瘤分期包括CHOL、KICH、BLCA、THCA、COAD和KIRP都具有显著差异。这与之前的调查结果一致,CCL18 的表达与气喘病的年龄[28];慢性阻塞性肺部疾病的性别[29];乳腺癌[30]、喉鳞状细胞癌[7]、口腔鳞状细胞癌[31-32]、膀胱癌[14]、头颈部鳞状细胞癌[33]、黑色素瘤[34]和卵巢癌[35]的分期具有相关性。最近的一项研究报告称,癌症患者可分为6种免疫亚型:C1-C6[36]。本研究发现CCL18的高表达与更具攻击性的C1、C2、C3和C6亚型密切相关。
本研究还发现CCL18表达水平与大多数癌症中28种免疫细胞的浸润水平显著相关。晚期HCC患者中富含CCL18高表达的M2巨噬细胞亚群,可能参与肿瘤进展[37]。CCL18的过表达与炎症和免疫反应有关,与巨噬细胞丰度有关[38]。降低PITPNM3(一种CCL18受体)的表达,能够阻断初始CD4+T细胞募集到肿瘤,显著抑制乳腺癌的肿瘤进展[13]。CCL18可作为一种趋化信号,促进未成熟的树突状细胞与原始的T淋巴细胞在 IL-10-dominated的环境中共定位,从而产生调节T细胞[39],这些研究报道与本研究结果一致。还研究了在33个肿瘤中CCL18表达与免疫相关通路的相关性,结果发现CCL18表达与10种免疫相关通路呈正相关,包括APM、CD8 T effector、Immune checkpoint、Pan F TBRs、TMEscoreA CIR、EMT1、EMT2、EMT3、pan F TBRs和TMEscoreB CIR路径;CCL18表达与9种免疫相关通路呈负相关,包括base excision repair、cell cycle、DDR,FGFR3 related、homologous recombination、Histones、mismatch Repair、nucleotide excision repair和WNT target pathways。已有报道[40]表明,随着CCL18表达的增加大多数免疫反应以及免疫相关途径都被激活。根据TCGA数据确定了CCL18水平与免疫评分、基质评分和ESTIMATE评分相关。这表明CCL18可能能够改变肿瘤微环境或肿瘤免疫细胞浸润程度。此外,为了进一步证明CCL18与免疫之间的关系,本研究发现在大多数癌症中CCL18表达水平与免疫相关基因呈正相关。大多数癌症中T细胞功能受损是癌细胞逃避保护性抗肿瘤免疫的主要原因,尽管CCL18调节免疫的机制尚未得到实验证实,但在理论上用CCL18抑制剂是可行的[13,41-42]。
免疫检查点抑制剂如CTLA4抑制剂和PD-1抑制剂已被证明对多种癌症患者的生存有显著的积极影响[43-44]。在进一步分析中还发现,CCL18可能通过调节特定免疫检查点基因的表达来调节BLCA、BRCA、CESC、COAD、HNSC、LGG、LIHC、PRAD、READ、STAD、THCA和UCEC等各种肿瘤的肿瘤免疫模式。CCL18表达与BRCA、UCEC、STAD和PRAD中的免疫新抗原有关。还发现CCL18表达与TMB以及微卫星不稳定性之间存在相关性。有研究报道[40],CCL18的高表达分组MSI、dMMR、TMB比例相对较高,这与本研究结果一致。DNA错配修复系统在维持遗传物质的完整性和稳定性以及避免基因突变的产生方面发挥了重要作用[45]。本研究发现CCL18表达与BRCA、COAD、HNSC、KIRP和LUAD中的DNA错配修复相关基因呈正相关。此外,CCL18表达与BLCA、BRCA、COAD、HNSC、LUAD、LUSC、PRAD、SKCM、STAD、TGCT和THCA中的甲基化转移酶相关基因呈正相关。以上结果表明,CCL18可能通过调节DNA错配修复相关基因和DNA甲基化转移酶相关基因的表达水平,在肿瘤发生中发挥重要作用。
最后,通过GSEA富集分析分析CCL18在肿瘤中的生物学功能,发现CCL18富集在大多数信号相关通路中。CCL18暴露诱导人脐带血管内皮细胞中的内皮细胞-间质转化并激活ERK和Akt/GSK-3β/Snail信号传导,从而促进其促血管生成作用[16]。CCL18及其共表达基因富集与细胞增殖、迁移、凋亡等生物学功能、NF-κB、癌症通路、PI3K-AKT通路相关[46]。miR-484在胃癌组织和细胞中表达下调,在胃癌的发生发展中发挥抗癌作用,这可能通过抑制转录因子CCL18的表达,阻断PI3K/AKT通路来实现[47]。AnxA2作为Nir 1与CCL18结合的下游分子,通过PI3K/Akt/GSK3β/Snail信号通路促进EMT在乳腺癌中的侵袭和转移[48-49]。CCL18通过EP300/UCA1/Wnt/β-catenin通路促进骨肉瘤细胞的增殖和迁移[50]。本研究的泛癌分析同样支持CCL18在调节机制中的功能。因此,本研究为未来研究提供了对CCL18在肿瘤免疫学中潜在作用的重要见解。
总之,本研究全面揭示了CCL18在人类癌症中的表达谱,探讨了CCL18表达水平与临床病理特征和预后、肿瘤细胞生物学特征、肿瘤免疫的相关性。还确定了涉及CCL18 的功能途径。基于这些发现,CCL18可能是确定人类癌症诊断和预后的有用生物标志物,也是评估免疫疗法疗效的生物标志物。因此,本研究为更好地了解CCL18在肿瘤发生、进展和预后中的作用以及未来免疫治疗的作用提供了准确而详细的参考。本研究的局限性在于CCL18的相关功能和机制需要通过实验进一步验证。

