脱氧胆酸对HBV复制及肝癌细胞自噬影响的研究
侯冰,高玉雪,杨鹏翔,关媛月,刘芃祥,杨静,陈德喜
(1.包头医学院基础医学与法医学院,内蒙古 包头 014040;2.首都医科大学附属北京佑安医院北京肝病研究所,北京 100069)
人体中的胆汁酸是由肝脏合成并储存在胆囊中,同时肝脏也是人体内唯一具有胆汁酸合成所需的所有酶的器官[1]。胆汁酸根据其来源可分为两大类:初级胆汁酸与次级胆汁酸。初级胆汁酸是由肝脏初步合成,包括胆酸与鹅脱氧胆酸,并且与甘氨酸或牛磺酸结合后成为初级结合胆汁酸存储于胆囊中;初级胆汁酸释放进入肠道后,在肠道菌群的作用下转化为次级游离胆汁酸,包括脱氧胆酸(deoxycholic acid,DCA)与石胆酸。当胆汁酸经胆囊释放通过肠道时,约95%的胆汁酸会参加胆汁酸的肝肠循环,在此过程中胆汁酸在末端回肠的刷状边界膜中被重吸收,由门静脉入血,流向肝窦并被肝细胞吸收,而最终剩余约5%的胆汁酸会随着粪便排出。胆汁酸对于人体的脂类代谢来说十分重要,胆汁酸的肠肝循环则保证了人体内胆汁酸池的稳定[2]。
自噬是一个将自身的细胞质蛋白或细胞器包被进入囊泡,并与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物的过程,细胞通过自噬可以实现其本身的新陈代谢[3]。目前已经发现许多可以促进自噬发生发展的信号分子以及信号通路,常见的信号通路包括PI3K-AKT-mTOR信号通路、AMPK信号通路以及MAPK信号通路,而这些通路中Beclin-1、Bcl-2、LC3-Ⅰ、LC3-Ⅱ、p62等蛋白产物是最常见的检测分子[4-8]。
由乙型肝炎病毒(hepatitis B virus,HBV)感染导致的慢性乙型肝炎是我国常见的慢性传染病,在我国因HBV感染而导致的肝硬化占比达到60%,而肝癌占比达到80%[9]。LI J H等[10]发现,HBV可诱导肝细胞的自噬,同时HBV的复制也需要自噬相关蛋白的参与,如HBV的包膜延长需要自噬过程中的重要分子LC3-Ⅱ的参与,而LC3-Ⅱ又是自噬溶酶体的必要组成分子,因此HBV的复制抑制了自噬溶酶体的形成与降解,导致不完全自噬的发生[11-12]。在这种自噬过程中LC3-Ⅱ被HBV捕获并用于自身包膜的延长,促进了HBV的复制,同时因自噬溶酶体的形成与降解受阻,导致被自噬溶酶体包裹并降解的HBV数量减少,这是HBV产生免疫逃逸的一种机制。因此肝细胞的不完全自噬促进了HBV的复制,进一步加重了HBV的感染。
胆汁酸对于自噬的影响具有双面性,既可以促进自噬的发生发展,又可以抑制自噬的发展进程,其中膜受体TGR5与核受体FXR在这里起到重要作用[13-14]。ROESLY H B等[15-17]表明,DCA可以通过G蛋白偶联受体-5(TGR5)与Beclin-1途径促进自噬的发生,进而促进了食管腺癌的发生。而在胆汁酸的肝肠循环中,经过肝细胞的DCA占比可达到至少10%,在肝硬化、肝癌、胆汁淤积等情况下,又增加了DCA与细胞接触及相互作用的时间,而DCA在慢性乙型肝炎中对HBV复制以及肝细胞生物学效应的影响还缺乏相应的研究,为此,本文将重点观察DCA对HBV复制的影响及自噬在其中的作用,并探讨可能的机制,为研究更精准、有效地治疗HBV感染导致的慢性乙型肝炎的手段提供理论依据。
1 实验材料与方法
1.1主要实验材料 HepG2与HepG2.215肝癌细胞系(中国科学院上海生命科学院细胞库)、标准纯度的DCA(美国Sigma公司)、Elisa检测试剂盒(上海科华生物工程股份有限公司)、HBV核酸定量检测试剂盒(长沙圣湘生物科技股份有限公司)、LC3-Ⅰ/Ⅱ抗体(美国cell signaling technology公司,4108S)、p62抗体(美国cell signaling technology公司,5114S)、HBX抗体(美国abcam公司,ab39716)、HBcAg抗体(美国abcam公司,ab8637)、辣根过氧化物酶标记的山羊抗鼠/兔二抗(美国cell signaling technology公司,7076S,7074S)、AF488荧光标记的二抗(美国Thermo Fisher公司,A-11008)、HBX突变表达质粒(北京博迈德基因技术有限公司,BM4015)、X-tremeGENE HP DNA Transfection Reagent质粒助转剂(瑞士Roche公司)。
1.2实验方法
1.2.1CCK-8检测细胞毒性 将生长状态良好的HepG2与HepG22.215细胞接种于96孔板中,每孔1×104个细胞,孵育12 h后更换为含有0 μmol/L、25 μmol/L、50 μmol/L、100 μmol/L、150 μmol/L DCA的培养基,孵育48 h后每孔加入10 μL的CCK-8溶液,37 ℃孵育1 h后读取吸光度。
1.2.2HBsAg、HBeAg以及HBV DNA载量测定 将细胞铺于6孔板中,每孔6×105个细胞,孵育12 h后更换为含有0 μmol/L、50 μmol/L、100 μmol/L DCA浓度的培养基,二氧化碳培养箱孵育72 h后收集培养基上清用于ELISA与HBV DNA载量测定实验。按照ELISA检测试剂盒与核酸定量试剂盒说明书中的操作步骤进行实验。
1.2.3量化成像流式仪测定HBcAg水平 同1.2.2中将细胞铺板并更换培养基孵育后,收集细胞,使用4%的多聚甲醛固定,再加入冰冷的100%甲醇,用PBS稀释甲醇至终浓度90%以透化细胞,25 min后加入HBcAg抗体,30 min后加入荧光二抗,染色30 min后上机检测。
1.2.4Western Blot检测蛋白 同1.2.2中将细胞铺板并更换培养基孵育后,收集细胞,使用RIPA裂解液收集细胞总蛋白,使用BCA蛋白定量试剂盒检测蛋白浓度,煮沸蛋白后进行传统WB的实验步骤:制胶-上样-电泳-转膜,PVDF膜使用对应的一抗孵育并洗膜后再使用对应的种属二抗孵育,洗膜后进行曝光检测。
1.2.5HBX突变表达质粒转染 将生长状态良好的Hep2.215细胞接种于6孔板,待生长融合度达到90%后进行质粒转染实验,取出对应孔数的1.5 mL无菌EP管,每管加入200 μL培养基、4 μL HBX突变表达质粒、12 μL助转剂,混匀后37 ℃孵育30 min,在添加进相应的孔板中,转染6 h后换液。
1.3统计学方法 采用SPSS 20.0 软件进行统计学分析。多组间比较采用方差齐性检验和单因素方差分析(One Way ANOVA)。进一步进行组间两两比较时,若方差齐时,采用SNK 检验(Student-Newman-Keuls 法);若方差不齐时,采用Games-Howell检验,以P<0.05为差异有统计学意义。
2 实验结果
2.1DCA对肝癌细胞系活力的影响 经过实验发现,DCA对肝癌细胞均具有毒性作用,且随着浓度的升高,细胞活力呈现出逐渐降低趋势,具有浓度依赖性(P<0.01)。见图1。
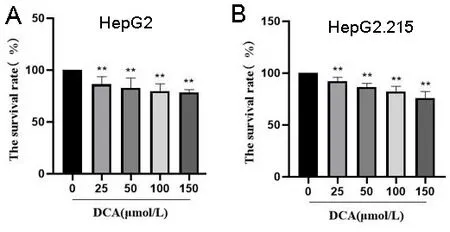
注:与0 μmol/L DCA的对照组相比,**P<0.01。
2.2DCA对HBV复制的影响 HBsAg、HBeAg水平和HBcAg的荧光强度与荧光细胞占比以及HBV DNA载量均随着浓度的升高而升高,且具有梯度上升趋势(P<0.01)。见图2。
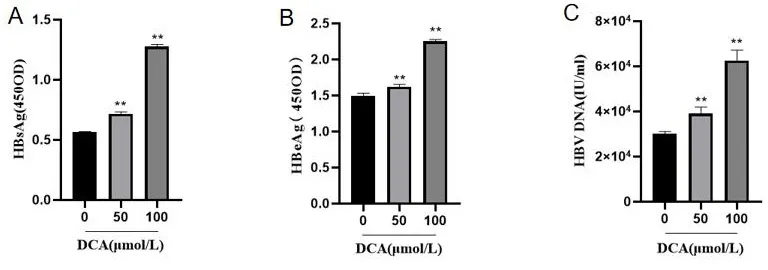
注:A.HBsAg测定结果,B.HBeAg测定结果,C.HBV DNA载量测定结果,D、E.HBcAg水平测定结果。
2.3DCA对肝癌细胞自噬的影响 在HepG2细胞中,LC3-Ⅱ/LC3-Ⅰ比值随着DCA浓度的升高而升高,p62蛋白水平随着DCA浓度的升高而下降,结果提示DCA促进了其自噬进程,促进了肝癌细胞的自噬(P<0.01);而在HepG2.215细胞中,LC3-Ⅱ/LC3-Ⅰ比值与p62蛋白水平均随着DCA浓度的升高而升高(P<0.01)。见图3。
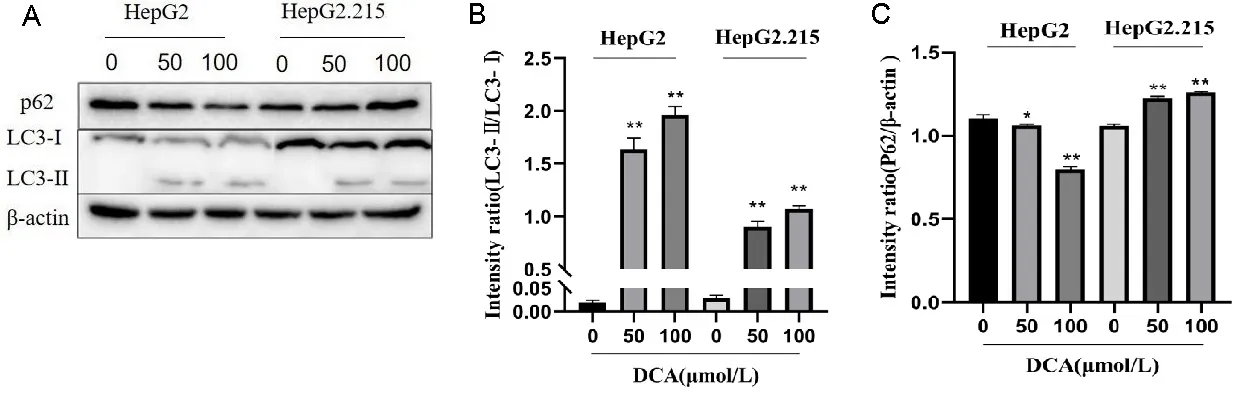
注:A.自噬蛋白水平检测,B.LC3-Ⅱ/LC3-Ⅰ比值测定,C.p62/β-actin比值测定。
2.4DCA通过作用于HBX蛋白对HBV复制的影响 0 μmol/L对照组、100 μmol/L对照组、0 μmol/L质粒转染组、100 μmol/L质粒转染组的各项HBV复制指标均呈现依次上升结果(P<0.01)。见图4。
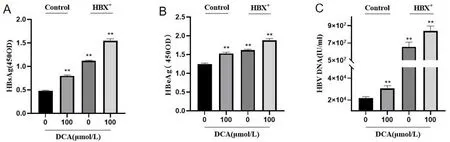
注:A.HBsAg测定结果,B.HBeAg测定结果,C.HBV DNA载量测定结果,D、E.HBcAg测定结果。
2.5DCA通过作用于HBX蛋白对自噬水平的影响 0 μmol/L对照组、100 μmol/L对照组、0 μmol/L质粒转染组、100 μmol/L质粒转染组的HBX、p62蛋白水平以及LC3-Ⅱ/LC3-Ⅰ比值均呈现依次上升结果(P<0.01)。见图5。
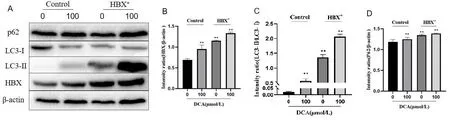
注:A.各项蛋白检测结果,B.HBX/β-actin比值结果,C.LC3-Ⅱ/LC3-Ⅰ比值结果,D.p62/β-actin比值结果。与0 μmol/L对照组相比,**P<0.01。
3 讨论
DCA主要由肠道菌群的厌氧菌群对结合胆汁酸的7α脱羟基作用生成,目前DCA多注重于结肠癌的诱导促进以及肠道菌群的调节等研究,BERNSTEIN C等[18]、KAWANO A等[19]、PAI R等[20]分别通过动物实验、流行病统计学、细胞实验表明脱氧胆酸可以诱导结肠癌的发生,并且DCA可以激活多种信号通路,比如NF-κB、Wnt与MAPK通路,进而对结肠癌产生促进作用[21-22]。另一方面,DCA本身具有抗炎灭菌作用,在正常生理状态下可在肠道中可以抑制菌群的过度生长,并在肠道炎症中发挥着消炎效应,同时在胆汁酸的肠肝循环中调节胆汁酸池的含量,进而调节胆汁酸的合成[23]。DCA被重吸收进入肝脏时通常以结合的形式存在,从而增加其亲水性以降低细胞毒性作用,但是在高脂饮食、肝硬化、肝炎以及胆管炎等一系列疾病中,胆汁酸的代谢受到阻碍,从而增加了DCA的产生,并且降低了其与氨基酸结合的形式,导致了DCA含量增加且毒性作用扩散,进而对肝胆等器官产生影响[24]。
自噬在正常生理状况下对机体起着清除有害物质、防止疾病发生的作用。在肝癌中,人体的自噬功能受损,导致肝癌的各种因素抑制自噬(如癌基因Akt的激活或肿瘤抑制基因Pten或Tsc1的缺失)、肝脏自噬不足(非酒精性脂肪性肝病)、肝脏自噬通路不完全(病毒性肝炎)[25]。前言中提到的目前慢性乙型肝炎中自噬与HBV起着相互促进的作用与本次实验结果结论一致。目前研究发现DCA同样可以促进与抑制自噬的发生发展,当细胞急性暴露在DCA环境中时,DCA可以通过促进Beclin-1途径来促进自噬,但在慢性DCA环境中细胞自噬进程则会明显降低,本次研究结果则证明DCA促进了肝癌细胞的自噬。
HBX蛋白是由HBV的X区基因所编码生成的蛋白质,这是一种跨调节蛋白,通过与其他蛋白质结合来影响病毒和宿主基因的表达[26]。HBX蛋白已被证实是一种多效性反式激活剂,可以调节病毒复制和许多细胞功能,包括细胞增殖、分化、转化、耐药性、DNA修复以及细胞自噬和凋亡[27]。WANG P等[28]表明HBX蛋白可以通过PIK3CA-AKT-MTOR途径以及在体外增强LC3-Ⅱ的水平,导致内源性Beclin-1水平升高,从而促进自噬的发生发展,此外HBX蛋白还可以通过诱导线粒体外膜(OMM)上PINK1的表达触发Pink1/Parkin依赖性线粒体自噬诱导,这导致被HBV感染的细胞逃避一般细胞凋亡,从而促进选择性降解和预防凋亡细胞死亡,以进一步增强被感染细胞的存活和病毒持久性[29]。HUANG J L等[30]表明,HBX蛋白可以显著激活肝癌细胞中的MAPK信号传导途径,进而导致HBX诱导的Bcl-2磷酸化和beclin-1与Bcl-2的解离,从而增强自噬体的形成;PARK Y H等[31]指出,HBX蛋白诱导自噬并激活JNK信号传导过程,ROS-JNK信号传导的激活对于HBV诱导的不完全自噬很重要,而HBX蛋白在这些过程中起主要作用;ZHONG L M等[32]的研究证明抑制ROS-JNK信号传导可显著抑制HBV诱导的自噬体形成,这更加确立了HBX蛋白通过ROS-JNK信号途径促进自噬发生发展的立场。除此之外HBX蛋白还通过许多其他途径以影响自噬[33-36]。
本次实验结果表明,HBX蛋白是HBV复制的核心蛋白,对于HBV的复制具有显著促进作用,同时也证实了HBX蛋白促进了肝癌细胞不完全自噬的进程这一结论,同时提示了DCA在慢性乙型肝炎中或许作用于HBX蛋白从而导致HBV复制以及细胞自噬活动的加强。
高浓度的DCA具有一定的细胞毒性,同时也可以促进HBV复制以及肝癌细胞自噬。DCA可能通过促进HBX蛋白的合成来加强HBV的复制进而促进了不完全自噬的发生发展。现如今针对HBV治疗的手段主要是抗病毒治疗,即干扰素以及核苷(酸)类似物,但是干扰素的使用具有不同程度的不良反应,而核苷(酸)类似物无法清除HBV的闭合环状DNA,停药复发的情况屡见不鲜;本研究为DCA在HBV感染中所起的作用进行了一定程度的探索,同时提示或许可以通过增加DCA在肝胆中的转化从而减弱对HBV复制的影响,为HBV感染的治疗提供了一定的科学依据。

