FDFT1基因的泛癌表达分析、与癌症预后的关联性分析及其对几种肿瘤细胞增殖的影响
刘巧珍,韦连登,刘琳,田旭云,邹萸婷,杨维玲,姜艳,曾怡,3,4
(1.右江民族医学院基础医学院,广西 百色 533000;2.右江民族医学院基础医学院病原微生物学与免疫学教研室,广西 百色 533000;3.广西高校肿瘤免疫与感染性疾病基础研究与转化重点实验室,广西 百色 533000;4.右江民族医学院肿瘤免疫病理学重点实验室,广西 百色 533000)
FDFT1(farnesyl-diphosphate farnesyltransferase 1)基因编码的角鲨烯合成酶(squalene synthase,SQS)可使代谢产物法尼基焦磷酸酯(farnesyl pyrophosphate esters,FPP)转化为角鲨烯,在胆固醇合成的过程中发挥着重要作用;无论是从甾醇或非甾醇途径,其基因产物在甲戊酸合成的过程中都发挥着重要作用。甲戊酸途径中的多种化合物可有效促进肿瘤的发生和发展[1-5]。SAITO Y等[6]报道称FDFT1基因通过AZ-TEAD2通路可促进肝癌细胞增殖和生长;在前列腺癌细胞系中,抑制FDFT1 基因表达可有效抑制细胞增殖[7];LU J J等[8]研究表明,人参皂甙 20(S)-Rg3可上调FDFT1基因的表达来降低卵巢癌细胞的增殖和侵袭能力。可见FDFT1基因与多种肿瘤的发生发展密切相关。癌症基因组图谱(The Cancer Genome Atlas,TCGA)收录了临床病理学注释数据及33种不同癌症的临床数据[9-10];泛癌分析旨在利用生物信息学工具,横向分析靶基因与不同肿瘤的作用特征[13-14],如:总生存数(OS)、疾病特异性生存率(DSS)和无进展生存间期(PFI)等。综合考虑FDFT1、胆固醇、肿瘤的密切关系,且目前少见有关FDFT1的泛癌分析。本研究通过挖掘癌症基因图谱,探究FDFT1在不同肿瘤中的表达差异及其对肿瘤预后与肿瘤微环境的影响,并探索FDFT1 基因表达对不同癌细胞增殖的影响。有助于理解FDFT1基因与肿瘤的关系,为寻找胆固醇代谢中潜在的肿瘤治疗靶点提供依据。
1 材料和方法
1.1TCGA联合GTEx数据库进行FDFT1表达的泛癌分析 TCGA数据库收录基因在不同肿瘤组织中的测序数据,GTEx(Genotype-tissue expression)数据库收录样本基因在不同组织中的差异表达情况。数据来源于UCSC XENA网站(https://xenabrowser.net/datapages/),数据为经Toil流程[9]统一处理的TCGA和GTEx的TPM(transcripts per million reads)格式的RNAseq数据。TPM格式的RNAseq数据进行log2转化后进行组间表达分析比较。
1.2FDFT1基因表达对肿瘤的预后价值 利用从TCGA数据库( https://portal.gdc.cancer.gov)下载并整理的 RNAseq 数据并提取 TPM格式的数据以及临床数据,选择泛癌分析中FDFT1表达存在统计学差异的肿瘤临床数据,利用 R(4.2.1)语言包survival[3.3.1]、survminer、ggplot2[3.3.6],使用survival包进行比例风险假设检验,自变量满足等比例风险假设(P>0.05)前提下,统计方法采用Cox回归,结果用survminer包以及ggplot2包进行可视化。如果选用了最佳分组方法(best),则对应使用survminer包中surv_cutpoint函数进行最佳分组cut-off 筛选。以绘制K-M生存曲线,比较FDFT1表达高低组之间的预后情况。本研究中仅展示Cox回归分析P<0.05的K-M曲线。
1.3免疫浸润分析 根据1.2预后分析有意义的结果,从TCGA数据库(https://portal.gdc.cancer.gov)分别下载并整理TCGA中肾上腺皮质癌(adrenocortical carcinoma,ACC)、胰腺癌(pancreatic adenocarcinoma,PAAD)、口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)、肾透明细胞癌(kidney renal cell carcinoma,KIRC)项目STAR流程RNAseq数据,提取TPM格式的数据以及临床数据,基于R包-GSVA[1.46.0][15]中提供的ssGSEA算法,利用Immunity文章[16]提供24种免疫细胞的markers来计算对应云端数据的免疫浸润情况,具体24种免疫细胞可查看对应参考文献。剔除非癌部位样本、去除正常及去除无临床信息样本。对主变量进行分组后,根据数据格式特征情况选择合适的统计方法进行统计(stats包以及car包)(如果不满足统计要求将不会进行统计分析),用ggplot2包对数据进行可视化。基于公共数据分析分子(中位数)高低表达组之间免疫浸润结果的差别,OSCC与KIRC统计方法为 Mann-Whitney U检验(Wilcoxon rank sum test);ACC和PAAD统计方法采用T检验(T test)。
1.4细胞培养 人舌鳞状细胞癌细胞(CAL-27)、人胰腺癌细胞(PANC-1)、人肝癌细胞(HepG-2)和人肝癌细胞(SMMC-7721),镜下观察其培养特性为上皮样贴壁生长。其中 CAL-27、HepG-2和PANC-1细胞需使用含10% FBS、1%青霉素-链霉素抗体的DMEM完全培养基培养,SMMC-7721细胞的培养需使用含10% FBS、1%青霉素-链霉素抗体的RPMI 1640完全培养基培养,细胞放置在含5% CO2的37 ℃细胞培养箱中培养。以上细胞目前保存于本实验室。
1.5细胞增殖实验 将100 μL不同肿瘤细胞以 4×103cells/mL的密度分别接种于96孔板中,分组为:①As组:实验孔(含有细胞的培养基、CCK-8、FDFT1 过表达慢病毒);②Ac组:对照孔(含有细胞的培养基、CCK-8、FDFT1对照组慢病毒);③Ab组:空白孔(不含细胞和待测物质的培养基、CCK-8)。37 ℃、5% CO2的条件下预培养16~18 h。更换为基础培养基培养,加入适量聚凝胺,使其终浓度为8 μg/mL,预培养 30 min;分别加入40 μLFDFT1过表达慢病毒及其对照组慢病毒;培养6~8 h后,更换为完全培养基培养;继续培养适当时间(12 h、24 h、36 h、48 h、60 h和 72 h),加入10 μL CCK-8溶液;酶标仪测定450 nm处吸光度值。结果计算:As组实际吸光度值=As组OD值-Ab组OD值,Ac组实际吸光度值= Ac组OD值-Ab组OD值。
1.6统计学方法 泛癌基因表达差异分析应用Mann-Whitney U检验进行组间差异分析,统计分析的可视化利用R(3.6.3版本)ggplot2[3.3.3版本]R包实现。CCK8增殖实验结果采用统计学分析软件GraphPad Prism 9.0进行统计学分析。实验组与对照组的组间差异使用t检验,检验水准 α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1FDFT1的mRNA在泛癌中存在差异表达 TCGA联合GTEx数据库进行RNA-Seq数据分析,结果显示,FDFT1的mRNA在ACC、乳腺浸润癌(breast invasive carcinoma,BRCA)、胆管细胞癌(cholangiocellular carcinoma,CHOL)、结肠癌(colon cancer,COAD)、弥漫性大B细胞淋巴瘤(lymphoid neoplasm diffuse large B-cell lymphoma,DLBC)、多形成性胶质细胞瘤(glioblastoma multiforme,GBM)、脑低级别胶质瘤(brain lower-grade glioma,LGG)、食管癌(esophageal carcinoma,ESCA)、肝细胞癌(liver hepatocellular carcinoma,LIHC)、肺鳞癌(lung squamous cell carcinoma,LUSC)、PAAD、前列腺癌(pro-tsate adenocarcinoma,PRAD)、直肠腺癌(rectum adenocarcinoma,READ)、皮肤黑色素瘤(skin cutaneous melanoma,SKCM)、胃癌(stomach adenocarcinoma,STAD)、胸腺癌(thymoma,THYM)中表达显著上调,差异具有统计学意义(P<0.05);KIRC、肾乳头状细胞癌(kidney papillary renal clear cell carcinoma,KIRP)、急性髓细胞样白血症(acute myeloid leukemia,LAML)、肺腺癌(lung adenocarcinoma,LUAD)、嗜铬细胞瘤和副神经节瘤(pheochromocytoma and paraganglioma,PCPG)、睾丸癌(testicular germ cell tumors,TGCT)、甲状腺癌(thyroid carcinoma,THCA)、子宫肉瘤(uterine carcinosarcoma,UCS)中表达下调,差异具有统计学意义(P<0.05),见图1。
2.2FDFT1基因表达对肿瘤的预后价值 为进一步评估FDFT1 基因表达与癌症预后的关系,利用从TCGA数据库下载的 RNAseq数据及临床数据绘制K-M生存曲线。结果显示,在ACC、PAAD中FDFT1的高表达与较差的总生存数(overall survival,OS)、疾病特异性生存率(disease specific survival,DSS)和无进展生存间期(progress free interval,PFI)有关(见图2A、图2B);在OSCC中FDFT1的高表达与较差的OS、DSS预后有关(见图2C);在KIRC中FDFT1的高表达与较好的OS、DSS、PFI预后有关(见图2D)。
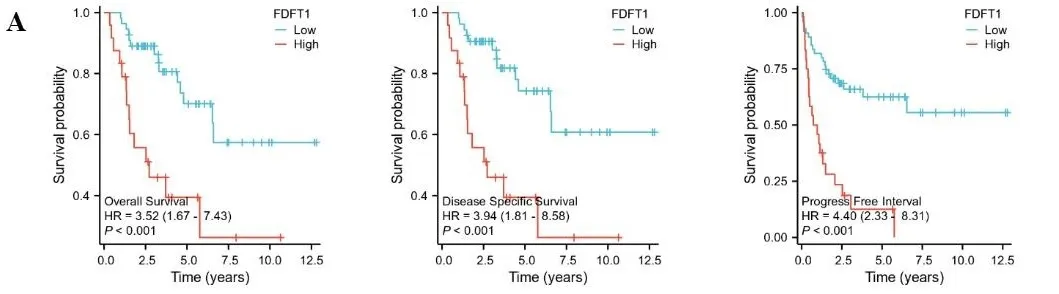
注:A.ACC的生存曲线;B.PAAD的生存曲线;C.OSCC的生存曲线;D.KIRC的生存曲线。
2.3免疫浸润分析结果 对ACC、PAAD、OSCC、KIRC 4种癌组织分别按FDFT1基因表达高低分组进行免疫浸润分析,结果显示,高表达FDFT1基因的ACC、OSCC、KIRC组织中,活化的树突状细胞(activated dendritic cell,aDC)浸润评分低于FDFT1基因低表达组(见图3A、3C、3D),差异有统计学意义(P<0.05)。FDFT1基因高表达的PAAD癌组织与低表达组比,aDC浸润评分差异无统计学意义(见图3B)。
2.4FDFT1过表达促进CAL-27、PANC-1、SMMC-7721和HepG-2细胞的增殖FDFT1 过表达慢病毒感染不同癌症细胞,分别于12 h、24 h、36 h、48 h、60 h和72 h采用CCK8法检测细胞的增殖情况。如图4A和图4B中的结果所示,与NC组相比,FDFT1过表达慢病毒对PANC-1和CAL-27的细胞增殖情况表现为促进作用;如图4C和图4D所示,与NC组相比,FDFT1过表达慢病毒对SMMC-7721和HepG-2细胞同样表现为促进癌细胞增殖的作用。
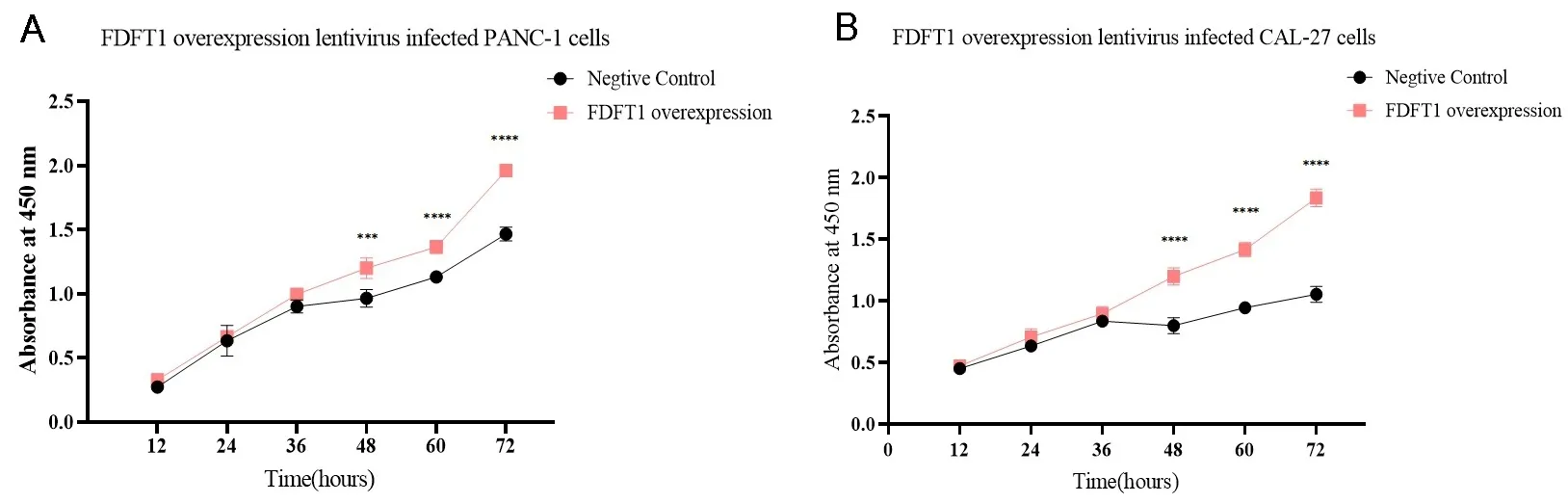
注:与同时间点NC组相比,*P<0.05,**P<0.01,***P<0.001,****P<0.0001。
3 讨论
本研究中的泛癌基因差异表达分析结果显示在ACC等16种癌组织中FDFT1 基因表达上调,在KIRC等8种癌组织种FDFT1 基因表达下调,与近年来相关报道显示FDFT1基因与多种癌症相关的结果相符[7,17-24]。众多研究表明肿瘤微环境在肿瘤的发生发展中起重要作用[25-29],其中,肿瘤免疫浸润细胞和肿瘤的预后有关,进一步对FDFT1表达上调的癌症进行的预后分析,结果显示FDFT1的高表达与ACC、PAAD、OSCC、KIRC较差的预后有关,比较这4种癌组织FDFT1高表达组与低表达组之间aDC浸润评分,在ACC、OSCC、KIRC 3种癌组织中,FDFT1高表达组aDC浸润评分较低,提示FDFT1高表达可能下调肿瘤微环境中活化DC的数量(活化DC发挥抗原提呈功能),其数量减少易导致肿瘤细胞抗原无法正确提呈给T细胞,导致细胞免疫不答应,从而促进肿瘤免疫逃逸。因此,FDFT1基因可能通过调节肿瘤微环境中免疫细胞的数量或功能,参与肿瘤免疫逃逸作用。
本研究细胞增殖实验的结果显示过表达FDFT1基因可促进癌细胞(PANC-1、CAL-27、SMMC-7721和HepG-2)的增殖,从临床的角度来看,TCGA数据集显示FDFT1的高表达与较差的ACC、PAAD的OS、DSS和PFI预后有关;在OSCC中与较差的OS、DSS预后有关;细胞增殖实验的结果显示FDFT1基因高表达促进癌细胞增殖,提示FDFT1基因高表达可能促进癌细胞增殖导致肿瘤进一步发展,从而与较差的疾病预后有关,实验结果与生存分析结果相符。
FDFT1基因与结直肠癌的关系被广泛关注,有研究报道了该基因与结肠腺癌的不良预后相关[30];罗娜等[31]研究在小鼠结肠癌细胞系MC-38细胞中敲低FDFT1基因,肿瘤细胞迁移和凋亡无明显差异,但对细胞的生长能力具有显著影响,本研究的泛癌基因表达差异分析结果与此结论相符;此外,FDFT1 与前列腺癌的关系也被多次报道[32-34]。对比其他肿瘤与FDFT1基因的相关报道,FDFT1基因与肝癌的研究较少[18-20,22],但在蔡东[35]的研究中证实了FDFT1基因通过PI3K/AKT信号轴影响肝癌细胞的增殖和迁移。FDFT1基因逐渐成为肿瘤发生发展研究中易受关注的基因。进一步在胰腺癌细胞PANC-1和口腔癌细胞系CAL-27中高表达FDFT1基因,发现FDFT1基因可促进PANC-1和CAL-27细胞增殖。表明FDFT1基因的表达可能在胰腺癌、口腔癌的发生发展中起一定影响作用。
综上所述,FDFT1基因在PAAD、KIRC等16种肿瘤组织中mRNA表达上调,在KIRC、PRCC等8种肿瘤组织中表达下调。FDFT1高表达在PAAD、OSCC和LIHC中与较差的预后有关,在KIRC中与较好的预后有关。高表达FDFT1基因的肿瘤微环境中活化DC的数量少于低表达组。FDFT1过表达慢病毒促进PANC-1等4种肿瘤细胞的增殖。

