基于GEO数据库筛选舌鳞状细胞癌顺铂耐药的关键基因及生物信息学分析
苏萌,张钊银,姚金光
(右江民族医学院口腔医学院,广西 百色 533000)
舌鳞状细胞癌(tongue squamous cell carcinoma,TSCC)是一种舌体鳞状上皮组织来源的口腔恶性肿瘤,也是常见的头颈部恶性肿瘤[1]。舌头的前2/3被认为是舌鳞状细胞癌发生的主要区域,而舌头的后1/3为舌根癌的范畴[2]。流行病学资料显示,舌鳞状细胞癌约占口腔癌的30%~50%和全身恶性肿瘤的0.8%~1.5%[3-4]。舌体组织的淋巴管、血管丰富且机械运动频繁,出现区域淋巴结转移的可能性很高,即使在早期阶段也是如此,导致临床上治疗困难。
顺铂的联合化疗是包括舌鳞状细胞癌在内的多种癌症的标准治疗方法,在舌鳞状细胞癌的治疗中扮演极其重要的角色。然而,顺铂通常受到机体天然和获得性耐药的限制,许多舌鳞状细胞癌患者对顺铂固有抗性或经多次用药后对顺铂产生抗性,甚至对未使用过的化疗药物也产生抗性,从而严重限制了化疗效果,术后5年生存率仅为50%[5-7]。目前,临床上仍缺乏针对舌鳞状细胞癌顺铂耐药的关键靶点,导致无法从根本上逆转其耐药性。
随着芯片技术的发展,学者们从专注于少数经典耐药基因的研究转向全基因组测序来挖掘特异的耐药基因,以更准确地评估机体基因调控耐药变化的过程。本研究基于GEO数据库中舌鳞状细胞癌顺铂耐药细胞的芯片数据,利用生物信息学分析方法筛选舌鳞状细胞癌顺铂耐药过程中的关键基因,探讨其与顺铂耐药性的联系,为揭示顺铂耐药的分子机制及逆转顺铂耐药性提供理论依据。
1 材料与方法
1.1数据来源 登录Gene Expression Omnibus数据库(https://www.ncbi.nlm.nih.gov/geo/,GEO),以“Tongue Squamous Cell Carcinoma”和“Ciplatin Resistance”作为关键词,下载数据集GSE111585和GSE115119的表达数据及GPL平台文件。GSE111585数据集基于GPL14715平台测序,共包括3例正常SCC9细胞样本和3例SCC9顺铂耐药细胞样本。GSE115119数据集基于GPL16955平台测序,共包括2例正常CAL27细胞样本和2例CAL27顺铂耐药细胞样本。SCC9与CAL27均为人舌鳞状细胞癌细胞系。根据GPL平台文件对探针ID进行注释转换,以获取对应的基因名称。从铂耐药基因数据库(http://ptrc-ddr.cptac-data-view.org)中下载909个与铂耐药密切相关的基因(platinum resistent genes,PRGs),该数据库包含近30年来800篇出版物关于铂耐药的研究,并对涉及铂耐药的909个基因进行高度整理和注释[8]。
1.2差异基因的筛选 用R语言limma包分别对GSE111585和GSE115119数据集进行差异分析[9],以P<0.05且|log2FC|≥2作为标准筛选差异表达基因(differentially expressed genes,DEGs),并绘制火山图。将两组数据集的DEGs与PRGs取交集,以降低筛选的假阳性,并绘制韦恩图。
1.3GO和KEGG富集分析 运用R语言对DEGs进行功能注释,以明确其参与的生物学功能及信号通路,并进行可视化,设置Count>5,P<0.05及FDR<0.1。其中基因本体论(gene ontology,GO)主要包括生物学过程(biological processes,BP)、细胞组分(cellular components,CC)及分子功能(molecular functions,MF)。京都基因和基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)主要包括信号通路。
1.4PPI网络的构建及网络分析 String数据库(https://stringdb.org/)可用于预测DEGs编码蛋白的相互作用关系[10]。将DEGs上传至String数据库,以互作分数Score>0.400(中等置信度)为阈值构建蛋白互作网络(protein-protein interaction,PPI),去除游离的靶点,简化PPI网络。下载PPI网络的TSV文件,将其导入Cytoscape_v3.8.0软件进行可视化,其中节点(Node)代表节点基因,边(Edge)代表基因之间的相互作用情况。基于CytoHubba插件中Degree拓扑分析算法对PPI网络进行分析,筛选出评分前3的基因作为Hub基因。
1.5Hub基因与顺铂耐药性分析 从Cellminer数据库(https://discover.nci.nih.gov/cellminer/home.do)中下载药物敏感性数据[11],根据Hub基因表达量中位数分为高、低表达组,用wilcox.test计算两组顺铂敏感性IC50的表达差异,绘制箱线图,P<0.05时差异有统计学意义。
2 结果
2.1差异表达基因的鉴定 根据|log2FC|≥2,P<0.05标准筛选,GSE111585数据集共筛选出458个DEGs,其中上调基因235个,下调基因223个(见图1A);GSE115119数据集共筛选出677个DEGs,其中上调基因377个,下调基因300个(见图1B)。韦恩图交叉分析筛选出32个与顺铂耐药密切相关的DEGs(见图1C)。
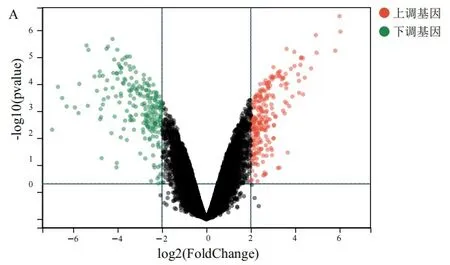
图1 差异表达基因的火山图和韦恩图
2.2GO及KEGG富集分析 GO功能富集分析显示,32个DEGs主要富集在刺激反应调节、多细胞生物过程的调节及组织发育等生物学过程(见图2A);细胞组成变化主要涉及细胞外区域、内膜系统及胞外区部分等(见图2B);分子功能变化主要包括信号受体结合、酶结合、DNA结合转录激活剂活性等(见图2C)。KEGG通路富集分析显示,DEGs主要富集在癌症通路、人T细胞白血病病毒Ⅰ型感染、人乳头瘤病毒感染及糖尿病并发症中的AGE-RAGE信号通路等(见图2D)。
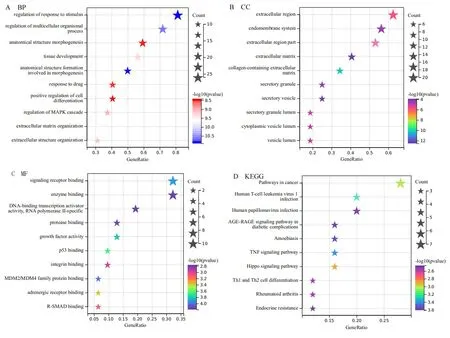
图2 差异表达基因的GO及KEGG富集分析
2.3PPI网络的构建及Hub基因的识别 将32个显著性DEGs上传至STRING数据库,去除游离节点,构建32个节点,60条边数的PPI网络。使用CytoHubba插件Degree算法对PPI网络进行分析,评分排名前3的基因中纤维连接蛋白基因(fibronectin 1,FN1)、性别决定区Y框蛋白2(sexdetermining region Y-Box2,SOX2)和Ⅰ型胶原α1亚基因(collagen type Ⅰ alpha 1,COL1A1)被鉴定为舌鳞状细胞癌顺铂耐药的关键基因即Hub基因,三者均为上调基因,见图3。
2.4Hub基因与顺铂IC50的表达差异 根据P<0.05为筛选阈值,发现其中COL1A1具有较大的研究意义。研究显示与COL1A1低表达组相比,高表达组的顺铂敏感性IC50较高,说明基因表达量越高,其对顺铂的抗药性越强。见图4。
3 讨论
顺铂是舌鳞状细胞癌化疗的首选药物,但耐药性严重限制了其临床应用。尽管很多学者已经致力于顺铂抗性机制的研究,但是仍然缺乏逆转顺铂抗性和改善对基于顺铂的疗法响应的有效靶标[12]。因此,确定顺铂耐药变化过程中起主导作用的关键基因,运用新的分子靶向治疗方法来克服顺铂耐药性或针对性开发安全有效的药物靶标来逆转耐药性对舌鳞状细胞癌的治疗至关重要。本研究通过生物信息学方法筛选GSE111585和GSE115119数据集中DEGs,但芯片数据中细胞样本量较少,为此引入了铂耐药基因数据库中的PRGs,以排除筛选基因时出现的假阳性。经过多数据集及多基因的整合,共筛选出32个显著表达的DEGs,其在正常人舌鳞癌细胞系和耐药细胞系中的表达存在显著差异,说明该基因与铂耐药性存密切的联系。GO功能富集分析显示,DEGs主要参与刺激反应调节及多细胞生物过程的调节等生物学过程,细胞组成变化主要在细胞外区域、内膜系统及胞外区等区域,与信号受体结合、酶结合及DNA结合转录激活剂活性等分子功能相关。KEGG通路富集分析显示,DEGs主要富集在癌症通路、人T细胞白血病病毒Ⅰ型感染等信号通路。GO和KEGG富集分析提供了DEGs在顺铂耐药性中可能参与的功能及发挥作用的相关途经,将众多基因的表型与基因功能构建起联系,以明确研究的范围,为顺铂耐药性研究提供新的思路。
根据CytoHubba中Degree拓扑分析算法筛选出前3个候选Hub基因,即FN1、SOX2和COL1A1,这些在舌鳞状细胞癌顺铂耐药细胞样本中均呈现出显著高表达,具有成为顺铂耐药关键靶点的潜力,存在极大的研究价值。FN1是一种纤维连接蛋白,为FN蛋白家族的成员,主要位于胞外区的细胞外基质中。研究表明FN1与癌症的顺铂耐药过程密切相关,且FN1在顺铂耐药的卵巢癌中表达显著上调,但是其分子调控机制尚不明确[13]。目前,有学者在顺铂耐药的神经母细胞瘤中观察到上皮间质转化(epithelial-to-mesenchymal transitions,EMT)的表型,而KURIMOTO R、CHENG M M等[14-15]也发现EMT标志物在顺铂化疗耐药的NSCLC患者组织中表达显著上调,说明上皮间质转化途经可以介导顺铂耐药。FN1是上皮间质转化的公认标志物,多项功能研究已将其与EMT的生物学行为联系起来[16]。因此,推测FN1的高表达可能改变舌鳞状细胞癌的EMT表型,介导恶性上皮细胞向间质细胞转化,从而促进耐药性改变。SOX2位于3号染色体的长臂中,位于3q26.3-27区域,属于SOX基因家族,主要参与肿瘤细胞的增殖、分化、侵袭、转移、复发等过程[17-18]。作为肿瘤干细胞重要的标志物,SOX2在介导耐药方面可能与肿瘤干细胞相关的耐药特征存在密切联系,被认为有助于耐药性的早期阶段。研究表明增强SOX2启动子的表达作用,可以促进SOX2表达并导致肿瘤生长和耐药性,提示其在改变耐药性方面存在重要作用[19]。COL1A1是胶原蛋白家族的成员,主要参与细胞增殖、迁移及血管生成,而且COL1A1被认为与细胞外基质 (extracellular matrix,ECM) 的变化密切相关,特别是能增强EMC的重塑作用[20-21]。EMC是分布在细胞表面多糖和蛋白,可以保护生物细胞免受外部环境的影响,其屏障作用有助于增加肿瘤细胞对抗微生物剂的耐药性[22]。推测COL1A1基因表达的改变可以导致异常的基质活化,引起强烈的细胞外基质重塑,出现过度的ECM积累,从而增加顺铂抗性。
本课题根据Hub基因表达量的中位数分为高、低表达组,用wilcox.test计算两组顺铂敏感性IC50的表达差异,期望从3个Hub基因中筛选出更具有预测价值的目标基因,发现COL1A1基因表达量与顺铂敏感性IC50存在显著正相关,而且其表达量越高,顺铂的耐药性也就越强。有报道显示,冯晓杰等[22]通过干扰COL1A1基因表达成功逆转A2780-cis/lGROV1-cis细胞的耐药性,充分证明通过抑制COL1A1表达能增强肿瘤化疗的敏感性,可作为个性化逆转耐药的重要靶标,从而提高化疗效果。本研究与上述文献报道基本一致,表明该研究具有较大的前瞻性及可信度。本研究利用基因表达谱技术初步证明FN1、SOX2和COL1A1具有作为舌鳞状细胞癌顺铂耐药潜在生物标志物的潜力,其中COL1A1最具研究价值,针对其开发新治疗药物或挖掘现有药物的有效成分,有望成为逆转顺铂耐药的关键。
综上所述,本研究通过生物信息学方法筛选出32个DEGs,其中FN1、SOX2和COL1A1作为Hub基因,且顺铂耐药密切相关。此外,本课题组首次预测出Hub基因与顺铂敏感性IC50的联系,其中COL1A1基因具有极大的研究价值,可以作为逆转舌鳞状细胞癌顺铂耐药的潜在作用靶点。本研究为舌鳞状细胞癌顺铂耐药分子机制及开发敏感药物靶标提供强有力的理论依据,但仍需更多实验证据进一步证实。

