碱韭总黄酮含量测定方法优选
高雪峰 高健 杨昱萍 门中华 董贵成 赵鹏


摘 要:目的:筛选适用于测定碱韭总黄酮含量的试验方法,并对不同采集年份、不同部位碱韭总黄酮进行分析评价。方法:以芦丁为对照品,碱韭叶为试验材料,对比NaNO2-Al(NO3)3-NaOH比色法、AlCl3比色法、直接测定法对碱韭总黄酮含量测定的影响。然后对AlCl3比色法测定条件(显色时间、AlCl3加入量、显色温度、pH值和乙醇的浓度)进行了优化。结果:选用AlCl3比色法测定的结果准确可靠,采用优化后的AlCl3比色法测定条件测得碱韭总黄酮主要存在于叶和花中,平均含量为(38.60±5.79)mg·g-1。结论:碱韭具有较高的黄酮应用价值,可作为食品黄酮类添加剂和营养保健食品开发利用。
关键词:碱韭;AlCl3比色法;总黄酮
Optimization of Determination Method of Total Flavonoids Content in Allium polyrhizum Turcz. ex Regel
GAO Xuefeng1, GAO Jian1, YANG Yuping1, MEN Zhonghua1, DONG Guicheng2, ZHAO Peng1*
(1.School of Biological Science and Technology, Baotou Teachers College, Inner Mongolia University of Science and Technology, Baotou 014030, China; 2.College of Life Science, Inner Mongolia Agricultural University, Hohhot 010011, China)
Abstract: Objective: To screen test methods suitable for determining the total flavonoid content of Allium polyrhizum Turcz. ex Regel, and to analyze and evaluate the total flavonoid content of Allium polyrhizum Turcz. ex Regel in different collection years and parts. Method: Using rutin as the reference material and Allium polyrhizum Turcz. ex Regel leaves as the experimental material, the effects of NaNO2-Al(NO3)3-NaOH colorimetric method, AlCl3 colorimetric method, and direct determination method on the determination of total flavonoid content in Allium polyrhizum Turcz. ex Regel were compared. Then, the determination conditions of the AlCl3 colorimetric method (color development time, AlCl3 addition amount, color development temperature, pH value, and ethanol concentration) were optimized. Result: The results obtained by using AlCl3 colorimetric method were accurate and reliable. The optimized AlCl3 colorimetric method was used to determine the conditions under which the total flavonoids of alkali leeks mainly exist in leaves and flowers, with an average content of (38.60±5.79)mg·g-1. Conclusion: Allium polyrhizum Turcz. ex Regel has high flavonoid application value and can be used as a food flavonoid additive and nutritional health food development and utilization.
Keywords: Allium polyrhizum Turcz. ex Regel; AlCl3 colorimetric method; total flavonoids
碱韭(Allium polyrhizum Turcz. ex Regel)是百合科(Liliaceae)葱属(Allium)多年生草本植物,广泛分布于内蒙古呼伦贝尔、锡林浩特、乌兰察布等地[1]。碱韭花又被称为扎蒙花,是西北地区日常生活中的一种烹调炝油提味的绿色食品,同时也是畜牧业季节性饲草和秋季抓膘的常用野生植物,全草及其种子可以入药,有解毒、化瘀、消炎消肿、健胃、利尿等功效,是一种可食用的多功能天然植物[2]。碱韭中重要活性成分為黄酮类物质[3-4],为加快碱韭黄酮的开发利用,有必要对碱韭黄酮的含量进行快速有效的监测。由于碱韭中黄酮类物质种类丰富,含量不一,以分光光度法测定总黄酮含量科学准确、操作简便、易于工业推广,可大大降低检测成本[5]。本文分析了直接测定法、NaNO2-Al(NO3)3-NaOH比色法、AlCl3比色法对碱韭总黄酮含量测定的适用性,筛选出最适合的测定方法,对方法的精密度、稳定性等进行研究,并对不同采集年份不同部位碱韭总黄酮进行分析评价,以期为碱韭资源有效保护提供参考,同时为开发具有黄酮类食品添加剂的保健食品提供支撑。
1 材料与方法
1.1 试验材料
本研究以2019年、2020年、2021年8月分别采自内蒙古自治区鄂尔多斯市达拉特旗的碱韭为实验材料,采后将根、叶、花清洁并分离,室内自然阴干,经粉碎后过60目筛,密封低温冷藏备用。考虑碱韭叶便于收集和处理,因此本文优选试验部分以
2019年8月采集的碱韭叶为研究对象。
1.2 仪器和试剂
N4S紫外可见分光光度计(上海仪电分析仪器有限公司);S22T数控超声波清洗器(上海仪天科学仪器有限公司);TB-114电子分析天平(河南信陵仪器设备有限公司);H/T16MM台式高速离心机(南北仪器有限公司);QE-200高速多功能粉碎机(上海沪粤明科学仪器有限公司)。
芦丁标准品(纯度≥98%,西安汇林生物科技有限公司);无水乙醇(济南世纪通达化工有限公司);甲醇、亚硝酸钠、硝酸铝、冰乙酸、氢氧化钠、三氯化铝、无水乙酸钠(分析纯,国药集团化学试剂有限公司);实验用水为二次蒸馏水。
1.3 试验方法
1.3.1 溶液制备
(1)碱韭总黄酮提取液的制备。准确称取
1.0 g碱韭叶粉末,分别选取水、乙酸乙酯、60%乙醇和60%甲醇作为提取溶剂,控制料液比为
1∶30(g∶mL),超声功率为400 W,在60 ℃下超声提取60 min。提取液经过滤分离后,收集至棕色瓶中,冷藏备用。
(2)芦丁标准液的制备。精密称取40 mg于
120 ℃干燥至恒重的芦丁标准品,用60%乙醇溶解定容至200 mL,配制成浓度为0.2 mg·mL-1的芦丁标准溶液。
1.3.2 碱韭总黄酮含量测定方法的选择
黄酮类化合物一般与水、乙酸乙酯、乙醇、甲醇等溶剂具有较好的亲和性,为了客观反映碱韭总黄酮在各提取溶剂中的存在状态,体现与芦丁标准品的可参比性和测定方法的一致性,本试验在各提取溶剂下进行显色反映,优选碱韭总黄酮测定方法。同时确定碱韭总黄酮的最佳提取溶剂。所有实验均重复3次。
(1)直接测定法。分别移取水、乙酸乙酯、60%乙醇和60%甲醇各1 mL,以及芦丁标准液1 mL,置于10 mL具塞刻度试管中,使用各提取溶剂定容至10 mL,摇匀并室温下静置15 min,分别以各提取溶剂为空白对照,在200~700 nm波长下进行光谱扫描。
(2)NaNO2-Al(NO3)3-NaOH比色法。分别移取各提取溶剂1 mL和芦丁标准液1 mL,置于10 mL具塞刻度试管中,逐一加5% NaNO2溶液0.3 mL、10% Al(NO3)3溶液0.3 mL、4% NaOH溶液4 mL,每种试剂加入后均需摇匀并室温下放置6 min,然后使用各提取溶剂定容至10 mL,摇匀,室温静置15 min,分别以各提取溶剂为空白对照,在400~600 nm波长下进行光谱扫描[6]。
(3)AlCl3比色法。分别移取各提取溶剂1 mL和芦丁标准液1 mL,置于10 mL具塞刻度试管中,加入1 mL 0.1 mol·L-1的AlCl3,使用各提取溶剂定容至10 mL,摇匀,室温靜置30 min,分别以各提取溶剂为空白对照,在200~700 nm波长下进行光谱扫描[7]。
1.3.3 AlCl3比色法测定条件的优化
(1)缓冲溶液pH及测定波长的选择。准确吸取1 mL芦丁标准液和1 mL 60%乙醇的样品提取液,置于10 mL具塞刻度试管中,加入1 mL 0.1 mol·L-1的AlCl3再分别加入pH值为3.6、4.0、4.4、4.8、5.0、5.2、5.4、5.8和6.2的NaAC-HAC缓冲液2 mL,使用60%乙醇定容至10 mL,摇匀后,室温静置30 min,分别以1 mL蒸馏水代替芦丁标准液(样品提取液)为空白对照,在200~500 nm波长下进行光谱扫描。
(2)显色剂AlCl3用量的选择。准确吸取1 mL芦丁标准液和1 mL 60%乙醇的样品提取液,置于
10 mL具塞刻度试管中,分别加入0.1 mol·L-1的AlCl3溶液0.2 mL、0.4 mL、0.5 mL、0.6 mL、0.8 mL、1.0 mL、1.5 mL和2.0 mL,再加入pH值为
4.4的NaAC-HAC缓冲液2 mL,用60%乙醇定容至10 mL,摇匀后,室温静置30 min,分别以1 mL蒸馏水代替芦丁标准液(样品提取液)为空白对照,在405 nm下测定吸光度值。
(3)显色时间和显色温度的选择。准确吸取1 mL芦丁标准液和1 mL 60%乙醇的样品提取液,置于
10 mL具塞刻度试管中,分别加入0.1 mol·L-1的AlCl3溶液0.8 mL,再加入pH值为4.4的NaAc-HAc缓冲液2 mL,用60%乙醇定容至10 mL,分别以1 mL蒸馏水代替芦丁标准液(样品提取液)为空白对照。在显色5 min、10 min、15 min、20 min、25 min、30 min、35 min、40 min、50 min和60 min后于405 nm下测定吸光度值。在确定显色时间后,控制显色温度为10 ℃、20 ℃、30 ℃、40 ℃,测定吸光度值。
(4)显色溶剂浓度的选择。准确吸取1 mL芦丁标准液和1 mL 60%乙醇的样品提取液,置于
10 mL具塞刻度试管中,加入0.1 mol·L-1的AlCl3溶液0.8 mL,再加入pH值为4.4的NaAC-HAC缓冲液2 mL,分别用0%(蒸馏水)、10%、30%、50%、60%、70%、95%乙醇定容至10 mL,以1 mL蒸馏水代替芦丁标准液(样品提取液)为空白对照。摇匀后,按(3)中确定的显色时间和显色温度(室温)静置25 min后,每隔20 min在405 nm波长下测定吸光度值,直至65 min。所有实验均重复3次。
1.3.4 AlCl3比色法标准曲线绘制
分别取芦丁标准液0 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL和1.0 mL,置于10 mL具刻度试管中,加入0.1 mol·L-1的AlCl3溶液0.8 mL,再加入pH值为4.4的NaAC-HAC缓冲液2 mL,分别用30%乙醇定容至10 mL,摇匀后,室温下静置25 min,在405 nm下测定吸光度值。用蒸馏水代替芦丁标准液作为相应的空白对照,以吸光度(A)对芦丁浓度(c)作图,得到标准曲线。线性方程为A=0.102 8c+0.007 4,相关系数R2=0.999 4。
按照上述芦丁标准曲线绘制的分析方法,测定其吸光度值,然后根据回归方程计算提取液中所含总黄酮的含量。计算公式为
(1)
式中:Y为碱韭总黄酮含量,mg·g-1;c为标准曲线计算得出的待测液中总黄酮质量浓度,mg·mL-1;v1为测定样品液体积,mL;v为样品提取液总体积,mL;v2为显色液總体积,mL;m为称取碱韭粉末质量,g。
1.3.5 AlCl3比色法的精密度测定及回收验证
(1)精密度。分别取碱韭样品提取液0.5 mL和
1.0 mL,按1.3.4测定方法连续测定5次并记录吸光度值,计算碱韭总黄酮的含量,检测精密度和重复性。
(2)回收验证试验。取碱韭样品提取液0.5 mL和1.0 mL,分别加入芦丁标准液0.2 mL、0.3 mL、
0.4 mL、0.5 mL和0.6 mL,测定其吸光度,并计算回收率。
1.3.6 不同采集年份和不同部位碱韭总黄酮含量检测
准确称取2019年、2020年、2021年的碱韭叶、花、根粉末各1.0 g,按1.3.1项方法制备碱韭黄酮提取液。分别取各提取液1 mL并按1.3.4测定方法测定吸光度值,计算碱韭总黄酮含量。以蒸馏水代替提取液作为相应的空白。
1.4 数据分析
采用SPSS 20.0软件进行One-way ANOVA方差分析,样本间的差异显著性用Duncans检验。采用Excel 2019软件制图。
2 结果与分析
2.1 碱韭总黄酮测定方法的选择
如图1所示,芦丁标准液和各提取液在200~700 nm均有2个吸收峰,且吸收峰各不相同。其中,芦丁标准液的最大吸收波长为270 nm和
360 nm,乙醇和甲醇提取液的最大吸收波长均为
320 nm和360 nm,水提取液的最大吸收波长为285 nm和320 nm,乙酸乙酯提取液的最大吸收波长为280 nm和410 nm,且峰值较低。各提取液的吸收峰与芦丁的吸收峰相距较远,故本文不选用直接测定法进行碱韭总黄酮含量的测定。
如图2所示,采用NaNO2-Al(NO3)3-NaOH比色法发生显色反应后,出现大量絮状物,这与柿叶[8]、竹叶[9]、荞麦壳[10]的研究结果一致,这可能是由于在碱性条件下,提取液中的原花色素、阿魏酸、绿原酸和咖啡酸等酚酸类物质可与铝离子形成络合物沉淀,对显色造成严重影响,且含有邻二酚羟基的非黄酮类物质也会在测定波长下显色,可能造成黄酮类化合物假阴性和非黄酮类化合物假阳性干扰,导致方法准确度不高[11]。
如图3所示,在芦丁标准液和各提取液中加入AlCl3显色剂后,芦丁的最大吸收峰红移至410 nm处,而各提取液均在410 nm附近有吸收峰,能有效避免酚酸类等物质干扰,有较好的一致性和专属性。因此,以芦丁为对照品,选用AlCl3比色法测定碱韭总黄酮含量。
对4种黄酮提取溶剂进行对比,发现甲醇和乙醇的提取效果优于水和乙酸乙酯,考虑到乙醇比甲醇更稳定和安全,本文选择乙醇作为碱韭黄酮的提取溶剂。
2.2 AlCl3比色法测定条件的优化
2.2.1 缓冲溶液pH及测定波长的确定
缓冲溶液pH值在3.6~6.2时,吸收峰值位置随着pH值升高发生红移,且吸光度也呈逐渐增大趋势。pH值为4.4时,芦丁标准液和样品提取液显色后均在405 nm波长处达到最大吸收峰,且该波长下的吸光度稳定。当pH值大于4.4时,芦丁标准液和样品提取液显色后放置一段时间均有白色沉淀析出。因此,本文确定NaAC-HAC缓冲溶液的pH值为4.4,测定波长为405 nm。
2.2.2 显色剂AlCl3用量的选择
由图4可知,当AlCl3(0.1 mol·L-1)显色剂用量为0.8 mL时,芦丁标准液达到最佳显色,而样品提取液在1.5 mL时达到最佳显色。结合光谱分析,发现显色剂用量小于0.5 mL时,芦丁标准液和样品提取液的最大吸收峰分别出现在350 nm和305 nm处,样品提取液的吸收峰随着显色剂用量的增大由395 nm向415 nm迁移,在显色剂用量为0.8 mL时与芦丁标准液的最大吸收峰一致。因此,本文选择0.8 mL AlCl3(0.1 mol·L-1)作为最佳显色剂用量。
2.2.3 显色时间和显色温度的选择
由图5和图6可知,芦丁标准液和样品提取液显色时间为20~60 min时,吸光度变化小于3%,综合考虑,本文选择25 min作为显色时间。在确定显色时间后,控制显色温度在10~40 ℃,发现显色后的吸光度差异不显著(P>0.05),因此本文采用室温条件进行显色。
2.2.4 乙醇浓度的选择
如图7所示,乙醇浓度为30%时,芦丁标准液和样品提取液的吸光度值最大,显色效果最佳。当乙醇浓度大于30%时,放置后芦丁标准液和样品提取液均有沉淀析出,这与乐薇等[12]在箬叶总黄酮测定时的表现一致。综合分析,本文选择30%乙醇作为显色溶剂浓度。
2.3 AlCl3比色法的精密度及回收率
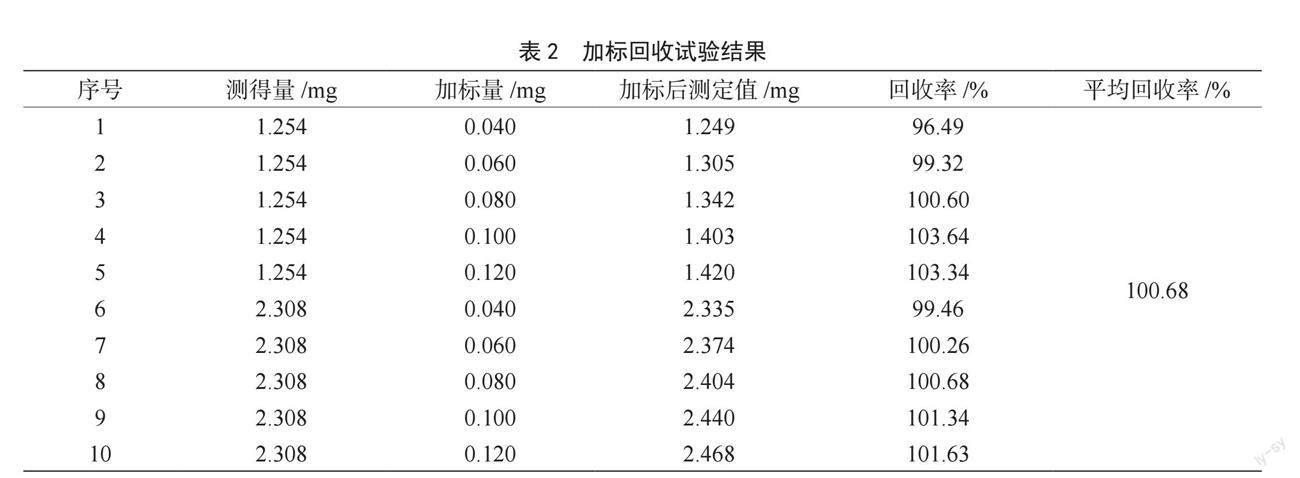
由表1和表2可知,样品取用量1 mL时的总黄酮含量为0.5 mL时总黄酮含量的1.97倍,RSD分别为1.48%和0.55%,表明该方法的精密度较好。本方法测定碱韭提取液中总黄酮含量的相对标准偏差为1.29%,加标回收率在96.49%~103.64%,准确度较高。因此,可以采用此法测定碱韭总黄酮含量。
2.4 不同采集年份和不同部位的碱韭总黄酮含量
由图8可知,不同碱韭部位的总黄酮含量大小顺序依次为叶>花>根,且2019年>2020年>2021年。2019年和2021年碱韭不同部位总黄酮含量差异显著(P<0.05),2020年叶和花差异不显著(P>0.05);相同部位不同年份差异显著(P<0.05)。碱韭黄酮主要存在于叶[(42.70±6.65)mg·g-1]和花[(34.50±5.30)mg·g-1]中,以3年均值衡量叶和花的总黄酮含量为(38.60±5.79)mg·g-1。
酮含量差异显著(P<0.05);不同大写字母表示在相同部位不同年份的黄酮含量差异显著(P<0.05)。
3 结论
本试验利用紫外可见分光光度法测定碱韭中的总黄酮含量,并针对3种比色法进行比较分析。最终确定采用AlCl3比色法测定碱韭总黄酮含量。该法以芦丁为对照品,取碱韭总黄酮样液1.0 mL,置于10 mL具塞刻度试管中,加入0.1 mol·L-1的AlCl3溶液0.8 mL,再加入pH值为4.4的NaAC-HAC缓冲液2 mL,用30%乙醇作為显色溶剂定容至10 mL,摇匀后,室温下静置25 min,在405 nm下测定吸光度值。回归方程为A=0.1 028c+0.007 4,相关系数R2=0.999 4。精密度试验和加标回收试验结果显示,加标回收率为96.49%~103.64%,RSD为1.29%,该方法操作简便、准确性好,可作为碱韭总黄酮的定量分析方法。使用该方法测定2019年、2020年、2021年采集的碱韭叶、花、根中总黄酮含量,发现碱韭总黄酮主要存在于叶和花中,这与光照长短影响植物体内次生代谢物的积累有重要关系,光照越长,该部位代谢积累的总黄酮含量越高。而根深入地下,无法接受照射,故总黄酮含量最低[6]。叶中平均黄酮含量[(42.70±6.65)mg·g-1]高于《中华人民共和国药典》中记录植物韭菜籽中的总黄酮含量
(34.26 mg·g-1)[13],表明碱韭具有较高的黄酮功能价值,可通过刈割方式加以利用,该结果可为进一步开发利用和保护碱韭资源提供科学依据。
参考文献
[1]马毓泉.内蒙古植物志[M].呼和浩特:内蒙古人民出版社,1994.
[2]布林特古斯.蒙古族食谱[M].赤峰:内蒙古科学技术出版社,1987.
[3]赵鹏,董贵成,门中华.内蒙古地区野生碱韭花期主要营养成分研究[J].北方园艺,2016(14):152-156.
[4]赵鹏,秦永林,门中华,等.内蒙古野生碱韭食用花中营养成分分析[J].现代食品科技,2016(12):292-297.
[5]赵凯丽,王秋亚,王慧,等.黄花菜总黄酮的提取、测定方法和生物活性研究进展[J].山东化工,2022,51(11):110-112.
[6]杨永涛.罗布麻总黄酮的提取、分离纯化及其抗氧化性能研究[D].广州:华南理工大学,2018.
[7]赵振,刘霞,黄昭,等.苎麻籽总黄酮含量测定方法比较研究[J].食品安全质量检测学报,2019,10(18):
6195-6200.
[8]张秀梅,曾祖平,王永红.柿叶总黄酮提取工艺的研究[J].时珍国医国药,2008(1):35-36.
[9]王博文.氧化石墨烯辅助乙醇提取竹叶黄酮及其在香烟中的应用[D].合肥:合肥工业大学,2017.
[10]苏学军,裘可,宗春燕.荞麦壳中总黄酮含量测定方法优选[J].化学工程师,2021,35(12):14-16.
[11]何珺,颜仁梁,刘志刚.NaNO2-Al(NO3)3-NaOH比色法测定总黄酮应用中的常见问题[J]. 今日药学,2009,19(12):18-21.
[12]乐薇,吴士筠.AlCl3比色法测定箬叶总黄酮含量[J].黑龙江农业科学,2015(2):98-101.
[13]郭奎彩,胡国华.超声提取韭菜籽总黄酮及其抗氧化活性研究[J].中国食品添加剂,2014(4):47-52.

