地舒单抗与唑来膦酸治疗绝经后骨质疏松症的疗效对比研究
李小霜 孙 娟 何苗苗 张珍华 于洪恩
骨质疏松症(ostegtporosis, OP)是一种骨量减低和骨微结构恶化导致骨折风险增加的全身代谢性疾病,在绝经后中老年女性中最为常见,即绝经后骨质疏松症(postmenopausal ostegtporosis, PMO)[1]。PMO多发生在女性绝经后5~10年,且早期症状隐匿,骨折是其严重的并发症,可导致患者疼痛、残疾甚至死亡,因此,科学有效防治PMO至关重要[2]。PMO患者由于卵巢功能衰退,导致雌激素水平下降,破骨细胞活性增强,骨吸收大于骨形成,导致大量骨质流失,破骨细胞活性增强是PMO发生的关键因素,研究并开发以骨吸收抑制剂为主的治疗药物是防治PMO的重要方向[3]。
地舒单抗(denosumab, DEN)属于核因子κB受体活化体配体(receptor activator for nuclear factor-κB ligand inhibitor, RANKL)抑制剂,RANKL是破骨细胞分化、激活和存活的主要介质,DEN通过干扰RANKL与RANK的结合,从而抑制破骨细胞的形成和存活,使骨吸收与骨形成趋向平衡[4]。唑来膦酸(zoledronic acid, ZOL)通过抑制法尼基焦磷酸盐合成酶(famesyl pyrophosphate synthase, FPPS)发挥其抗骨再吸收作用,是目前药理活性最强的双磷酸盐类药物[5]。DEN与ZOL都是抗骨吸收药物,但给药途径以及药物作用特点有所不同。本研究回顾性对比分析DEN和ZOL治疗PMO为期1年的治疗效果,以骨密度(bone mineral density, BMD)、骨代谢标志物(bone metabolic markers, BTM)以及骨痛视觉模拟评分(visual analogue scale, VAS)作为评价指标,以期对DEN与ZOL在临床治疗PMO时的选择提供理论基础。
资料与方法
1.一般资料:本研究为回顾性对比分析研究,查阅2020年10月~2021年6月于徐州医科大学附属医院住院的PMO患者资料,筛选出接受DEN和ZOL治疗≥1年的女性患者作为研究对象,根据使用药物的不同将其分为两组:DEN组(n=40)和ZOL组(n=46)。纳入标准:①符合《原发性骨质疏松症诊疗指南》中OP的诊断标准[6];②年龄为50~60岁且自然绝经时间≥2年的女性患者。排除标准:①代谢性骨病、维生素D缺乏性疾病患者;②类风湿关节炎、系统性红斑狼疮等免疫系统疾病患者;③患有甲状腺疾病、甲状旁腺疾病等内分泌系统疾病患者;④伴严重的心脏、脑、肝脏、肾脏等功能障碍疾病患者;⑤两年内使用过影响骨代谢药物的患者;⑥使用过雌激素治疗的患者。本研究经徐州医科大学附属医院医学伦理学委员会批准(伦理学审批号:XYFY2022-KL014-01)。
2.方法:DEN组患者给予皮下注射DEN 60mg,2次/年;ZOL组患者给予静脉滴注ZOL 5mg,1次/年。治疗期间所有患者每日补充维生素D3125IU和碳酸钙600mg,治疗为期1年。
3.观察指标:收集两组患者的基础指标:年龄、身高、体重、计算体重指数(body mass index, BMI) [BMI=体重/身高2(kg/m2)]。采集患者治疗前和治疗1年后静脉血,于院内检验科检测BTM,主要包括骨源性碱性磷酸酶(bone alkaline phosphatase, BAP)、Ⅰ型前胶原氨基端延长肽(total procollagen type Ⅰ amino-terminal propeptide, TP1NP)、β-胶原特殊序列(β-cross laps,β-CTX)、骨钙素(bone gla protein, BGP)、甲状旁腺激素(parathyroid hormone, PTH)、25羟基维生素D(25OHD)等;以及血清碱性磷酸酶(alkaline phosphatase, ALP)、血钙(Ca)、血磷(P)、血肌酐(Serum creatinine, Scr)、血尿素氮(blood urea nitrogen, BUN)等相关指标。采用双能X线骨密度测量仪测定所有患者治疗前及治疗1年后腰椎(L1~4)和髋部(股骨颈、Wards三角、大粗隆、股骨干、全髋)的骨密度值。采用骨痛视觉模拟量表(visual analogue scale, VAS)对治疗前后骨关节疼痛症状评分,总分为10分,评分越高表示疼痛越剧烈。临床疗效根据《原发性骨质疏松症诊疗指南》拟定评价标准进行分级[6]。疗效共分3级:①显效:患者临床症状基本消失,BMD水平显著升高;②有效:患者临床症状有所改善,BMD水平升高但不显著;③无效:患者临床症状未改善甚至加重,BMD未升高或降低。并计算DEN与ZOL 两种药物治疗PMO的总有效率。治疗总有效率(%)=(显效+有效)例数/总例数×100%。

结 果
1.两组患者的一般资料比较:两组患者的年龄、BMI、Ca、P、BUN、Scr水平比较,差异均无统计学意义(P均>0.05),具有可比性,详见表1。
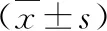
表1 两组患者的一般资料比较
2.两组患者的骨代谢指标比较:治疗前两组患者BAP、TP1NP、β-CTX、BGP、25OHD、PTH及ALP水平比较,差异均无统计学意义(P>0.05)。治疗1年后,两组患者BAP、TP1NP、BGP、β-CTX及ALP水平较治疗前均显著下降(P<0.05);25OHD水平较治疗前显著升高(P<0.05);PTH水平较治疗前无明显变化(P>0.05)。DEN组β-CTX水平较ZOL组下降更显著(P<0.05),两组患者治疗后BAP、TP1NP、BGP、25OHD、PTH及ALP水平比较,差异均无统计学意义(P均>0.05),详见表2。

表2 两组患者的骨代谢指标比较
3.两组患者的骨密度值比较:两组患者治疗前腰椎(L1、L2、L3、L4、L1~4)和髋部(股骨颈、Wards三角、大粗隆、股骨干、全髋)骨密度值比较,差异均无统计学意义(P均>0.05)。治疗1年后,两组患者各部位骨密度值较前均显著升高(P<0.05)。DEN组患者治疗后L1~4、股骨颈、全髋等部位骨密度值较ZOL组升高更显著(P<0.05);两组患者治疗后L1、L2、L3、L4、Wards三角、大粗隆、股骨干等部位骨密度值比较,差异均无统计学意义(P均>0.05),详见表3、表4。
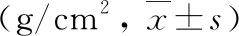
表3 两组患者的腰椎骨密度值比较
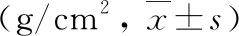
表4 两组患者髋部骨密度值比较
4.两组患者的VAS评分比较:两组患者治疗前VAS评分比较,差异无统计学意义(P>0.05)。治疗1年后,两组患者VAS评分较治疗前均显著下降(P均<0.05),DEN组VAS评分明显低于ZOL组,差异有统计学意义(P<0.05),详见表5。
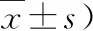
表5 两组患者的VAS评分比较(分,
5.两组患者的临床疗效比较:治疗前ZOL组患者的骨折发生率为15.22%,DEN组为12.50%;治疗后ZOL组患者的骨折发生率为6.52%,DEN组为5.00%,两组患者骨折发生率较治疗前均显著降低(P均<0.05)。DEN组患者的临床疗效优于ZOL组,差异有统计学意义(P<0.05);两组患者的总有效率比较,差异无统计学意义(P>0.05),详见表6。

表6 两组患者的临床疗效比较[n(%)]
6.两组患者的不良反应比较:治疗期间,ZOL组患者出现发热4例,DEN组患者出现发热1例、乏力1例,对症处理后症状均得到缓解,所有患者治疗期间肝肾功能均未出现异常。
结 果
随着我国人口老龄化加剧,PMO临床病例呈逐年增高趋势,研究显示,我国≥50岁女性OP发生率为32.5%,是同年龄组男性的4~5倍[7]。绝经后女性由于体内雌激素缺乏,导致骨吸收大于骨形成的高转换型的OP[8]。双膦酸盐类药物是临床上治疗PMO的首选药物,研究证明,ZOL可显著提高骨密度值,降低骨转换指标,降低骨折风险[9]。DEN于2020年被我国批准用于治疗有高骨折风险的PMO患者,其成分主要为全人源单克隆抗体,可降低骨吸收,改善骨强度[10]。国外一项前瞻性研究显示,使用DEN治疗1年后,腰椎、全髋、股骨颈BMD与治疗前比较的百分比变化分别7.3%±23.6%、3.6±31.4%和3.2%±10.7%,有效性高且耐受性良好[11]。
BTM可以对骨转化进行特异地评估。TP1NP、BGP、BAP由成骨细胞产生并分泌,反映骨形成的指标,β-CTX是Ⅰ型胶原的代谢产物,反映骨吸收的指标。ALP有50%来源于骨,PMO患者会伴随ALP活性升高。阿根廷的一项研究显示,在DEN治疗12个月期间,BGP、β-CTX及ALP水平均呈下降趋势[12]。在相关研究中,与双膦酸盐和安慰剂比较,DEN组患者的β-CTX水平下降幅度最大,TP1NP、β-CTX及BAP水平也较治疗前下降[13]。本研究中治疗后两组患者的BAP、TP1NP、BGP、β-CTX及ALP水平均明显下降,表明DEN和ZOL能够显著抑制骨吸收,也能抑制骨形成,全面降低骨代谢指标。治疗期间两组患者均补充了维生素D和碳酸钙,因此治疗后两组患者血清25OHD水平均较前升高,且组间比较差异无统计学意义(P>0.05)。
本研究中DEN组患者治疗后β-CTX水平显著低于ZOL组,与Kang等[14]报道一致。这可能与两者作用机制不同有关。在雌激素缺乏导致的PMO中,RANKL的表达水平升高,可诱导破骨细胞前体细胞分化、增殖,导致破骨细胞活化和骨吸收增加,因此减少前体细胞的分化是高吸收性骨病的治疗方式之一。DEN与RANKL结合,阻止其与RANK相互作用,抑制破骨细胞形成和功能,进而减少骨吸收;ZOL抑制骨代谢通路中FPPS的活性,诱导破骨细胞凋亡来减少骨吸收,但不影响破骨细胞的形成[15]。与ZOL比较,可能DEN对破骨细胞的抑制作用更加突出。
本研究结果显示,两组PMO患者接受治疗1年后,腰椎、髋部骨密度值较治疗前均明显升高,其中DEN组腰椎(L1~4)、股骨颈、全髋等部位骨密度值较ZOL组升高更显著,其他部位两组间比较,差异无统计学意义(P>0.05)。韩国一项研究表明,DEN对PMO患者的腰椎、全髋的骨密度值改善效果优于ZOL,与本研究结果一致[14]。研究认为,ZOL对破骨细胞的抑制需要与骨矿物质结合,而对羟基磷灰石的强亲和力可能限制ZOL在骨骼中的均匀分布;而DEN则通过与RANKL结合,直接抑制破骨细胞形成、功能与存活,DEN是一种循环抗体,可到达骨骼的各个部位,尤其是在骨深部[14]。DEN对骨重塑的抑制作用可能强于ZOL。
缓解患者疼痛是治疗的重要目的之一。本研究结果显示,治疗1年后,两组患者的VAS评分较治疗前均显著降低,DEN组较ZOL组降低更显著,缓解疼痛效果更明显,但二者在总有效率方面比较差异无统计学意义(P>0.05)。治疗期间两组患者的不良反应情况比较,差异无统计学意义(P>0.05)。同时两组患者治疗后骨折发生率较治疗前均显著下降,组间比较,差异无统计学意义(P>0.05)。骨密度的增加能够降低脆性骨折发生的风险。一项Meta分析表明,DEN与ZOL比较,在降低骨折风险上无显著差异,但停用DEN后发生骨折的风险会增加,这可能与停药后BTM的持续升高有关[16]。因此,对于已经开始DEN治疗的患者,应嘱其不要自行停药,以免增加骨折风险[17]。同时研究表明,使用DEN治疗的患者在1年内发生复合性心血管疾病的风险低于ZOL,DEN更适合患有心血管疾病的患者使用,ZOL可能更适合60岁以上或免疫系统紊乱的患者[17]。具体选择使用哪种药物需要根据患者的情况来决定。
DEN和ZOL治疗PMO均有较好的疗效,能够有效提高骨密度值,改善骨代谢指标。本研究结果初步证实DEN较ZOL在增加腰椎(L1~4)、股骨颈、全髋等部位骨密度值及减轻患者疼痛方面更有优势。本研究仍存在一定的局限性:①由于是回顾性研究,BMD和BTM只能从数量有限的患者中收集,可能导致患者选择偏倚;②各组样本量偏小、随访时间短也可能对研究结果产生一定的影响,为了进一步评估DEN和ZOL对PMO的疗效,后期需要开展更大样本量的随机对照试验予以进一步证实。

