NETs在急性呼吸窘迫综合征新生儿中的变化及意义
吴泽明 朱海金 陈 海 相 虹 常 明
急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)是急性肺损伤(acute lung injury, ALI)的严重阶段,是由感染、创伤及休克等因素引起的急性弥漫性肺损伤,临床上多表现为急性呼吸窘迫、低氧血症及呼吸衰竭,尽管临床上已出现众多支持治疗应对ARDS,但总体病残率仍很高,预后差[1]。ARDS发病机制复杂,至今未被阐明,目前认为大量中性粒细胞聚集、活化及凋亡引起肺部炎性反应导致肺损伤是ARDS发生的病理基础[2]。Brinkmann等[3]在ARDS患者肺泡灌洗液及血浆中发现中性粒细胞胞外诱捕网(neutrophil extracellular traps, NETs),推测NETs与肺损伤的发生密切相关。NETs是由活化的中性粒细胞释放的染色质,其组成成分包括DNA、中性粒细胞弹性蛋白酶(neutrophil elastase, NE)、髓过氧化物酶(myeloperoxidase, MPO)等,一方面NETs利用DNA的网状结构抓捕病原体,同时NE、MPO等蛋白成分杀灭病原体;另一方面NE、MPO等通过诱导上皮和内皮细胞连接失调或细胞死亡损害肺上皮-内皮屏障,导致肺泡中蛋白质渗出和炎性细胞的大量积累,加速ARDS的发生[4]。
本课题组前期动物研究发现,相较于健康大鼠,肺损伤新生大鼠MPO等蛋白表达量显著增高,游离DNA(cell-free DNA, cf-DNA)水平上升,提示急性肺损伤中存在NETs的形成[5]。Marcos等[6]研究结果提示,活化的新生儿中性粒细胞可以形成NETs。目前NETs在成人ARDS及小鼠ALI中均有研究,新生儿ARDS的研究报道较少。本研究旨在探讨新生儿ARDS中是否存在NETs的形成,以及动态观察cf-DNA/NETs的变化在新生儿ARDS病情严重程度及治疗效果判断中的意义,现报道如下。
资料与方法
1. 一般资料:前瞻性选取2020年10月~2022年4月江苏大学附属医院收治的需呼吸机治疗的37例ARDS新生儿为ARDS组,其中男性21例,女性16例,平均胎龄为38.1±1.2周。诊断标准:符合2017年蒙特勒诊断标准[7];具体如下:①明确或可疑临床损伤后出现了ARDS,氧合障碍伴随残气量下降,需要正压通气以利于肺复张;②排除与ARDS有不同的病理生理基础的新生儿ARDS、新生儿短暂呼吸增快,以及先天性肺畸形、肺表面活性物质(pulmonary surfactant, PS)合成相关基因缺陷所致ARDS;③肺部影像学显示双侧弥漫性不规则的透光度下降、渗出或白肺,这些改变不能被其他原因完全解释,如局部积液、肺不张、新生儿ARDS、新生儿短暂呼吸增快或先天性肺畸形等;④肺水肿引起的呼吸衰竭不能够完全由心力衰竭来解释;⑤根据氧合指数(oxygenation index, OI)判断病情轻重:轻度为4≤OI<8,中度为8≤OI<16,重度为OI≥16。其中OI=(吸入氧浓度×平均气道压×100)/动脉血氧分压(cmH2O/mmHg)。同时满足上述5条标准即可以诊断为ARDS,依据第5条可知本研究ARDS组分为轻度组12例、中度组15例及重度组10例。
选择同期分娩的27例正常新生儿为对照组,其中男性16例,女性11例,新生儿平均胎龄为38.5±0.7周。以上入选对象均征得家属同意,本研究经江苏大学附属医院医学伦理学委员会审核批准(伦理学审批号:SWYXLL20191119-14)。
2.方法: ARDS组于治疗前、治疗3天及治疗7天3个时间点各抽取静脉血2ml,对照组抽取一次静脉血2ml,离心血清(离心转速3000r/min,离心时间10min),取上层血清于-80℃冰箱保存。采用基于PicoGreen荧光染料法检测cf-DNA/NETs水平,Quant-ItTM PicoGreen dsDNA Assay Kit购自美国Invitrogen公司;采用酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)检测血浆NE及TNF-α水平,ELISA试剂盒购自武汉伊莱瑞特生物科技有限公司。

结 果
1.ARDS组和对照组新生儿的一般资料比较:ARDS组和对照组新生儿在胎龄、出生体重及性别方面比较,差异均无统计学意义(P均>0.05),详见表1。
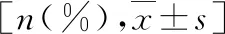
表1 ARDS组和对照组新生儿的一般资料比较
2.ARDS各组和对照组新生儿的cf-DNA、NE及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平比较:结果显示,差异均有统计学意义(F=57.517,P<0.001;F=219.408,P<0.001;F=133.200,P=0.005)。经两两比较发现,ARDS各组cf-DNA、NE及TNF-α水平均高于对照组(P<0.05),重度组cf-DNA、NE及TNF-α水平均高于轻度组及中度组(P<0.05),中度组NE水平高于轻度组(P<0.05),但cf-DNA及TNF-α水平与轻度组比较,差异无统计学意义(P>0.05),详见表2。
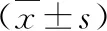
表2 ARDS各组和对照组新生儿的cf-DNA、NE及TNF-α水平比较
3.ARDS各组新生儿不同时间cf-DNA、NE及TNF-α水平比较:与治疗前比较,ARDS各组治疗3天及7天时cf-DNA、NE及TNF-α水平均有不同程度下降,差异有统计学意义(时间:F=52.750,P<0.001;F=44.859,P<0.001;F= 62.098,P<0.001;组间:F=21.237,P<0.001;F=75.427,P<0.001;F=31.776,P=0.005;交互:F=3.042,P=0.023;F=3.047,P=0.023;F=8.618,P<0.001),详见表3。
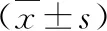
表3 ARDS各组新生儿不同时间cf-DNA、NE及TNF-α水平比较
4.cf-DNA与NE及TNF-α水平相关性分析:Pearson相关性分析结果显示,cf-DNA与NE及TNF-α水平均呈正相关(P<0.05),详见表4。

表4 cf-DNA水平与NE及TNF-α水平相关性分析
结 果
ALI/ARDS是多种因素导致的肺部病变,临床上表现为进行性呼吸困难和低氧血症,在新生儿危重症中较为常见[8]。新生儿作为人生的一个特殊阶段,引起ARDS的病因与儿童及成人也有所差异,肺内因素(肺炎、胎粪吸入综合征)和肺外因素(败血症、围生期窒息)是引起新生儿ARDS的重要原因,其自身较差的环境适应能力、未发育完善的器官及不成熟的免疫功能更是难以阻止病情恶化,甚至死亡[9,10]。因此早期判断病情严重程度,控制病情发展,有利于降低ARDS新生儿的病死率。目前认为,各种直接或间接因素损伤上皮细胞及内皮细胞,引起肺泡-毛细血管屏障功能丧失,液体涌入肺泡中,造成肺水肿;同时外界刺激使中性粒细胞和巨噬细胞活化,释放各种细胞因子产生持续炎性反应,如TNF-α、白细胞介素-6(interleukin-6, IL-6)等,加速ARDS的进展[2]。近年来研究显示,ARDS患者体内被刺激活化的中性粒细胞释放出NETs,在此过程中,活化的肽基精氨酸脱亚胺酶4(peptidylarginine deiminase 4, PAD4)、MPO及NE共同引起组蛋白裂解,弱化组蛋白及DNA的结合力,导致染色质解凝聚,核膜及细胞膜破裂后NETs释放到细胞外发挥灭菌作用,但NE及MPO等细胞毒性作用破坏肺上皮-内皮屏障结构完整性,富含蛋白质的液体向外释放,造成肺水肿,加剧ARDS的进展[11]。目前在多种疾病中都已发现NETs的参与[12,13]。通过测量NETs中的蛋白成分和DNA复合物间接反映NETs含量[14]。
在一项临床研究中,研究者检测未足月胎膜早破(preterm premature rupture of membranes, PPROM)新生儿及正常新生儿脐血的NE水平,发现PPROM组NE水平高于正常对照组,并且PPROM组中发生新生儿肺炎者NE水平高于未发生新生儿肺炎者,考虑NE对肺组织的过氧化损伤促进新生儿肺炎的发生、发展[15]。本研究结果显示,与对照组比较,ARDS组新生儿的NE水平上升,间接反映新生儿ARDS中存在NETs;与轻度组比较,中度组及重度组NE水平逐步升高;ARDS各组新生儿治疗前NE水平均高于治疗3天及7天时,推测高水平NE加重肺损伤程度,影响ARDS的进展与预后。
既往研究发现,肺泡巨噬细胞可分泌各种促炎性细胞因子如TNF-α等,促进中性粒细胞、单核细胞及巨噬细胞聚集,并使上皮细胞及效应T细胞活化加重肺部炎症表现,甚至发展为ARDS[16]。解霞等[17]通过监测新生儿ALI肺泡灌洗液中的TNF-α水平,发现ALI组TNF-α高于健康对照组,ALI组治疗后TNF-α水平明显降低,提示TNF-α或许可以作为预测新生儿ALI病情程度及预后的指标。本研究结果显示,ARDS各组新生儿的TNF-α水平均高于对照组,提示TNF-α参与ARDS的发生;ARDS各组新生儿的TNF-α水平比较,重度组高于轻度组及中度组,但轻度组与中度组比较差异无统计学意义,猜测与机体内部抗炎有关,治疗后ARDS各组新生儿的TNF-α水平均下降,以上结果提示TNF-α在评估新生儿ARDS病情程度及治疗效果中有一定价值。
cf-DNA是由中性粒细胞衍生而来,故可通过检测cf-DNA来获悉血浆中NETs的含量[18]。临床研究中用PicoGreen荧光染料法检测重症肺炎并发ARDS及重症肺炎患者外周血cf-DNA水平,结果显示,重症肺炎并发ARDS组cf-DNA水平较重症肺炎组明显升高,ARDS组治疗48h后cf-DNA水平逐步下降,提示高水平的NETs影响ARDS发生、发展[19]。本课题组前期研究结果提示,ALI小鼠中存在NETs的形成,cf-DNA可以作为评估ALI小鼠肺损伤严重程度的指标[5]。本研究结果显示,ARDS各组新生儿的cf-DNA水平高于对照组,进一步提示ARDS存在NETs形成;ARDS各组中重度组cf-DNA水平最高,轻度组与中度组cf-DNA整体水平无明显差异,猜测体内过量的NETs可加速ARDS进展,治疗后ARDS各组均有下降,提示监测cf-DNA对新生儿ARDS病情严重及治疗效果评估有一定价值。
研究发现,在ALI/ARDS发生时,NETs激活巨噬细胞,诱导M0巨噬细胞分化为M1型并产生TNF-α等炎性介质促进炎性反应,同时TNF-α等也可以促进NETs的生成,循环反复[4]。本研究结果显示,ARDS新生儿的cf-DNA与NE及TNF-α均呈正相关,考虑NETs与炎性介质及免疫细胞相互作用,共同促进炎性反应,影响新生儿ARDS发生、发展。
综上所述,本研究对NETs相关标志物进行动态监测,发现ARDS新生儿外周血NETs及相关标志物NE及TNF-α水平显著升高,病情程度越重,差异性越明显;治疗后NETs相关标志物NE及TNF-α水平逐渐降低,且cf-DNA与NE及TNF-α均呈正相关,提示cf-DNA/NETs对新生儿ARDS病情严重程度及治疗效果评估有一定的价值。本研究后期需扩大样本量,延长随访时间,完善cf-DNA/NETs在该疾病中的作用机制,予以验证本研究结论。

