SLFN11基因表达对SW480细胞L-OHP敏感度的影响
田 力 张宁坤 杨 璐 夏 菁 彭朝胜
结直肠癌(colorectal cancer,CRC),全球最常见的恶性肿瘤之一,其发生率及病死率分居肿瘤第3位及第2位,我国CRC发生率及病死率也具此特点[1,2]。40%~60%初诊CRC患者发现时就已为进展期[3];40%早期根治性手术切除术后的患者会出现复发或发生远处转移[4]。抗肿瘤药物是患者的主要治疗手段,奥沙利铂(oxaliplatin,L-OHP)是治疗CRC的重要化疗药物之一,但其有效率因耐药和毒瘤性反应而降低。因此,寻找L-OHP药物的疗效预测因子、制定合理的个体化治疗方案,是肿瘤治疗的一个重要方向。
SLFN11(Schlafen 11)基因属人源性Slfn(Schlafen)家族成员之一。Slfns基因家族包括 10 种鼠源和 5 种人类亚型,据基因同源性和编码蛋白的大小可以分成 3 组[5]。研究发现,SLFN蛋白为 SLFN1,在NIH-3T3 成纤维细胞中异位表达时观察到 G0/G1期细胞周期停滞的情况,故而将其命名为 Schlafen1[6]。该家族基因具有对细胞生长起重要的负调控作用,作为潜在的抑癌基因而被逐渐重视。众多临床研究证实SLFN11基因可影响抗肿瘤细胞铂类药物(顺铂、卡铂)的敏感度[7,8]。
L-OHP与顺铂、卡铂同属于烷化剂抗肿瘤药物,属于第3代铂类药物。但目前还没有关于SLFN11基因表达和L-OHP敏感度相关的细胞学研究,临床研究也很少,研究显示,SLFN11高表达可影响CRC以L-OHP为基础的联合化疗的患者预后。这提示SLFN11与L-OHP疗效可能存在一定的相关性,但由于此研究仅为单中心小样本量临床研究,其结果的可靠性需要进一步在细胞学及临床上得到证实。因此本项目拟从细胞学层面体外验证SLFN11对L-OHP抑制人直肠癌细胞(SW480)作用的影响,探索SLFN11表达水平对L-OHP疗效的评估意义,为寻找该药预测因子提供依据。
材料与方法
1.主要材料和试剂:SLFN11siRNA序列(汉恒生物科技有限公司)、mock序列(汉恒生物科技公司)、SLFN11基因和内参基因GAPDH序列[生工生物工程(上海)股份公司]、Lipo6000TM转染试剂(C0526,上海碧云天生物技术有限公司)、AG RNAex Pro reagent(AG21102,湖南艾科瑞生物工程公司)、Evo M-MLV RT Premix for qPCR(AG11706,湖南艾科瑞生物工程公司)、SYBR Green Premix Pro Taq HS qPCR Kit(AG11701,湖南艾科瑞生物工程公司),SLFN11一抗(26060-1-AP,武汉三鹰生物技术有限公司)、HRP标记的兔抗羊IgG(ZB-2301,北京中杉金桥生物技术有限公司)、细胞周期与凋亡检测试剂盒(C1052,上海碧云天生物技术有限公司)、L-OHP(HY-17371,美国MedChemExpres公司)。
2.SW480细胞培养:使用含10%胎牛血清L-15培养液,培养人结肠癌细胞系SW480(CL-0223A,武汉普诺赛生命科技有限公司)。待铺板率达到80%~90%时,经0.25%胰酶消化,1000r/min离心5min,重悬后按1∶2进行传代,随后选取处于对数生长期细胞进行后续实验。为了避免实验误差并保证数据可重复性,每批实验验证中每组均设计3个生物学重复。
3.小干扰RNA(small interfering RNA,SLFN11siRNA)细胞转染:设计3组SLFN11siRNA序列和1组mock序列(表1),以1×105/孔密度将SW480细胞接种于6 孔板中,培养过夜,待细胞铺板率达到 30%~40%分组处理:①空白对照组(Control):未进行转染操作;②阴性对照组:siRNA-NC:mock序列转染组;③3个序列验证组:分别转染SLFN11-siRNA1-A3。转染过程依Lipo6000TM转染试剂说明书进行。转染后6h更换新鲜培养基继续培养48h。用于后续RT-qPCR、Western blot法、细胞周期与细胞凋亡实验。
4.RT-qPCR检测:利用RT-qPCR检测(表2)SLFN11基因mRNA水平。提取细胞总RNA,依试剂盒说明进行反转录合成cDNA上机进行检测。采用2-ΔΔCt方法计算各组样本对空白对照组目的基因相对表达量,SLFN11基因相对表达量= 2-[ΔCT(SLFN11)-ΔCT(GAPDH)]。

表2 SLFN11基因RT-qPCR序列
5.Western blot法检测SLFN11蛋白表达:收取各组细胞,加入含有蛋白酶抑制剂的RIPA裂解缓冲液,于冰上裂解30min。4℃、12000r/min离心5min,进行总蛋白定量。取总蛋白30μg经SDS-PAGE电泳、转膜、SLFN11 一抗、HRP-IgG二抗孵育后,利用Image J图像分析软件分析灰度值表示目的蛋白相对表达量:SLFN11蛋白相对表达量(%)=siRNA转染组灰度值/control组灰度值×100%。
6.L-OHP药物毒性实验:结合RT-qPCR和Western blot法检测结果,将SW480细胞分为两组,即mock组和SLFN11基因沉默组(SLFN11-/-)。用PBS配制5mmol/L药物母液,并稀释0、0.9375、1.875、3.75、7.5、15、30、40、50μmol/L 9个浓度。作用于转染细胞48h后,清洗细胞,采用MTT检测方法读取吸光度A值。细胞抑制率(%)=1-(各药物浓度A值/未加药物A值)×100%。据药物毒性数据,选取L-OHP浓度3.75μmol/L作用于SW480细胞株进行后续细胞周期及凋亡实验。
7.细胞凋亡:细胞随机分为4组:control-BL组:SW480+siRNA-NC;control-L-OHP组:SW480+siRNA-NC+3.75μmol/L L-OHP;SLFN-/--BL组:SW480+SLFN11siRNA;SLFN-/--L-OHP组:SW480+SLFN11siRNA+3.75μmol/L L-OHP。细胞转染48h后更换含有3.75μmol/L L-OHP培养基,继续培养48h。收取细胞按AnnexinⅤ-FITC凋亡染色试剂盒中的要求进行检测。细胞凋亡率(%)=右下象限细胞比例(%)+右上象限细胞比例(%)。
8.细胞周期:依上述操作过程进行实验并收集细胞。经1ml PBS洗细胞1次,加入500μl PBS 4℃避光孵育30min。以标准程序用流式细胞仪检测,一般计数(2~3)万个细胞,荧光补偿调节使用正常SW480细胞,分析单个细胞上PI的荧光强度,软件自动拟合细胞周期。

结 果
1.SLFN11基因mRNA低表达有效siRNA筛选:结合RT-qPCR和Western blot法分别对SLFN11基因mRNA和蛋白表达情况进行分析。结果发现,与空白对照比较,siRNA-NC组、SLFN siRNA-1和SLFN siRNA-2组对SW480细胞SLFN11mRNA和蛋白表达均无显著性影响(图1),而SLFN siRNA-3显著降低了SLFN11mRNA和蛋白的表达,分别降低约90%和80%。
2.SLFN11基因沉默后对L-OHP抑制细胞生长影响:以SLFN siRNA-3为刺激物制备SW480 SLFN11基因沉默模型,并进行药物L-OHP检测。结果表明,SLFN11siRNA干扰组(SLFN siRNA-3)较未干扰(mock)组,细胞生长抑制率明显减低(P<0.05),未干扰组IC50值为36.19μmol/L,SLFN11siRNA干扰组IC50值为43.55μmol/L。说明SLFN11基因沉默可有效降低L-OHP对SW480抑制作用的敏感度(图2)。
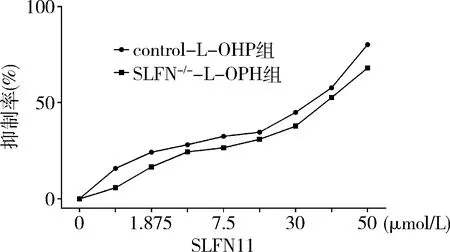
图2 SLFN 11沉默对L-OHP抑制SW480细胞株生长的影响
3.SLFN11基因沉默对L-OHP诱导SW480细胞凋亡的影响:对SW480凋亡率统计分析得出,与control-BL组(4.51%±0.25%)比较,L-OHP药物干预(control-L-OHP组, 29.86%±0.28%)SW480细胞凋亡率极显著升高,提高25.35%(P<0.05)。与SLFN-/--BL组比较(6.56%±0.30%),SLFN-/--L-OHP组细胞凋亡率 (12.79%±0.29%)极显著地增加,提高6.23%(P<0.05)。与control-L-OHP组比较,SLFN-/--L-OHP组细胞凋亡率极显著降低(P<0.05),降低17.07%。与control-BL组比较,SLFN-/--BL组细胞凋亡率差异无统计学意义(P>0.05)。检测结果显示,一方面L-OHP可有效诱导SW480凋亡;另一方面SLFN11基因沉默后能够有效抑制L-OHP诱发的肠癌细胞凋亡行为(图3、图4)。

图3 SLFN11对L-OHP阻滞SW480细胞株细胞凋亡的影响A.control-B组凋亡细胞百分比;B.SLFN-/--BL组凋亡细胞百分比;C.control-L-OHP 组凋亡细胞百分比;D.SLFN-/--L-OHP组凋亡细胞百分比
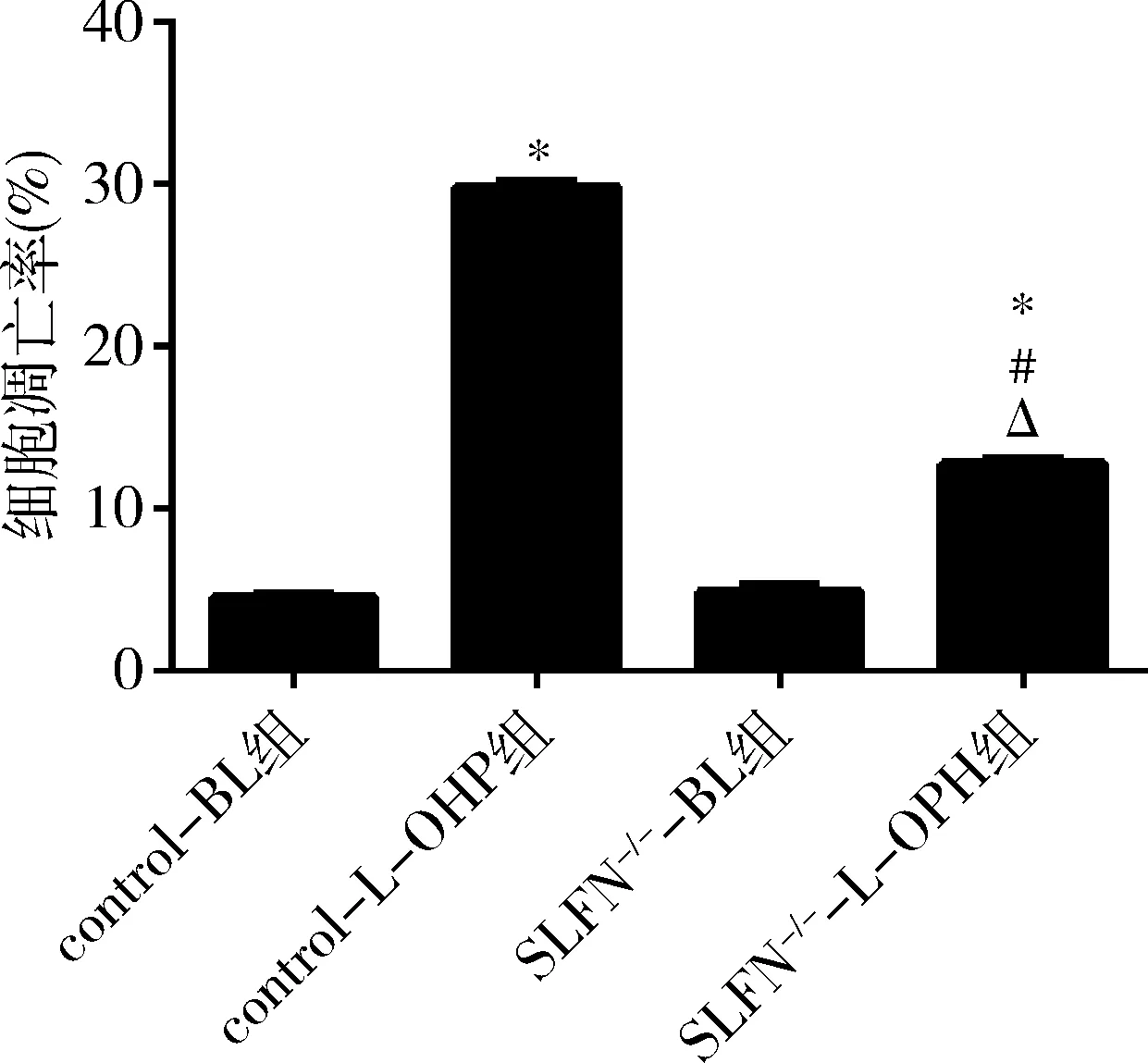
图4 SLFN11基因沉默对L-OHP诱导SW480细胞凋亡率与control-BL组比较,*P<0.05;与control-L-OHP组比较,#P<0.05;与SLFN-/--BL组比较,ΔP<0.05
4.SLFN11基因沉默对L-OHP阻滞SW480细胞周期的影响:对SW480细胞周期G2/M期比例进行统计分析,与control-BL组(23.30%±0.13%)比较,control-L-OHP组(32.04%±0.41%)SW480细胞G2/M期比例极显著增加,升高8.74%(P<0.05)。与SLFN-/--BL组(24.37%±0.30%)比较,SLFN-/--L-OHP组(27.21%±0.31%)G2/M期比例显著增加(P<0.05),升高2.84%。SLFN11-/--L-OHP组与control-L-OHP组比较G2/M期比例显著降低(P<0.05),减少了4.83%。与control-BL组比较,SLFN-/--BL组对细胞周期比例无显著影响(P>0.05,图4)。一方面表明L-OHP能够有效诱发肠癌细胞株SW480细胞周期阻滞。另一方面说明SLFN11敲除后能够有效抑制L-OHP诱发的肠癌细胞周期阻滞行为(图5、图6)。
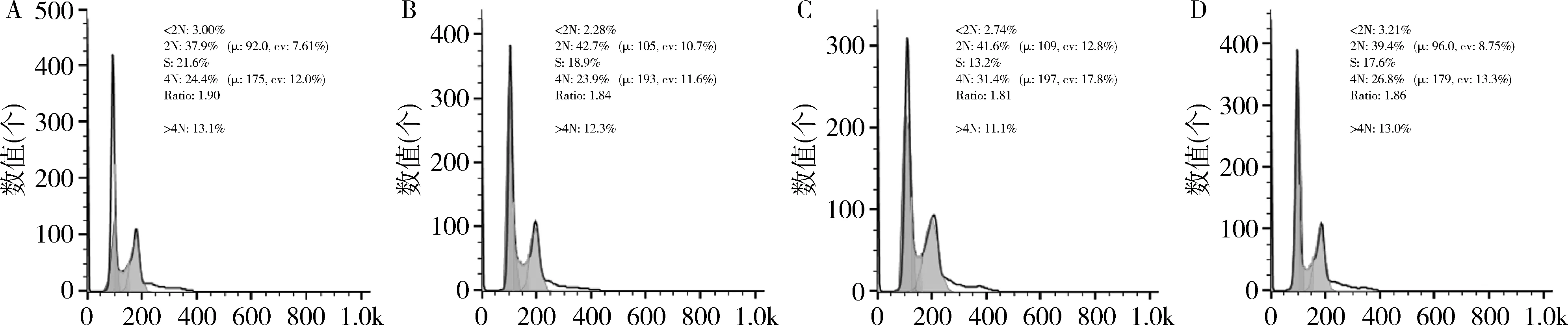
图5 SLFN11基因沉默对L-OHP诱导SW480周期变化影响A.control-BL组细胞周期分布;B.SLFN-/--BL组细胞周期分布;C.control-L-OHP 组细胞周期分布;D.SLFN-/--L-OHP组细胞周期分布

图6 SLFN11对L-OHP阻滞SW480细胞周期G2/M期比例影响A.与control-BL组比较,*P<0.05;与control-L-OHP组比较,#P<0.05;与SLFN-/--BL组比较,ΔP<0.05
讨 论
化疗是进展期CRC患者重要治疗手段,可有效提高患者总生存期和无疾病进展生存期。治疗基本按照肿瘤治疗NCCN(The National Comprehensive Cancer Network)指南给予以L-OHP为基础的抗肿瘤治疗FOLFOX(L-OHP+氟尿嘧啶+亚叶酸钙)或XELOX方案(L-OHP+卡培他滨)。但因铂类药物包括L-OHP单药在肿瘤中的有效率不超过20%,联合用药有效率不超过50%,使用效果不够理想[9,10]。至今在临床上仍未发现一个能够预测L-OHP疗效的标志物。因此,探索L-OHP疗效预测因子的研究是实现肿瘤患者个体化治疗面临的迫切问题。
SLFN11是Slfns基因家族之一,由Schwarz等[11]于1998年发现,参与调控胸腺发育,对细胞生长、分化和免疫等功能都有调节作用。Barretina等[12]研究发现,其可表达于多种细胞系,且不同肿瘤细胞SLFN11表达水平不一。SLFN11基因可使多种肿瘤细胞及多种抗肿瘤药物敏感,如铂类衍生物,拓扑异构酶抑制剂,DNA合成抑制剂和PARP抑制剂[13]。Zoppoli等[14]研究表明,CRC和卵巢癌肿瘤组织中的SLFN11表达分布范围明显较周围正常组织增大;但较周围正常组织,肿瘤组织SLFN11表达水平明显减低。随后的一些基础研究也证实了SLFN11基因可影响肿瘤细胞CPT-11和铂类药物(顺铂、卡铂)的敏感度,如卵巢癌患者的以铂类药物为基础的化疗效果显示,SLFN11基因高表达患者疗效要明显优于低表达患者[15~17]。另外,SLFN11表达量与肿瘤细胞对DNA损伤药物的敏感度呈正相关,国内研究者认为主要是由于SLFN11高表达,促使复制蛋白A复合体(replication protein A complex,RPA)从单链DNA(single-stranded DNA,ssDNA)上脱落,抑制细胞周期维持和同源重组修复而造成对DNA损伤药物的敏感度[18]。
L-OHP为第3代铂类药物,虽与顺铂、卡铂同属于致DNA损伤的烷化剂,目前还没有关于SLFN11基因表达和L-OHP敏感度相关的细胞学研究,临床研究也相对较少。2015年一项临床研究发现,结直肠癌患者辅助以L-OHP为基础的联合化疗治疗中,KRAS基因野生型患者与突变型患者生存率比较,差异无统计学意义,但KRAS野生型、SLFN11表达水平高的CRC患者预后良好,其3年及5年生存率较SLFN11低表达的患者明显升高[19]。另外一项临床研究结果也表明,具有高SLFN11表达的胃癌患者比低SLFN11表达患者具有更好的生存期,在辅助以铂类(顺铂或L-OHP)为基础的联合化疗后,这种生存期优势更加明显。激活SLFN11活性可以增加铂类药物的敏感度,而下调SLFN11表达水平则引起铂类药物的耐药性。研究还发现,长期L-OHP治疗可抑制SLFN11的表达,从而引起耐药[20]。这些均提示SLFN11与L-OHP疗效可能存在一定的正相关性,但因这些临床研究仅为单中心小样本量临床研究,其结果的可靠性需进一步在细胞学及临床上得到证实。
笔者通过细胞学实验观察SLFN11对L-OHP抑制肿瘤细胞作用的影响,结果发现,经干预处理SLFN11基因表达减低后,L-OHP抑制SW480生长作用显著减弱。说明SLFN11基因低表达可减低SW480细胞株对L-OHP的敏感度,这与既往研究SLFN11基因表达影响肿瘤细胞对铂类药物敏感度的结论相一致,也与临床研究结果相符[20,21]。进一步研究发现,SLFN11低表达,可显著减低L-OHP诱导的细胞凋亡和细胞周期阻滞,主要影响集中在细胞周期G2/M期,与L-OHP引起肿瘤细胞 G2/M 期停滞相一致,这更进一步证实了SLFN11表达水平影响L-OHP抗肿瘤效应。
对于CRC患者,以L-OHP为基础的化疗方案和以伊立替康(CPT-11)为基础的化疗均是重要的一线或二线化疗方案,而SLFN11被发现与包含CPT-11的拓扑异构酶抑制剂敏感度也密切相关,那么对于CRC患者,SLFN11基因表达显得尤为重要,可以考虑作为化疗药物选择的预测基因,对患者进行L-OHP或CPT-11药物治疗的分层筛选,尽可能指导个体化治疗,从而提高患者的有效治疗。

