甲状腺乳头状癌组织中miR-137水平表达及相关实验研究
薛思军,涂霁韬(黄石市中心医院/湖北理工学院附属医院 .普通外科;.急诊科,湖北黄石 435000)
甲状腺癌(thyroid cancer)作为头颈部常见的内分泌肿瘤,发病率不断上升,且女性人群占比较高[1]。其中,约90%的病理类型是乳头状癌(papillary carcinoma),临床上主要采取手术切除治疗,多数患者术后预后良好,但部分患者由于出现淋巴结转移及复发而死亡[2]。微小核糖核酸(microRNA,miR)是一种含20 个左右核苷酸序列的短链RNA,可通过调控靶基因表达而参与细胞多种生物学功能[3],同时,多种疾病发生与miRNA 表达异常有关[4],有研究指出[5],miRNA 亦参与了甲状腺乳头状癌(papillary thyroid carcinoma,PTC)患者的基因调控。近年来研究发现,miR-137 作为一种调控因子参与了与细胞周期、增殖、分化、侵袭等相关的基因表达[6],在恶性肿瘤细胞生长及转移中发挥抑癌基因的作用[7]。然而目前,关于miR-137是否参与PTC 病程鲜有报道。本研究分析了PTC患者组织中miR-137 表达,并通过对人PTC 细胞株TPC-1 转染miR-137 模拟物,观察细胞增殖及侵袭能力的变化。
1 材料与方法
1.1 研究对象 收集2018 年4 月~2021 年4 月在黄石市中心医院普爱院区手术切除的121 例PTC及配对癌旁组织,快速放在液氮中,-80℃保存。患者术前均未行任何治疗,术后病理检查确证,排除急慢性感染、其他系统恶性肿瘤及心肝肾等重要脏器功能不全者。男性36 例,女性85 例;平均年龄50.82±7.89 岁;病灶:单个64 例,多个57 例;发生淋巴结转移49 例。本研究通过医院伦理委员会审批,患者签署知情同意书。TPC-1 细胞(上海传秋生物公司),保存于液氮中。
1.2 仪器与试剂 Trizol 和Lipofectamine 2000 转染试剂(美国Invitrogen 公司),反转录和SYBR Green qPCR Master Mix 试剂盒(上海复申生物公司),miR-137 和U6 引物由武汉百齐生物公司设计合成,胎牛血清和胰蛋白酶(美国Gibco 公司),DMEM 和MTT 液(美国Sigma 公司),miR-137模拟及阴性对照序列由上海吉玛公司设计合成,Transwell 小室及基质胶(美国Corning 公司),7500 实时荧光定量PCR 仪(美国ABI 公司)。
1.3 方法
1.3.1 qRT-PCR 法检测组织中miR-137 表达:取组织50mg,剪碎、研磨,加入细胞裂解液,用Trizol 试剂提取总RNA,紫外分光光度法检测纯度和浓度合格后,使用反转录试剂盒将总RNA 合成cDNA,并以其为模板按SYBR Green qPCR Master Mix 试剂盒说明,用实时荧光定量PCR 仪扩增引物。反应条件:95℃ 5min,95℃ 20s,55℃ 30s,70℃30s,循环40 次,使用2-△△Ct法计算组织中miR-137 表达水平进行相对定量。miR-137 和U6 引物序列见表1。

表1 引物序列
1.3.2 细胞培养和处理:取TPC-1 细胞,用DMEM 培养液(含胎牛血清100ml/L)培养,条件:5% (v/v)CO2,37℃,传代培养。将对数生长的细胞接种在6 孔板,用转染试剂进行分组处理:①miR-137 模拟物组(M 组):转染miR-137 模拟序列:5’-ACATCGTCTCTCATAGCAATAT-3’;②阴性对照组(NC 组):转染阴性对照序列:5’-ACGU GACACGUUCGGAGAATT-3’;③空白组(B 组):仅加入转染试剂。处理后继续培养48h。
1.3.3 qRT-PCR 法检测细胞中miR-137 表达:取处理后48h 的细胞,加入裂解液,其他操作步骤同上述1.3.1 中qRT-PCR 操作。
1.3.4 MTT 法检测细胞增殖活性:取各组处理后细胞,消化,接种在96 孔板,密度2.0×103/孔,每组设复孔6 个,分别在培养12,24,48,72 和96h 时,各孔各加入MTT 液10μl,孵育4h 后弃上清,各加入二甲基亚砜150μl,振荡至结晶物溶解完全,酶标仪检测各孔在490nm 的吸光度A值。
1.3.5 Transwell 法检测细胞迁移力:将各组处理后细胞离心,取沉淀,用不含胎牛血清培养液按2.5×104/ml 重悬,取200μl 加入小室上室,下室则加入含10ml/dl 胎牛血清的培养液600μl。培养24h。擦拭小室膜上层散落细胞,膜下细胞则用4g/dl多聚甲醛固定,加入1g/dl 结晶紫染色,用倒置显微镜观察,随机选视野5 个计数穿膜细胞数。重复实验三次。
1.3.6 Transwell 法检测细胞侵袭力:将培养液稀释过的基质胶平铺在小室上层,37℃下风干使用。其他操作同方法1.3.5 中细胞迁移力测定的方法。
1.4 统计学分析 数据统计分析使用SPSS 13.0 软件,计量资料经检验均符合正态分布,以均数±标准差(±s)表示,采用t检验进行两组间比较,采用单因素方差分析进行多组间比较,组间进一步两两比较采用LDS-t检验,采用受试者工作特征(receiver operating characteristic,ROC)曲线分析PTC 组织中miR-137 对PTC 的诊断价值。P<0.05为差异有统计学意义。
2 结果
2.1 PTC 和癌旁组织中miR-137 水平比较 PTC组织中miR-137 水平为0.26±0.10,显著低于癌旁组织的0.42±0.18,差异有统计学意义(t=8.320,P<0.001)。
2.2 PTC 组织中miR-137 水平与临床指标相关性见表2。miR-137 水平在不同性别、年龄、是否吸烟、是否饮酒、不同病灶数量及肿瘤直径差异均无统计学意义(均P>0.05);与无包膜浸润、TNM分期Ⅰ~Ⅱ和未发生淋巴结转移患者相比,包膜浸润、TNM 分期Ⅲ~Ⅳ和发生淋巴结转移PTC 组织中miR 137 水平降低,差异均有统计学意义(均P<0.05)。
表2 PTC 组织中miR 137 水平与临床指标相关性(±s)
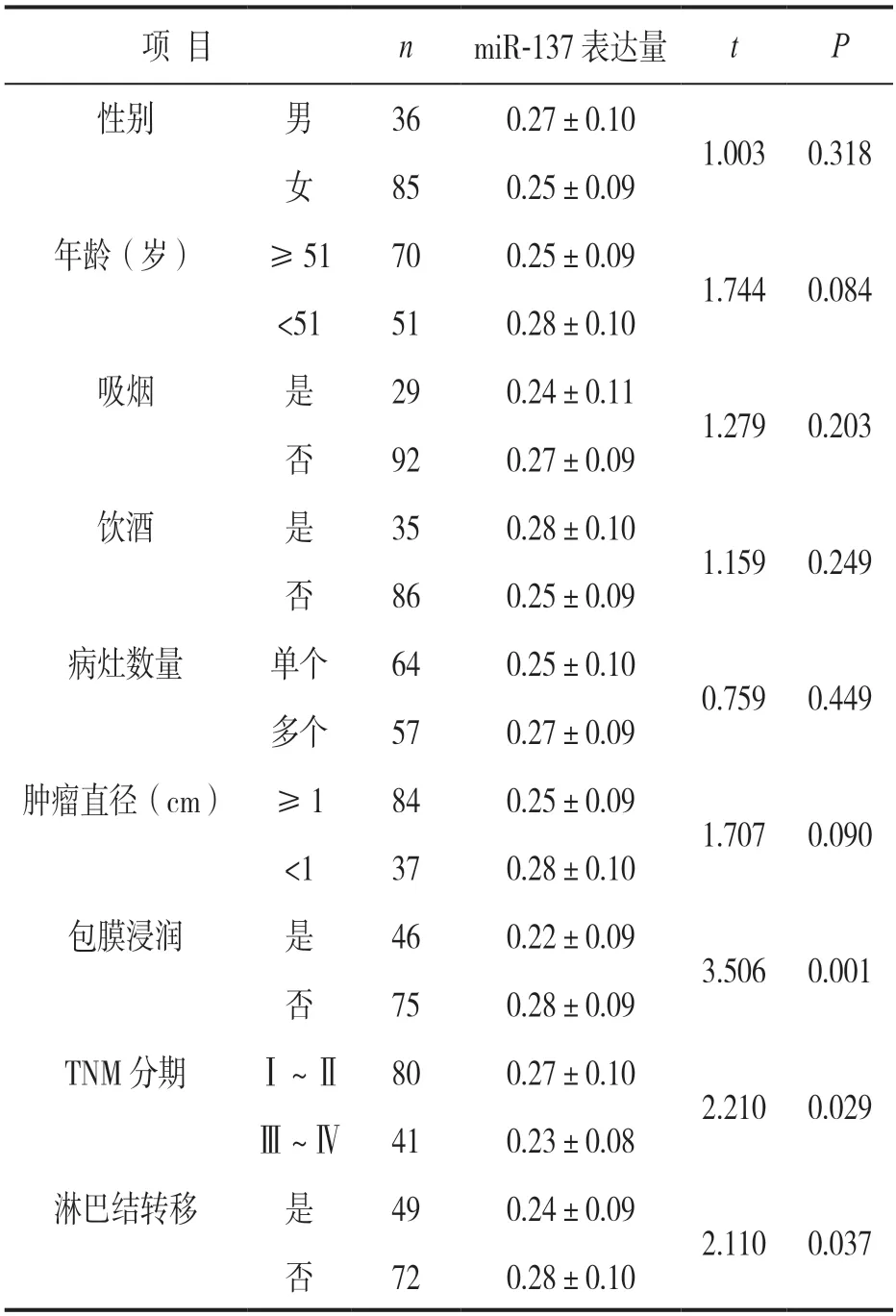
表2 PTC 组织中miR 137 水平与临床指标相关性(±s)
项 目nmiR-137 表达量tP性别男360.27±0.10 1.003 0.318女850.25±0.09年龄(岁)≥51700.25±0.09 1.744 0.084<51510.28±0.10吸烟是290.24±0.11 1.279 0.203否920.27±0.09饮酒是350.28±0.10 1.159 0.249否860.25±0.09病灶数量单个640.25±0.10 0.759 0.449多个570.27±0.09肿瘤直径(cm) ≥1840.25±0.09 1.707 0.090<1370.28±0.10包膜浸润是460.22±0.09 3.506 0.001否750.28±0.09 TNM 分期Ⅰ~Ⅱ800.27±0.10 2.210 0.029Ⅲ~Ⅳ410.23±0.08淋巴结转移是490.24±0.09 2.110 0.037否720.28±0.10
2.3 组织中miR-137 水平对PTC 的诊断价值 见图1。ROC 曲线分析结果显示,miR-137 表达量在诊断PTC 时,曲线下面积是0.776(95% CI:0.717~0.835),当miR-137 表达量取0.35 时,灵敏度和特异度分别为80.99%,65.29%。

图1 PTC 组织中miR-137 水平对PTC 的ROC 曲线
2.4 各组细胞中miR-137 水平比较 M 组、NC 组和B 组细胞中miR-137 水平分别为2.30±0.19,1.01±0.05 和1.03±0.08,差异有统计学意义(F=222.632,P<0.001);NC 组和B 组细胞中miR-137水平差异无统计学意义(t=0.690,P=0.506),M组细胞中miR 137 水平高于NC 组和B 组,差异有统计学意义(t=16.319,15.117,P<0.05)。
2.5 各组细胞增殖活性比较 见表3。M 组24,48,72和96h时增殖活性低于NC组(t=2.570,2.520,2.969,4.095),且低于B 组(t=2.779,3.964,4.681,3.782),差异均有统计学意义(均P<0.05)。NC组和B 组24,48,72 和96h 时增殖活性比较差异无统计学意义(t=0.297,0.893,1.712,0.949,均P>0.05)。

表3 三组细胞不同时点增殖活性(A 值)
2.6 各组细胞迁移和侵袭力比较 见表4,图2 和图3。M 组迁移细胞数和侵袭细胞数均低于NC 组(t=7.316,5.555) 和B 组(t=6.118,8.078),差异均有统计学意义(均P<0.05),NC 组与B 组迁移细胞数和侵袭细胞数比较差异无统计学意义(t=0.0839,1.381,均P>0.05)。
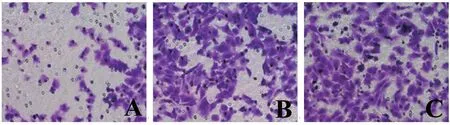
图2 Transwell 法检测三组细胞迁移情况(A:M 组,B:NC 组,C:B 组,结晶紫×200)

图3 Transwell 法检测三组细胞侵袭情况(A:M 组,B:NC 组,C:B 组,结晶紫×200)

表4 三组细胞迁移和侵袭能力比较(x± s,个)
3 讨论
随着人民健康意识的提高,甲状腺癌检出率不断增加,且发病年龄呈低龄化[8],PTC 作为其中占比最高的病理类型,患者病程进展缓慢,手术切除后长期预后良好[9],但术后复发率较高,部分患者面临再次或多次手术风险[10],同时,对于发现较晚出现转移的患者,治疗后效果不佳[11],因此,进一步探讨明确与PTC 转移及复发相关机制,寻找敏感靶点基因,对早期诊疗及预后改善意义重大。
研究发现[12],PTC 组织中存在miRNA 表达谱异常,可能对患者诊断、预后评估有重要意义。研究发现[13],miR-137 与肿瘤细胞增殖关系密切,可通过影响靶基因稳定性而在细胞增殖中发挥重要作用。有研究指出[14],miR-137 可通过影响上皮-间质转化而参与了肿瘤细胞侵袭。亦有研究指出[15],miR-137 可抑制宫颈癌进展。张长壮等[16]指出,miR-137 与乳腺癌患者临床病理特征及术后应用ACT 方案化疗后疗效有关。本研究结果显示,PTC组织中miR-137 表达量显著低于癌旁组织,说明miR-137 在PTC 组织中低表达,可能参与了PTC发生。本研究结果显示,miR-137 在包膜浸润、TNM 分期Ⅲ~Ⅳ和发生淋巴结转移PTC 组织中表达量显著降低,进一步说明miR-137 与PTC 患者临床病理特征有关,并对诊断PTC 具有一定意义,低表达可能参与了PTC 恶性进程,在PTC 进展中发挥抑癌基因的作用。
本研究为进一步探讨miR-137 在PTC 发病中的作用,采用转染模拟序列的方式升高人PTC 细胞株TPC-1 中miR-137 表达,结果显示,M 组细胞中miR-137 表达量高于NC 组和B 组,说明转染miR-137 模拟序列的细胞中miR-137 表达量升高,提示建模成功。研究发现[17],miR-137 表达增加可显著抑制细胞增殖,降低集落形成并诱导G1 期停滞。本研究结果显示,M 组24,48,72 和96h 时增殖活性均低于NC 组和B 组,说明TPC-1 中miR-137 表达升高可有效降低细胞增殖活性,提示miR-137 可能在TPC-1 细胞增殖中发挥抑制作用。有研究指出[18],miR-137 在体外和体内通过靶向肝癌细胞中的EZH2-STAT3 信号通路抑制迁移和侵袭。DING 等[19]指出,miR-137 可通过调节上皮间质转化抑制大肠癌细胞迁移。本研究实验结果发现,M组迁移细胞数和侵袭细胞数均低于NC 组和B 组,说明增加miR-137 表达可抑制TPC-1 细胞迁移和侵袭,可能在细胞迁移及侵袭中发挥重要作用。
综上所述,miR-137 在PTC 组织中表达量降低,升高miR-137表达可明显减少TPC-1细胞增殖活性,抑制细胞迁移和侵袭,但其具体可能涉及到的通路尚待开展进一步的研究明确。
- 现代检验医学杂志的其它文章
- 急性肺栓塞患者血清ADAM15和MMP-2表达水平及其与疾病严重程度的相关性研究
- 肺炎支原体感染诱发哮喘患儿血清中miR-424-5p和CX3CL1表达水平及与预后预测价值研究
- ALKBH5调控GEFT的m6A修饰对胆管癌转移及EMT的实验研究
- LncRNA NNT-AS1通过调控miR-582-5p/NCKAP1轴激活Hippo-YAP/TAZ信号通路促进膀胱癌细胞增殖、迁移、侵袭和干细胞干性影响
- 血浆外泌体miR-4306表达水平联合CT征象对单发非实性肺结节良恶性鉴别的价值研究
- 白细胞介素-1β基因(rs16944)单核苷酸多态性与骨髓增生异常综合征易感性及临床特征的相关性研究

