糖代谢异常与甲状腺疾病伴发时外周血Treg和Th17细胞的变化
沈 艳,李文花,龙密密,谭玉洁
(1.六盘水市人民医院检验科,贵州 六盘水 553000;2.贵州医科大学附属医院临床检验中心,贵州 贵阳 550004)
甲状腺疾病是甲状腺功能、大小或组织结构发生改变的一组疾病的总称,是临床上常见的内分泌疾病。糖代谢异常是机体葡萄糖代谢发生异常的一类疾病,包括糖尿病前期和糖尿病。糖尿病和甲状腺疾病的发病与遗传、环境及自身免疫等多种因素有关,但具体病因目前尚未明确。临床研究表明,糖尿病与甲状腺疾病之间存在一定的联系,糖尿病患者中甲状腺功能异常的发生率明显升高,是非糖尿病患者的2 ~3 倍,介于12.5% ~51.6% 之间,其原因未明。研究证实,Th1/Th2 失衡与甲状腺疾病的发生发展有关。Th17 细胞主要分泌白细胞介素-17(IL-17),在各种传染性疾病、癌症和自身免疫性疾病的发生发展中起着重要的作用。Treg 细胞是一种具有免疫调节功能的免疫抑制性T 细胞。糖尿病合并甲状腺功能异常者在临床上较为常见,本研究采用流式细胞术检测糖代谢异常与甲状腺疾病患者外周血Treg 和Th17 细胞的变化,探讨糖代谢异常与甲状腺疾病之间的免疫学联系。
1 资料与方法
1.1 基线资料
选取贵州医科大学附属医院门诊及住院的糖代谢异常患者78 例、甲状腺疾病患者60 例进行研究。糖代谢异常分类符合1999 年世界卫生组织(WHO)糖尿病专家委员会提出的糖尿病的诊断标准,甲状腺功能异常依据《中国甲状腺疾病诊治指南》进行诊断。将78 例糖代谢异常患者纳入GM 组,将60 例甲状腺疾病患者纳入TD 组。GM 组中,男45 例,女33 例,平均年龄(47.53±15.68)岁。TD 组中,男20 例,女40 例,平均年龄(45.00±12.57)岁。另选择我院同期健康体检者20 例为对照组(NC 组),其中男8 例,女12 例,平均年龄(46.15±13.44)岁。三组的年龄、性别相比,差异无统计学意义(P>0.05),具有可比性。糖代谢异常患者根据甲状腺功能检查结果分为糖代谢异常伴甲状腺功能正常者58 例(纳入GM-TN 组)和糖代谢异常伴甲状腺功能异常者20 例(纳入GM-TD组)。甲状腺疾病患者根据糖代谢检查结果分为甲状腺疾病伴糖代谢正常者47 例(纳入TD-NGM 组)和甲状腺疾病伴糖代谢异常者13 例(纳入TD-AGM 组)。
1.2 主要试剂与仪器
CD4-FITC、CD25-PE-Cy ™7、IL-17A-PE、A-Fluor 647-CD127(均为鼠抗人),同型对照FITC Mouse IgG1,κ Isotype Control RUO、Alexa Fluor®647 Mouse IgG1 κ Isotype Control RUO、PE Mouse IgG1,κ Isotype Control RUO、PE-Cy ™7 Mouse IgG1 κ Isotype Control RUO、溶血素和刺激剂+ 蛋白转运抑制剂,均为美国BD 公司生产。FACS Canto Ⅱ流式细胞仪(美国BD 公司)。
1.3 方法
1.3.1 标本采集 所有研究对象均隔夜禁食8 ~12 h,以EDTA-K2 真空抗凝采血管采集清晨空腹静脉血2 mL,混匀,室温保存,用于检测Treg 细胞和Th17 细胞的表达。
1.3.2 Treg 细 胞 检 测 取CD4-FITC、A-Fluor 647-CD127 各5 µL 及CD25-PE-Cy™7 1.25 µL,加入50µL EDTA-K2 抗凝血,振荡混匀后,室温避光孵育30 min。加入溶血素1 mL,振荡混匀后,室温溶血5 min,然后再置于37 ℃恒温水浴箱中溶血5 min。待血融透后,加入3 mL PBS,振荡混匀后用低速离心机离心(1500 r/min 下离心5 min),洗涤两次,加入0.3 mL PBS 重悬细胞,混匀,上机检测。收集20 000 个淋巴细胞,采用Flowj0 7.6 软件分析CD4+CD25+CD127low细胞占CD4+T 细胞的百分比(Treg/CD4+T%)。
1.3.3 Th17 细胞检测 用人淋巴细胞分离液分离外周血单个核细胞(PBMC),加入PBS 至1 mL,重悬细胞,混匀备用。取出24 孔细胞培养板,每孔加入1 mL含10% FBS 的1640 培养基。加入上述制备好的细胞悬液,调整细胞浓度为1×106/mL,用枪吹打混匀,再加入2 µL 刺激剂+蛋白转运抑制剂,吹打混匀,置于37 ℃、5% 的CO2培养箱中培养刺激6 ~8 h ;用PBS 在1500 r/min 下离心5 min,洗涤两次,加入10 µL 的CD4-FITC,4 ℃避光孵育30 min。用PBS在1500 r/min 下离心5 min,洗涤2 次,加入固定/破膜剂1 mL,颠倒混匀,4 ℃避光孵育1 h,用固定/破膜洗液在1500 r/min 下离心5 min,洗涤2 次,加入10µL 的IL-17A-PE,4 ℃避光孵育50 min。加入固定/ 破膜洗液1 mL,在1500 r/min 下离心5 min,洗涤2 次,加入300 µL 的PBS 重悬细胞,上机检测。每管收集20 000 个淋巴细胞,采用Flowj0 7.6 软件分析CD4+IL-17A+ 细胞占CD4+T 细胞百分比(Th17/CD4+T%)。
1.4 观察指标
观察并比较各组的外周血Treg、Th17 细胞及Treg/Th17。
1.5 统计学分析
2 结果
2.1 GM 组、TD 组、NC 组外周血Treg、Th17细胞及Treg/Th17 的比较
与NC 组比较,GM 组和TD 组的外周血Treg/Th17均降低,Treg 和Th17 细胞均升高(P<0.05)。详见表1。
表1 GM 组、TD 组、NC 组外周血Treg、Th17 细胞及Treg/Th17的比较(± s)
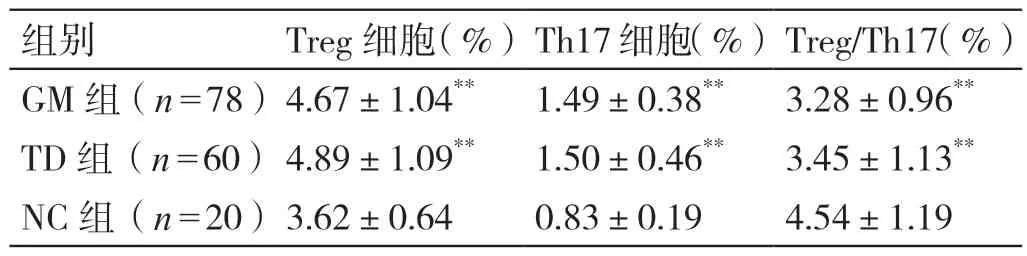
表1 GM 组、TD 组、NC 组外周血Treg、Th17 细胞及Treg/Th17的比较(± s)
注:**与NC 组比较,P <0.01。
组别 Treg 细胞(%)Th17 细胞(%)Treg/Th17(%)GM 组(n=78)4.67±1.04** 1.49±0.38** 3.28±0.96**TD 组(n=60)4.89±1.09** 1.50±0.46** 3.45±1.13**NC 组(n=20)3.62±0.64 0.83±0.19 4.54±1.19
2.2 GM-TN 组、GM-TD 组外周血Treg、Th17细胞及Treg/Th17 的比较
与GM-TN 组比较,GM-TD 组的外周血Treg 细胞和Treg/Th17 均降低(P<0.05);两组的外周血Th17细胞相比无统计学差异(P>0.05)。详见表2。
表2 GM-TN 组、GM-TD 组外周血Treg、Th17 细胞及Treg/Th17 的比较(± s)
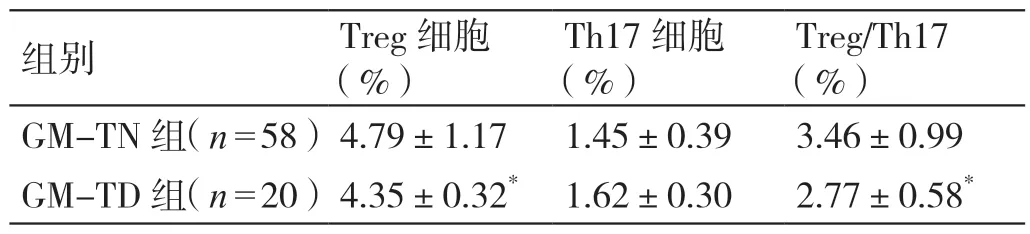
表2 GM-TN 组、GM-TD 组外周血Treg、Th17 细胞及Treg/Th17 的比较(± s)
注:*与GM-TN 组比较,P <0.05。
组别 Treg 细胞(%)Th17 细胞(%)Treg/Th17(%)GM-TN 组(n=58)4.79±1.17 1.45±0.39 3.46±0.99 GM-TD 组(n=20)4.35±0.32* 1.62±0.30 2.77±0.58*
2.3 TD-NGM 组、TD-AGM 组外周血Treg、Th17 细胞及Treg/Th17 的比较
TD-NGM 组和TD-AGM 组的外周血Treg、Th17细胞及Treg/Th17 比较均无统计学差异(P>0.05)。详见表3。
表3 TD-NGM 组、TD-AGM 组外周血Treg、Th17 细胞及Treg/Th17 的比较(± s)
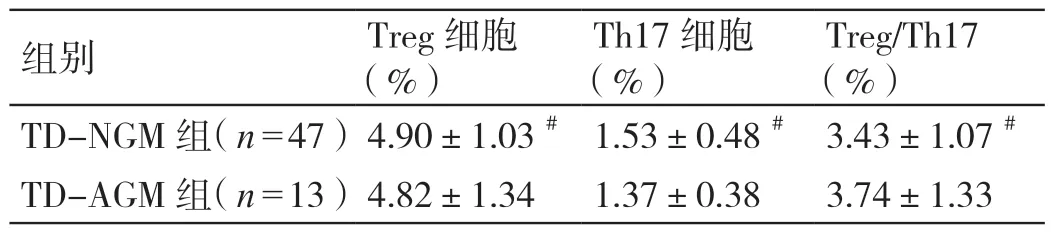
表3 TD-NGM 组、TD-AGM 组外周血Treg、Th17 细胞及Treg/Th17 的比较(± s)
注:#与TD-AGM 组比较,P >0.05。
组别 Treg 细胞(%)Th17 细胞(%)Treg/Th17(%)TD-NGM 组(n=47)4.90±1.03# 1.53±0.48# 3.43±1.07#TD-AGM 组(n=13)4.82±1.34 1.37±0.38 3.74±1.33
2.4 GM-TD 组、TD-AGM 组外周血Treg、Th17细胞及Treg/Th17 的比较
与TD-AGM 组比较,GM-TD 组外周血的Th17细胞升高,Treg/Th17 降低(P<0.05);两组的外周血Treg 细胞相比无统计学差异(P>0.05)。详见表4。
表4 GM-TD 组、TD-AGM 组外周血Treg、Th17 细胞及Treg/Th17 的比较(± s)
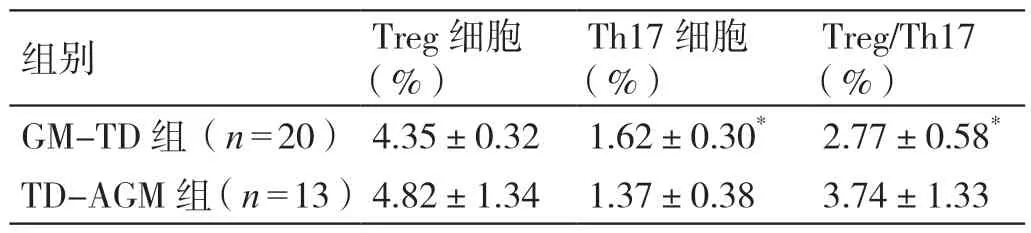
表4 GM-TD 组、TD-AGM 组外周血Treg、Th17 细胞及Treg/Th17 的比较(± s)
注:*与TD-AGM 组比较,P <0.05。
Treg/Th17(%)GM-TD 组(n=20)4.35±0.32 1.62±0.30* 2.77±0.58*TD-AGM 组(n=13)4.82±1.34 1.37±0.38 3.74±1.33组别 Treg 细胞(%)Th17 细胞(%)
3 讨论
Treg 细胞由Sakaguchi 等在1995 年首次报道,随后的研究发现Treg 细胞能分泌多种具有免疫调节功能的细胞因子,抑制效应T 细胞的免疫应答,与多种免疫性疾病的发病机制或免疫状态密切相关,在维持免疫稳态和调控免疫应答方面具有重要作用[1-2]。Th17 细胞由Harrington 和Park 等发现,它是一种不同于Th1、Th2 的新型CD4+T 细胞,主要分泌IL-17,受转录因子RORrt 的分化调控,在各种传染性疾病、癌症和自身免疫性疾病的发生发展中起着重要的作用[3]。近年来的研究表明,糖尿病是以高血糖为主要特征的低度炎症性疾病,而炎症的发生与免疫状态密切相关,已陆续有研究报道糖尿病的发生与免疫功能紊乱有关。另一方面,有研究发现甲状腺疾病患者可出现Treg 细胞数量减少、功能降低及Th17 细胞增加的情况,提示甲状腺疾病的发生同样与机体免疫紊乱有关[4]。本研究观察了GM 组、TD 组与NC 组外周血Treg 细胞和Th17 细胞的变化,结果显示GM 组与TD组的外周血Treg 细胞和Th17 细胞均升高,二者的比值Treg/Th17 均降低。国内外的研究显示,Th17 细胞在糖尿病中表达上升,增加的Th17 细胞可分泌效应因子,调节多种致炎因子的水平,从而引起糖尿病患者的胰岛β 细胞损害和死亡;在甲状腺疾病中,Th17细胞表达也处于活跃状态,被激活的Th17 细胞分泌效应因子,作用于甲状腺组织细胞,诱发并加重局部炎症反应,导致甲状腺滤泡上皮细胞逐渐被破坏。效应因子还可以活化转化因子NF-κB,诱导T 细胞的增殖与活化,参与炎症反应,导致甲状腺自身抗体的产生。据报道,Treg 细胞对机体的免疫保护机制减弱可增强慢性炎症的刺激及增加炎性因子的分泌,导致胰岛素敏感性进一步减弱,引起糖尿病的发生发展。而Treg 细胞对Fas 介导的凋亡细胞易感性增加,导致Treg 细胞数量减少,从而抑制免疫调节功能活化自身反应性T 细胞,导致甲状腺疾病的发生。但一些研究则表明,甲状腺疾病中Treg 细胞数量无明显改变。有研究发现,Treg 细胞在糖尿病发病初期会增加[5]。
糖尿病和甲状腺疾病都属于内分泌疾病,两者之间存在一定的关联,且糖尿病患者中甲状腺功能异常的发生率明显升高,是非糖尿病患者的2 ~3 倍。有研究发现,甲状腺疾病中甲亢患者的血糖水平及血糖异常的发生率均高于健康体检组[6]。甲状腺疾病发生时,甲状腺激素对胰岛功能有双重影响,既改变机体对胰岛素的敏感性,又改变胰岛素的降解速度。甲状腺激素升高,胰岛β 细胞功能减低,胰岛素抵抗增加,导致糖尿病加重。研究表明,甲状腺激素引起的胰岛β 细胞凋亡是糖代谢异常患者早期胰岛β 细胞死亡的主要病理机制[7]。本研究中我们发现,与糖代谢异常伴甲状腺功能正常组比,糖代谢异常伴甲状腺功能异常组的外周血Treg 细胞和Treg/Th17 均降低,Th17 细胞升高,提示甲状腺功能异常可进一步加重糖代谢异常患者的免疫功能紊乱及体内的炎症反应。甲状腺激素的异常分泌可破坏胰岛β 细胞,促进胰岛炎症反应,使其炎症反应增强,这进一步证实了甲状腺疾病的发生与免疫功能损伤密切相关。本研究对甲状腺疾病伴糖代谢正常与甲状腺疾病伴糖代谢异常患者进行了比较,发现两组的免疫细胞差异无统计学意义。提示甲状腺疾病患者血糖升高并非免疫因素导致,而是甲状腺激素对胰岛功能的双重影响导致。我们对糖代谢异常伴甲状腺功能异常与甲状腺疾病伴糖代谢异常患者进行比较发现,前者的Th17 细胞升高,而Treg/Th17 降低,证实了这两组患者并非罹患相同的疾病,而是两个不同的疾病组,至少也是处于疾病的不同阶段。
综上所述,临床实践中应充分重视糖代谢异常与甲状腺疾病之间密切的免疫学联系,除被免疫细胞作用的主要靶器官不同外,两者均与机体细胞免疫缺陷和体液免疫过度激活有关,均存在外周血Treg/Th17平衡的异常,且糖代谢异常伴甲状腺疾病时机体的免疫调节异常更加严重。因此,针对糖代谢异常患者应重视甲状腺功能检查,并关注其有无免疫功能紊乱及炎症反应,以便更好地开展治疗。

