TNF-α-308基因多态性与皖南地区克罗恩病患者英夫利昔单抗继发性失应答的关联性*
叶明琪,王培培,2,刘俊,2,武元竹,袁梦,李龙,栾家杰,2
(1.皖南医学院药学院,芜湖 241002;2.皖南医学院弋矶山医院临床药学科,芜湖 241001)
克罗恩病(Crohn's disease,CD)是一种病因不明的慢性非特异性肠道炎症疾病,病情复杂易反复,往往需要长期甚至终身治疗。近年,我国CD发病率逐步攀升,严重影响患者生活质量水平[1]。英夫利昔单抗(infliximab,IFX)作为一种针对肿瘤坏死因子(tumor necrosis factor,TNF)-α的单克隆抗体对治疗CD疗效显著,但仍有许多CD患者经初始诱导治疗达临床缓解后随时间推移发生失应答(loss of response,LOR),表现为维持治疗阶段CD相关症状再复发,即继发性失应答(secondary loss of response,SLOR)[2]。据报道,50%~54%CD患者在持续接受IFX治疗1年中发生SLOR[3]。由于IFX治疗高成本和可能严重副作用,了解患者是否存在潜在SLOR风险对IFX维持治疗十分重要。但IFX治疗SLOR的机制是多因素的,除了与药效学和药动学密切相关外,还与药物遗传学、疾病特征及患者个体等因素紧密关联[4]。TNF-α是CD发病机制中一个关键促炎症细胞因子,与TNF-α相关基因多态性被认为是影响抗TNF-α药物治疗反应主要原因之一[5]。国外有关TNF-α-308基因多态性与IFX疗效相关研究具有争议性[6-9],但由于基因多态性存在种族、地区差异性且国内相关研究较少,故需进一步探索以提供更多循证医学证据。本研究旨在探究皖南地区CD患者TNF-α-308基因多态性等临床资料是否为IFX治疗发生SLOR的潜在预测因子。
1 资料与方法
1.1资料
1.1.1临床资料 以2018年1月—2021年4月皖南医学院弋矶山医院消化内科收治的入院时提供的个人信息显示其籍贯属于芜湖、马鞍山、宣城的皖南地区城市的患者作为研究对象。本研究经皖南医学院弋矶山医院伦理委员会批准(批件号:2022-50),取得入组患者或家属同意并签署知情同意书。纳入标准:①符合《炎症性肠病诊断与治疗的共识意见》中CD诊断标准[1];②IFX治疗次数>4次的住院患者。排除标准:①对IFX禁忌/过敏人群;②随访时间<12个月;③合并其他感染性疾病及严重肝肾功能不全者。
1.1.2药品、试剂与设备 药品:IFX(瑞士Cilag AG公司,批准文号:S20171001,规格:每支100 mg)。设备:多通道荧光定量分析仪Fascan 48S(西安天隆科技有限公司,陕械注准20182400043号)。试剂:基因检测通用试剂(济南广音医疗科技有限公司,批号:20201106),主要成分:寡聚核苷酸、牛血清白蛋白等;样本萃取液主要成分:0.74%氯化铵溶液。
1.2方法
1.2.1药物治疗方法 患者均依据药品使用说明书予IFX静脉滴注,5 mg·kg-1,于第0,2,6周时诱导,缓解后每8周给药一次行维持治疗。用药前予“地塞米松磷酸钠注射液5 mg,im”预防急性输液反应。
1.2.2基因型检测方法 采集患者外周静脉血1 mL置于EDTA抗凝管中混匀,采用荧光染色原位杂交技术行TNF-α-308 rs1800629基因型检测。
1.2.3SLOR的定义及分组 符合以下任何一个条件患者被纳入SLOR组[10]:①因疾病活动需增加IFX剂量和(或)缩短给药间隔时间;②联合免疫抑制剂;③因IFX疗效不佳无法维持缓解而换用其他药物治疗;④进行CD相关手术或因不良反应需停止治疗。其余随访期间应用IFX治疗持续有效(包括因怀孕或经济等原因停止治疗)患者纳入持续性应答组。
1.2.4观察指标 收集患者用药前临床资料包括性别、体质量指数(BMI)、发病年龄、病程、TNF-α-308基因型、病变部位、疾病行为、既往肛周病变、肛周手术史、第1次IFX治疗前C反应蛋白(CRP)水平、第4次IFX治疗前CRP水平和CRP降低率(第1次IFX治疗前CRP水平与第4次IFX治疗前CRP水平的差值)。本研究主要观察指标是随访期间患者IFX治疗SLOR发生情况。
1.2.5统计学方法 应用SPSS 25.0版软件处理数据。采用Hardy-Weinberg平衡定律分析基因遗传平衡;偏度与峰度系数法行正态性检验;单因素分析,非正态分布计量资料以M(Q1,Q3)表示,组间比较采用Mann-Whitney检验;计数资料用例(%)表示,组间比较采用χ2检验。将单因素分析中有统计学意义变量纳入二元Logistic回归分析,以P<0.05为差异有统计学意义;配对χ2检验探索计数资料指标、受试者特征工作曲线(receiver operating characteristic curve,ROC)探索相关计量资料指标预测IFX治疗SLOR敏感性、特异性,并联合多指标计算ROC曲线下面积(area under the curve,AUC),约登指数最大取截断值。
2 结果
2.1TNF-α-308基因分型及频率分布 纳入70例CD患者,TNF-α-308基因型和等位基因频率符合Hardy-Weinberg平衡(P>0.05),见表1。
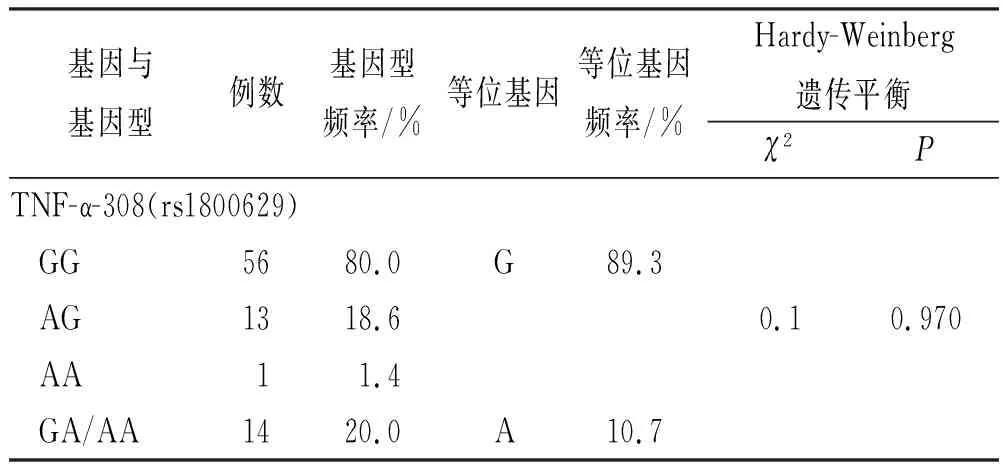
表1 克罗恩病患者TNF-α-308基因型分布情况
2.2持续性应答组与SLOR组患者的临床资料比较 70例患者中,20例(28.6%)患者治疗发生SLOR纳入SLOR组,50例(71.4%)持续应答患者纳入持续性应答组。比较两组患者临床资料,单因素分析结果显示SLOR组中既往肛周病变和肛周手术史患者占比、第4次IFX治疗前CRP水平显著高于持续性应答组,既往肛周病变、肛周手术史和第4次IFX治疗前CRP水平是IFX治疗SLOR的影响因素(P<0.05),见表2。
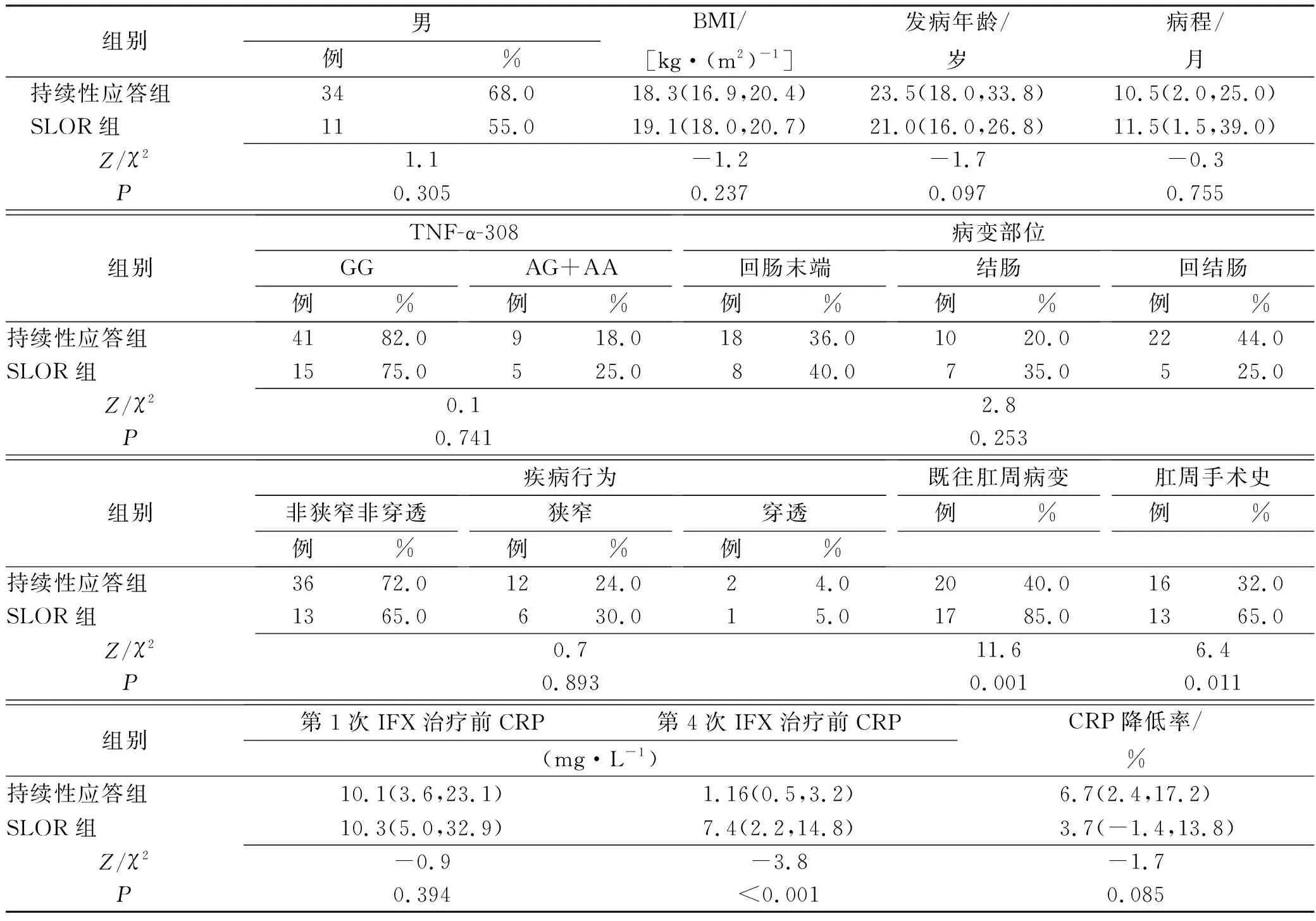
表2 两组患者临床资料比较与单因素分析
2.3影响IFX治疗发生SLOR的Logistic多因素回归分析 将上述单因素分析中有统计学意义的3个指标作为自变量纳入Logistic多因素回归分析,结果显示既往肛周病变和第4次IFX治疗前CRP水平为IFX治疗SLOR的独立危险因素(P<0.05),见表3。
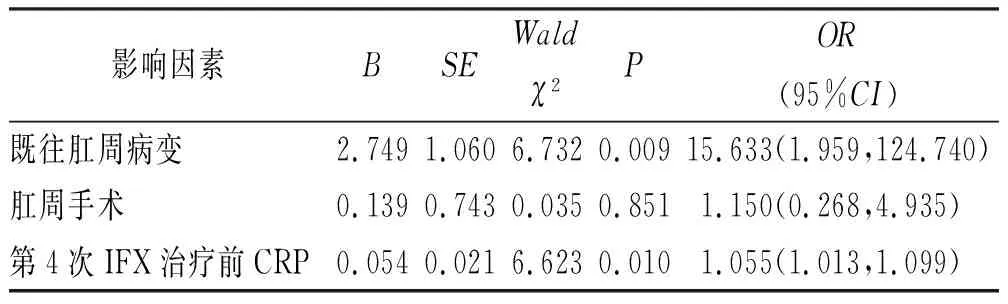
表3 影响IFX治疗发生SLOR的Logistic多因素回归分析
2.4预测IFX治疗SLOR指标的诊断效能 既往肛周病变预测IFX治疗SLOR特异性:90.9%,敏感性:45.9%,AUC:0.725[95%CI=(0.340,0.580)];第4次IFX治疗前CRP水平预测IFX治疗SLOR特异性:78.0%,敏感性:70.0%,AUC:0.749[95%CI=(0.683,0.904],截断值:3.89 mg·L-1,即第4次IFX治疗前CRP≥3.89 mg·L-1可预测SLOR;通过Logistic回归将既往肛周病变、第4次IFX治疗前CRP水平合为联合变量,预测IFX治疗SLOR特异性:72.0%,敏感性:85.0%,AUC:0.859[95%CI=(0.766,0.952)]。结果显示联合变量相比于单个变量在预测SLOR方面具有更好诊断效能,见图1。
3 讨论
SLOR在CD患者IFX治疗过程中十分常见且难以预防,会导致患者疾病复发并增加住院、手术风险和经济负担,是IFX实际应用中的难题。国内研究显示CD患者SLOR发生率与国外(20%~40%)相近[11],本研究结果也佐证此观点。探索CD患者IFX治疗SLOR潜在预测因子及其权重对患者进行SLOR诊断预测是亟待解决的临床问题。临床上提倡根据患者IFX谷浓度和ATI水平制定个体化治疗方案优化药物使用,但因检测结果反馈不及时且多次检测费用高,相比之下获取患者临床资料更便捷。本研究旨在基于患者临床资料探寻影响IFX治疗SLOR的独立危险因素。
TNF-α是一种强有力的促炎细胞因子,在炎症和免疫反应中发挥重要作用。TNF-α基因启动子区域-308 G>A多态被证实与TNF-α产生有关,GA基因被归类为高产生TNF-α细胞因子[12-13]。国外Meta分析发现携带TNF-α-308 G等位基因的高加索人对TNF-α拮抗剂反应优于A等位基因[6],西班牙人群中开展的SNP研究发现抗TNF治疗无反应者-308 A等位基因和GA基因型频率比反应者高[13],且另一项研究显示美国CD患者-308 A等位基因的存在与成为抗TNF治疗无应答者几率高出3倍相关[7]。综上,提示了TNF-α-308基因多态性可能与CD患者抗TNF-α治疗反应相关。而其他在比利时、日本人群中开展的类似研究结果却与之相悖[8-9]。这种相互矛盾的结果可能是由于等位基因频率的种族差异所致。国内相关研究并不多,林荣芳等[14]探究了111例CD患者TNF-α-308基因多态性与IFX血药浓度及疗效的关系,未发现存在关联性。而陈禾凤等[15]分析了初始处于疾病活动期治疗30周时IFX临床治疗有效CD患者的TNF-α-308等位基因分布频率无组间差异,与IFX疗效未显示相关性。本研究结论与之类似。因此,推测TNF-α-308基因多态性不能作为中国CD患者IFX治疗反应的预测因子。
CRP作为一种机体在炎性刺激下产生的急性期蛋白,是临床上常用反应CD患者体内炎症负荷程度和疾病活动度的指标[16]。高炎症负荷会加速TNF-α抑制剂清除导致低血药水平,因此许多学者认为CRP是预测LOR的潜在标志物[17]。但迄今CRP还没有明确临界值可以预测CD治疗反应。不同研究表明较低基线CRP水平可预测IFX治疗LOR,临床缓解期间CRP水平升高患者的住院和肠切除手术风险会增加[18],SONG等[19]发现CRP水平>1 mg·dL-1且相比基线下降>70%与LOR显著相关,首次提示治疗期间CRP变化情况可预测LOR。本研究发现当第4次IFX治疗前CRP≥3.89 mg·L-1可预测SLOR,提示治疗后CRP水平是发生SLOR主要影响因素,与索日娜等[20]研究结论类似。临床需密切关注维持治疗期间患者CRP水平及变化情况。本研究中两组患者基线CRP水平与CRP降低率差异无统计学意义,这可能与样本量较小有关,需进一步扩大样本量验证评估。
肛周病变是许多CD患者首发和主要肠外表现。研究提示既往肛周病变与IFX疗效存在关联,一项纳入3187例CD患者的Meta分析表明既往有肛周病变患者比没有肛周病变患者LOR结局的风险更高[21],与本研究结果一致。应密切监测既往有肛周病变CD患者治疗过程中IFX应答情况。
性别和体质量是影响IFX体内清除率的重要因素,IFX体内清除率与血药浓度水平呈负相关。低IFX血药浓度可导致抗IFX抗体(antibodies to infliximab,ATI)产生,而ATI形成使IFX清除率增加2.5倍[22],并且持续高水平ATI与患者SLOR密切相关[23]。所以患者体内低血药浓度水平致使ATI形成,从而使IFX体内清除率增加,发生LOR概率增加。AUBOURG等[24]发现男性CD患者IFX清除率显著高于女性,本研究中男性SLOR比例55.0%高于女性45.0%,推测男性患者出现LOR的概率可能高于女性。既往报道称BMI>25 kg·(m2)-1的患者常发生IFX治疗LOR[25],较高的BMI被认为是LOR的预测因素。由此推测高BMI患者出现药物浓度不足和持续高水平ATI的可能性大于低BMI患者。但本研究未发现二者相关,可能与入组患者多数BMI<25 kg·(m2)-1,无较高BMI患者有关。建议患者控制BMI在正常范围内有利于提高治疗获益度。
本研究也存在一定局限性,单中心研究存在样本量偏小,后续需要进一步联合多中心、扩大样本量开展前瞻性研究并增加其他可能影响IFX治疗SLOR遗传因子和相关因素,为优化CD患者给药方案提供更多临床证据。
综上,存在既往肛周病变和第4次IFX治疗前CRP≥3.89 mg·L-1是皖南地区CD患者发生SLOR的独立危险因素,临床上应密切监测这类患者治疗期间应答情况和相关检验指标变化;而TNF-α-308基因多态性与IFX维持治疗中SLOR发生无显著相关。近年来,已有多种临床、遗传等因素被证实与CD中IFX反应相关,应着重从中寻找确切LOR预测因子,以期为CD患者制定个体化治疗策略。

