足量泼尼松联合环磷酰胺治疗IgA肾病的疗效及影响因素*
王梦平,孙健超,金畅,董建华,唐诗韵
(1.成都中医药大学附属医院肾病一科,成都 610072;2.成都市第八人民医院心血管内科二病区,成都 610083;3.乐山市人民医院肾病内科,乐山 614099;4.成都中医药大学附属医院GCP中心,成都 610072)
IgA肾病(IgA nephropathy,IgAN)是终末期肾病(end stage renal disease,ESRD)的重要病因之一[1]。2020年KDIGO指南推荐,IgAN患者经过优化支持治疗后平均蛋白尿持续>1 g·d-1,可考虑糖皮质激素治疗,而环磷酰胺只被推荐用于快速进展的IgAN。然而,近年研究发现IgAN患者时间平均蛋白尿水平高于0.5 g·d-1时,肾脏存活率显著降低、疾病进展风险增加[2-3]。但免疫抑制治疗往往伴随着更多的药物不良反应。因此,在IgAN中使用糖皮质激素和环磷酰胺的时机仍存在很大争议,需要更多研究深入探讨。
本研究回顾搜集成都中医药大学附属医院肾穿刺活检证实的并使用足量泼尼松联合环磷酰胺治疗的IgAN患者,对其临床数据进行分析,探讨足量泼尼松联合环磷酰胺治疗IgAN的疗效及其影响因素,为IgAN免疫抑制治疗提供一定的临床思路和证据。
1 资料与方法
1.1临床资料 2018年1月—2020年1月在成都中医药大学附属医院肾内科经肾穿刺活检和临床确诊蛋白尿的IgAN患者。纳入标准:①依据临床表现及病理结果确诊为IgAN;②治疗前尿蛋白定量>500 mg· d-1,eGFR>30 mL· min-1· (1.73 m2)-1,泌尿系彩超提示:双肾无萎缩、肾皮质未变薄;③经钠盐限制(氯化钠摄入量<3 g· d-1)、戒烟、适当锻炼[每周至少150 min(如每周运动5 d、每次 30 min)中等强度(50%~70%最大心率,运动时有点费力,心跳和呼吸加快但不急促)的有氧运动]、强化降压(<130/80 mmHg)、足量血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitors,ACEI)或血管紧张素2受体拮抗剂(angiotensin receptor antagonist,ARB)类药物治疗3个月蛋白尿无缓解。排除标准:①合并心、脑、肺、肝等器官的严重疾病、精神疾病、肿瘤以及各种感染性疾病;②狼疮性肾炎、过敏性紫癜、乙型肝炎病毒相关性肾炎等继发性IgAN;③肾穿刺活检标本光镜下肾小球数<8个;④合并其他肾脏疾病:膜性肾病、微小病变型肾病、糖尿病肾病等;⑤曾经使用或正在使用糖皮质激素或免疫抑制剂,或本研究开始后使用了其他免疫抑制剂,如:硫唑嘌呤、吗替麦考酚酯、环孢素 A等;⑥用药不规范、资料不全或随访时间不足6个月;⑦合并病毒性肝炎(甲型、乙型、丙型、丁型、戊型),梅毒,人类免疫缺陷病毒感染,结核杆菌感染;⑧不能配合治疗和随访;⑨药物及(或)酒精滥用;⑩孕妇或哺乳期妇女。
1.2治疗方法 所有入选患者治疗方案:足量泼尼松+环磷酰胺(cyclophosphamide,CTX)。具体用法如下:泼尼松(浙江仙琚制药股份有限公司,批准文号:国药准字H33021207)用法:1 mg· kg-1· d-1,6:00—8:00早餐后0.5 h顿服,8周后每4周减量5 mg,直至5 mg· d-1维持半年后停药。CTX(江苏恒瑞医药股份有限公司厂家,批准文号:国药准字H32020856)用法:静脉输液,每月1次,每次0.5~1.0 g· (m2)-1体表面积,6个月后若患者达到缓解标准可改为每3个月1次,累计剂量8 g,疗程12个月。
1.3观察指标 所有入组患者随访6个月。搜集患者的年龄、性别、病理资料特点,患者治疗前和治疗后6个月的血肌酐(serum creatinine,Scr)、血尿酸(uric acid,UA)、血清白蛋白(albumin,ALB)、收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)、平均动脉压(mean arterial pressure,MAP)、24 h尿蛋白定量、血钾(K)、空腹血糖(fasting blood glucose,FBG)、总胆固醇(total cholesterd,TC)、三酰甘油(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、白细胞(white blood cells,WBC)、红细胞(red blood cells,RBC)、血红蛋白(hemoglobin,HB)、血小板(platelet,PLT),同时采用CKD-EPI公式估算肾小球滤过率(estimated glomerular filtration rate,eGFR),并记录治疗期间发生的不良反应。
1.4肾脏病理评定标准 由1名肾脏病理医师及2名经过肾脏病理培训的肾内科医师分别进行盲法阅片,依据IgAN Lee氏分级系统对IgAN进行病理分级(表1)[4],并依据IgAN牛津分型方法详细描述肾小球、肾小管、肾间质和新月体病变情况(表2)[5]。

表1 IgAN的病理组织学Lee氏分级
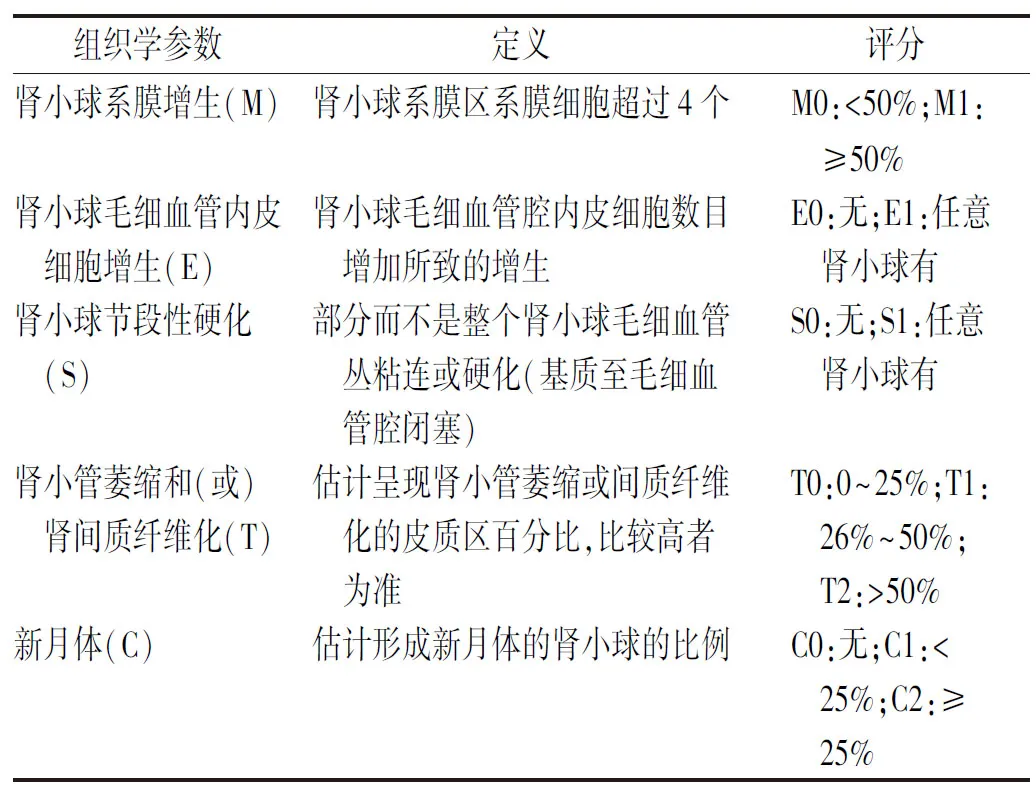
表2 IgAN牛津分型(MEST-C评分)
1.5疗效判定标准 参照中国成人肾病综合征免疫抑制治疗专家共识[6]制定的疗效标准:①完全缓解(complete remission,CR):24 h尿蛋白定量<0.3 g或尿蛋白/肌酐(uPCR)<300 mg· g-1,肾功能正常,人血白蛋白>35 g· L-1,尿蛋白定性阴性;②部分缓解(partial remission,PR):24 h尿蛋白定量>0.3 g,但<3.5 g;或uPCR在300~3 500 mg· g-1;且24 h尿蛋白定量比基线水平下降50%且肾功能稳定(血肌酐较基线水平上升<20%);③未缓解(no remission,NR):未达到完全缓解或部分缓解标准。缓解为完全缓解和部分缓解之和,总有效率(%)=(完全缓解+部分缓解)/总例数×100%。

2 结果
2.1治疗前资料
2.1.1一般资料 共搜集患者33例,其中男13例,女20例,年龄(46.70±11.35)岁,SBP(140.45±22.77)mmHg、DBP(84.42±16.51)mmHg,MAP(103.10±17.62)mmHg,24 h尿蛋白定量1 667.70(6 601.60)mg· d-1,Scr:101.00(87.00)μmol· L-1,eGFR:68.37±19.70[mL· min-1· (1.73 m2)-1],UA(390.45±97.98)μmol· L-1,血钾(4.32±0.60)mmol·L-1,FBG(5.07±0.81)mmol·L-1,TC(5.21±1.38)mmol·L-1,TG(2.36±1.40)mmol·L-1,HDL-C(1.50±0.32)mmol·L-1,LDL-C(2.50±0.90)mmol·L-1,WBC(7.36±2.14)×109· L-1,RBC(4.27±0.50)×1012· L-1,HB(127.27±18.40)g· L-1,PLT(221.76±57.90)×109· L-1,游离甲状腺素(fT4)(15.45±3.46)pmol· L-1,游离三碘甲状腺原氨酸(fT3)(4.49±1.21)pmol· L-1,促甲状腺激素(thyroid stimulating hormone,TSH)(3.67±2.33) uIU·mL-1。
2.1.2病理资料 33例患者中,病理表现为局灶增生型21例(63.64%),增生硬化型10例(30.30%),系膜增生伴新月体形成型及系膜增生型各1例(3.03%);其中Lee氏分级3级的患者22例(66.67%),Lee氏分级4级的患者11例(33.33%);M1患者33例(100.00%);E0患者19例(57.58%),E1患者14例(42.42%);S0患者20例(60.61%),S1患者13例(39.39%);T0患者19例(57.58%),T1患者11例(33.33%),T2患者3例(9.10%);C0患者14例(42.42%),C1患者15例(45.45%),C2患者4例(12.12%)。
2.2联合治疗的疗效 完全缓解10例(30.30%),部分缓解11例(33.33%),未缓解12例(32.36%),总缓解21例(63.64%)。血肌酐升高超过基础值30%的患者7例(21.21%),血肌酐倍增3例(9.09%),eGFR下降超过基础值30%的患者6例(18.18%),进入终末期肾病患者1例(3.03%),死亡0例。
2.3缓解组和未缓解组治疗前资料比较 根据病情缓解情况将患者分为缓解组(21例,63.64%)和未缓解组(12例,32.36%),比较两组患者性别、年龄、病理资料,以及治疗前收缩压、舒张压、平均动脉压、24 h尿蛋白定量、血肌酐、eGFR、病理特点、血尿酸、血钾、空腹血糖、血脂、白细胞、血红蛋白、血小板等情况。结果显示,缓解组与未缓解组比较,两组的年龄、治疗前24 h尿蛋白定量、Lee氏分级、E、T、C差异有统计学意义(P<0.05),见表3。
表3 缓解组和未缓解组各指标比较结果
依据牛津分型将所有患者分为T0组、T1组、T2组,比较各组缓解率,结果提示,T0组、T1组、T2组的缓解率不全相同(P<0.05);组间比较结果显示,T1组缓解率低于T0组(P<0.05),T2组缓解率低于T0组和T1组(P<0.05),见表4。

表4 不同T评分患者的缓解率比较结果
对不同C评分患者的缓解率进行比较,结果提示,C0、C1、C2的缓解率不全相同(P<0.05);组间比较结果显示,C1组缓解率与C0组比较差异无统计学意义,C2组缓解率低于C0组和C1组(P<0.05),见表5。
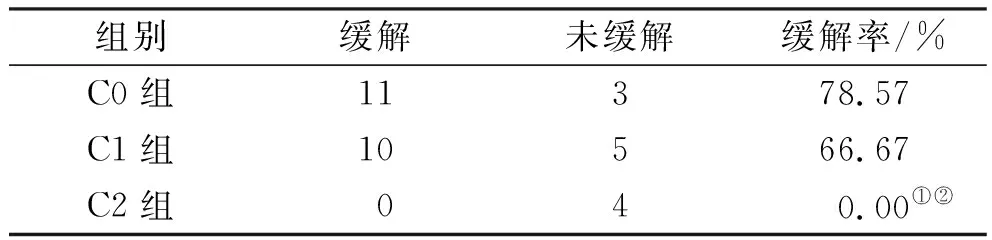
表5 不同C评分缓解率比较结果
2.4不良反应 随访6个月,治疗过程中血糖升高、肝功能不全各1例(3.03%),尿路感染、恶心呕吐各2例(6.06%);未见其他不良反应。
3 讨论
IgAN是导致ESRD的重要病因之一。指南建议,对于蛋白尿超过1 g· d-1且eGFR高于50 mL· min-1· (1.73 m2)-1的患者,在支持治疗的基础上应使用全身糖皮质激素[7]。因此许多传统的免疫抑制剂已在IgAN中试用,包括皮质类固醇、环磷酰胺、硫唑嘌呤和霉酚酸酯等。但IgAN的免疫抑制治疗仍存在极大争议[8-9]。TESTING试验结果提示,相对较高的皮质类固醇剂量有潜在的肾脏获益,然而这可能导致不良事件发生率显著增加[10]。STOP-IgAN试验结果表明,与单纯支持治疗相比,激素联合环磷酰胺治疗有更高的临床缓解率,但明显增加了糖代谢紊乱、体质量增加和感染的风险[11]。RAUEN等[12]的研究亦证明免疫抑制治疗相对于单纯支持治疗无明显优势。本研究结果显示,肾穿刺活检确诊且尿蛋白持续>500 mg· d-1的IgAN患者中,足量泼尼松联合环磷酰胺治疗具有较好疗效,但对肾功能的保护有限,且治疗过程中出现血糖升高、肝功能不全、尿路感染、恶心呕吐。由此推断,足量激素联合环磷酰胺冲击治疗IgAN有较好疗效,但应根据个体情况谨慎评估使用的获益和风险,并严密观察不良反应。
本研究结果显示,未缓解组平均年龄明显高于缓解组,由此推测年龄越大可能是激素联合环磷酰胺冲击治疗效果欠佳和肾脏不良预后的危险因素,但这种结果亦有可能是年龄大的患者对激素和环磷酰胺的耐受力更差、副作用更多有关。近期有研究发现,年龄是IgAN进展至ESRD的预测因素[13-14]。BARBOUR等[15]最近研发出一种IgAN的风险预测模型,该预测模型纳入了年龄作为IgAN的风险预测因子,这种经过验证的模型在临床试验募集和个体患者指导上具有很广的适用性。然而,WEN等[16]将981例原发性IgAN患者根据年龄分为青年组(14~29岁)、中年组(30~49岁)、老年组(≥50岁),发现3组的累积肾脏存活率差异无统计学意义,年龄不是不良预后的独立预测因子。这与本研究结果不一致,分析其原因可能为该研究中老年组的定义比较年轻有关。综上所述,免疫抑制治疗IgAN时仍需考虑年龄对疗效的影响。
越来越多的研究发现,蛋白尿与IgAN预后密切相关[14,17]。CHEN等[18]对506例24 h尿蛋白定量<1 g· d-1、eGFR≥60 mL· min-1· (1.73 m2)-1、未使用免疫抑制治疗的原发性IgAN患者进行数据分析后发现,蛋白尿>0.5 g· d-1是肾脏不良结局的独立危险因素。BARBOUR等[19]对OXFORD DERIVATION(n=265)、NORTH AMERICAN VALIDATION(n=187)和VALIGA(n=1 147)研究行事后分析发现,蛋白尿≥1 g· d-1、M1和T1/T2的患者进展至ESRD或血肌酐下降50%的风险最大,反之则患者进展至ESRD或肾功能下降50%风险最小。本研究结果显示,缓解组的24 h尿蛋白定量明显低于未缓解组,这与既往研究结果一致,提示尿蛋白定量是肾脏不良预后的预测因素。但既往评估尿蛋白与肾脏预后关系的研究对象多为未使用糖皮质激素及免疫抑制剂患者,本研究结果进一步证实,即使是在使用糖皮质激素联合免疫抑制剂的情况下,尿蛋白仍然是肾脏不良预后的预测因子。
Lee氏分级简单实用,是目前广泛应用的IgAN分级系统,大量研究证实Lee氏分级可预测肾脏存活率,Lee分级越高,肾脏存活率越低。任慧敏等[20]随访185例原发性IgAN患者12个月后发现Lee氏Ⅳ、Ⅴ级的肾脏累积生存率较Ⅰ、Ⅱ、Ⅲ级低。赵春梅等[21]随访68例IgAN患者72个月发现Lee氏分级Ⅳ或Ⅴ级是肾功能恶化进展的独立危险因素。本研究结果显示,Lee氏Ⅲ级患者的缓解率明显高于Ⅳ级的患者,这与既往研究结果一致,由此推测在足量泼尼松联合环磷酰胺治疗的患者中Lee氏分级仍可很好的预测疗效,临床应用免疫抑制治疗IgAN前应考虑Lee氏分级程度。
最初牛津队列研究提示,在未使用糖皮质激素或免疫抑制剂治疗的IgAN患者中,肾小球内皮细胞增生是IgAN预后不良的预测因子;但在后来使用糖皮质激素或免疫抑制剂的大多数研究中结果显示内皮细胞增生不能预测不良预后[22]。本研究结果提示E1患者缓解率明显高于E0患者,提示内皮细胞增生对足量泼尼松联合环磷酰胺治疗具有良好应答,这与既往研究结果一致。然而,有利于内皮增生病变进行免疫抑制治疗的证据是间接的,应仅作为产生该推理的证据。理想情况下,应将肾小球内皮细胞增生的患者随机分配至免疫抑制治疗组与支持治疗组,对比两种治疗方法的疗效;但这具有极高的挑战性,因为尽管现有证据有限,但现在强调需要通过免疫抑制治疗E病变的观点越来越多。
HAAS等[23]研究发现肾小管萎缩或肾间质纤维化可独立预测eGFR下降和低肾存活率,在eGFR<30 mL· min-1· (1.73 m2)-1的患者中,T1-T2与低肾脏存活率相关。COPPO等[24]研究结果显示,T1/T2评分是肾脏联合终点(ESRD或eGFR下降50%)的独立预测因子,而这种预测价值在接受免疫抑制剂的患者中仍存在。本研究结果显示,在足量泼尼松联合环磷酰胺治疗的患者中,T1组缓解率显著低于T0组(P<0.05),T2组缓解率显著低于T1组和T0组(P<0.05),提示肾小管萎缩或肾间质纤维化对免疫抑制治疗的应答差,当患者T指数较高时应慎重选择免疫抑制剂治疗。
牛津分类的最新修订版建议在 MEST-C评分中加入C(新月体)参数[25]。一项纳入3 096例受试者的研究提示,新月体可以预测IgAN进展风险,C1在未进行免疫抑制治疗时不良预后的风险显著增加,但对免疫抑制治疗有良好应答,C2患者无论是否使用免疫抑制治疗都会导致不良预后风险增加[23]。本研究结果显示C0组与C1组缓解率差异无统计学意义,C2组缓解率明显低于C0和C1组,提示足量泼尼松联合环磷酰胺治疗对C1具有良好效果;但对C2患者疗效不佳;这与HAAS等[23]的研究结果不谋而合。由此推测,IgAN中,表现为C1的患者或许应积极使用足量激素联合环磷酰胺治疗,而表现为C2的患者往往肾功能损害较重、预后不佳,选择免疫抑制治疗前应仔细权衡利弊。
综上所述,足量泼尼松联合环磷酰胺治疗IgAN疗效显著;年龄越大、24 h尿蛋白定量水平越高、毛细血管内细胞增生越明显、肾小管萎缩或肾间质纤维化程度越严重、新月体越多,缓解率越低;E1、C1对糖皮质激素联合环磷酰胺静脉冲击治疗具有良好应答。本研究的不足之处:①样本量较小,导致未能进行回归分析、病理表现不齐全、不良反应较少;②随访时间较短,不能预测远期肾脏预后;③未行肾脏ECT检查,仅根据CKD-EPI公式估算eGFR可能导致肾小球滤过率欠精准;④虽然所有纳入本研究的患者均反复进行了饮食宣教,告知患者严格低盐低脂优质低蛋白饮食,但未检测尿钠以评估患者真实低盐饮食情况。

