中高海拔地区癫痫患者肠道菌群多态性:病例对照研究
郑美玲,樊青俐,钟莲梅
1青海大学研究生院,西宁 810016 2青海省人民医院神经内科,西宁 810000 3昆明医科大学第一附属医院神经内科,昆明 650000
癫痫是一种常见的慢性中枢神经系统疾病,包括特发性、症状性及隐源性癫痫,病因复杂,可能与大脑神经元兴奋与抑制失衡相关,但详细的发病机制尚不明确。近年来研究发现,肠道菌群可通过迷走神经、内分泌、免疫、神经递质等机制影响中枢神经系统功能,从而实现肠道微生物与大脑之间的双向联系(脑-肠轴),已证实肠道菌群与癫痫、多发性硬化、阿尔茨海默症等诸多神经系统疾病具有关联性[1]。青海处于青藏高原东部,平均海拔约3000 m,低氧、低压、高寒的气候特点导致多种慢性疾病发病率升高[2-4],并使长期生活在该地区的居民呈现出特异性疾病谱。此外,在低压、低氧环境下,肠道菌群的组成及功能可能随之改变,此改变是否对癫痫的发生发展产生影响目前尚不明确。本研究分别收集了来自中高海拔地区癫痫患者与健康人群的粪便组织,对其标本中的16S rRNA进行高通量测序并结合生物信息学分析结果,比较癫痫患者与健康人群的肠道菌群分布和组成差异,旨在明确中高海拔地区癫痫患者肠道菌群的结构特征,为开展癫痫病因学研究提供思路。
1 资料与方法
1.1 研究对象
2021年9月至2022年8月,连续招募世居于中高海拔地区(海拔2200~4500 m)癫痫患者(middle-high altitude epilepsy,MHE)和中高海拔地区健康人群(middle-high altitude normal,MHN)。其中MHE来自于青海省人民医院神经内科癫痫患者,MHN来自于青海省人民医院体检中心体检的健康人群,并按照年龄、性别与MHE相匹配。
MHE纳入标准:(1)结合典型的癫痫发作病史及脑电图检查结果等资料确诊为癫痫,癫痫诊断标准符合《国际癫痫学会官方报告:癫痫的实用临床定义》[5];(2)长期(>3年)居住于青海地区;(3)采样前2周内无抗生素、益生菌、激素等药物使用史。排除标准:(1)合并严重的消化系统疾病、消化系统致病性微生物或寄生虫感染;(2)合并恶性肿瘤、内分泌系统疾病、免疫系统疾病等可能影响肠道菌群稳定性的其他疾病;(3)合并严重心、肝、肾等功能障碍;(4)采样前1周饮食习惯显著变化者;(5)孕期或哺乳期女性。
MHN纳入标准:(1)自觉无明显身体不适且体检证实无明确的临床疾病;(2)长期(>3年)居住于青海地区且年龄、性别与MHE进行1∶1匹配;(3)采样前2周内无抗生素、益生菌、激素等药物使用史。排除标准:(1)采样前1周饮食习惯显著变化者;(2)孕期或哺乳期女性。
本研究已于中华人民共和国科学技术部人类遗传资源采集审批备案(备案号:2022CJ1405),并通过青海省人民医院伦理审查委员会审批(审批号:2022-36),所有参与者均签署知情同意书。
1.2 标本采集与基因测序
1.2.1 标本采集与DNA提取
收集研究对象年龄、性别、肝肾功能、血脂等一般临床资料及晨起新鲜粪便标本约5 g,立即保存于-80 ℃冰箱。采用 QIAamp Fast DNA Stool Mini试剂盒提取标本中肠道微生物总DNA,并采用琼脂糖凝胶电泳、Nandrop和Qubit分别检测总DNA完整度、纯度和浓度,质量合格后进行后续分析。
1.2.2 16S rRNA基因扩增与测序
取质控合格的总DNA,采用全式金DNA扩增试剂盒(TransGen AP221-02:TransStart Fastpfu DNA Polymerase)对肠道菌群的16S rDNA V3~V4区进行扩增,引物为338F(5′-ACTCCTACGGGAGGCAGC AG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)。扩增体系:5× FastPfu Buffer 4 μL,2.5 mmol/L dNTPs 2 μL,正反向引物 (5 μmol/L)各0.8 μL,FastPfu Polymerase 0.4 μL,牛血清蛋白0.2 μL,模板DNA 1 ng,灭菌水补齐至20 μL。扩增条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,35次循环;72 ℃孵育5 min。收集扩增产物,采用Illumina NovaSeq 6000平台按标准操作规程纯化后构建PE250文库并进行高通量测序。
1.3 生物信息学分析
采用Fastp 0.21.0软件对原始序列进行质控后,采用FLASH 1.2.11软件对序列进行拼接。质控合格的序列进行分类操作单元(operational taxonomic units,OTU)聚类分析,相似度≥97%的序列被认为是同一种OTU,并进行生物信息学分析。(1)α多样性(R软件Mothur 1.47.0程序):包括稀疏曲线(Shannon指数)、Shannon指数、Sobs指数、Chao指数、ACE指数、Goods Coverage指数,其中稀疏曲线(Shannon指数)评估测序深度,Shannon指数评估菌群多样性,Sobs指数为实际观测到的OTU数目,Chao、ACE指数可评估菌群丰富度,Goods Coverage指数可评估测序深度覆盖样品中所有物种的概率。(2)β多样性:采用加权Bray-Curtis距离矩阵的主坐标分析(principal coordinate analysis,PCoA)评估菌落特征(R软件Mothur 1.47.0程序),并绘制基于UniFrac距离矩阵样本树树状图(R软件Vegan2.6-2程序)。(3)差异菌群:基于OTU聚类分析,在门、属水平比较两组丰度存在差异的菌群,并绘制物种组成柱状图、物种丰度聚类热图;采用线性判别分析(linear discriminant analysis,LDA)评估两组肠道有统计学差异的菌群(Wilcoxon秩和检验,设置LDA评分≥2为差异具有统计学意义)。
1.4 样本量估算
由于目前文献中尚缺乏癫痫与肠道菌群关联强度的相关数据,暂无法进行样本量估算。查阅文献[6-8]可知,既往癫痫患者肠道菌群多样性研究的样本量均较小,如Safak等[6]研究中癫痫患者30例,健康人群10名;Wang等[7]研究中癫痫患者27例,健康人群23名。本研究拟纳入癫痫患者32例,健康人群33名,理论上可满足数据分析需要。
1.5 统计学处理
采用SPSS 22.0软件进行统计学分析。年龄、体质量指数、α多样性等计量资料以均数±标准差表示,组间比较采用t检验;性别为计数资料,以频数(百分数)表示,组间比较采用卡方检验。采用R 4.0.3软件绘制稀疏曲线、样本树树状图、物种组成柱状图、物种丰度聚类热图等。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床资料
共入选符合纳入与排除标准的MHE 32例、MHN 33名。两组年龄、性别、体质量指数、肝肾功能、血脂均无统计学差异(P均>0.05),见表1。
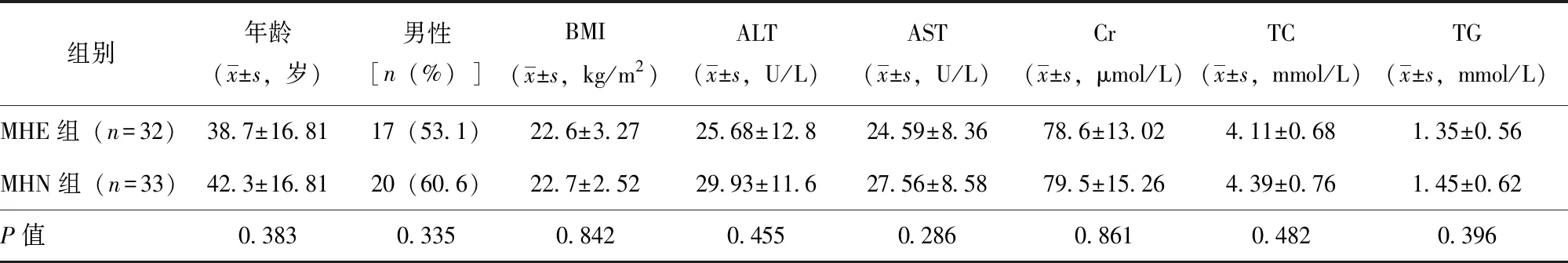
表1 两组基线资料比较
2.2 肠道菌群多样性
随测序序列条目增加,MHE组与MHN组稀疏曲线(Shannon指数)逐渐趋于平坦,说明测序数据量合理,样本的α多样性指标已达稳定状态(图1A)。MHE组与MHN组Sobs指数分别为698.88±257.29、804.33±122.52,Goods Coverage指数分别为0.995±0.001、0.994±0.001,提示测序深度已基本覆盖样品中的所有物种,测序结果可反映样本中微生物真实情况。α多样性分析显示,MHE组ACE指数、Shannon指数、Chao指数均低于MHN组(P均<0.05),见表2。
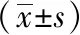
表2 两组α多样性比较
通过基于加权Bray-Curtis距离矩阵的PCoA评估了肠道菌群β多样性,结果显示MHE组与MHN组在 PCoA1轴和PCoA2轴之间形成两个不同的群落,表明二者菌群结构存在差异(图1B);基于加权UniFrac距离矩阵的样本树树状图将MHE组与MHN组划分为5个聚类组(图1C),其中第1、3、5组主要包含MHE,第2、4组包含大部分MHN,进一步表明MHE组和MHN组肠道菌群分布存在差异。
2.3 肠道菌群丰度和分布差异
物种组成柱状图示:门水平上,MHE组疣微菌门(Verrucomicrobia)、变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)的相对丰度高于MHN组,拟杆菌门(Bacteroidota)的相对丰度低于MHN组(图2A);属水平上,MHE组链球菌属(Streptococcus)、志贺菌属(Escherichia-Shigella)、肠球菌属(Enterococcus)、小类杆菌属(Dialister)、双歧杆菌属(Bifidobacterium)的相对丰度高于MHN组,普氏菌属(Prevotella)、粪杆菌属(Faecalibacterium)、拟杆菌属(Bacteroides)的相对丰度低于MHN组(图2B)。物种丰度聚类热图在属水平上的结果与物种组成柱状图基本一致,但门水平上两组变形菌门、拟杆菌门的相对丰度无明显差异。除此之外,MHE组在门水平上放线菌门、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteriota)、芽单胞菌门(Gemmatimona-dota),属水平上柯林斯氏菌属(Collinsella)、梭杆菌属(Fusobacteriota)、阿克曼菌属(Akkermansia)的相对丰度均增高(图2C、2D)。
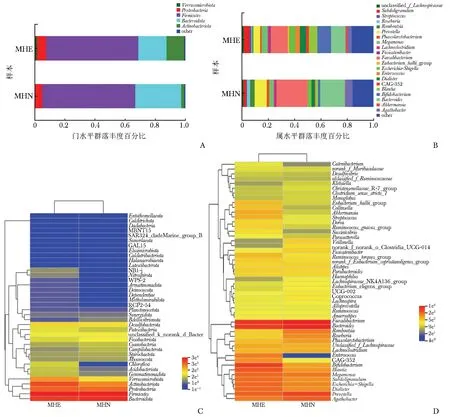
图2 MHE组与MHN组肠道菌群分布特征
LDA结果显示,放线菌门、双歧杆菌属在MHE组呈优势分布,肠球菌属、酸氨基球菌(Acidaminococcales)、芽孢杆菌属(Phascolarctobacterium)在MHN组呈优势分布(图3)。
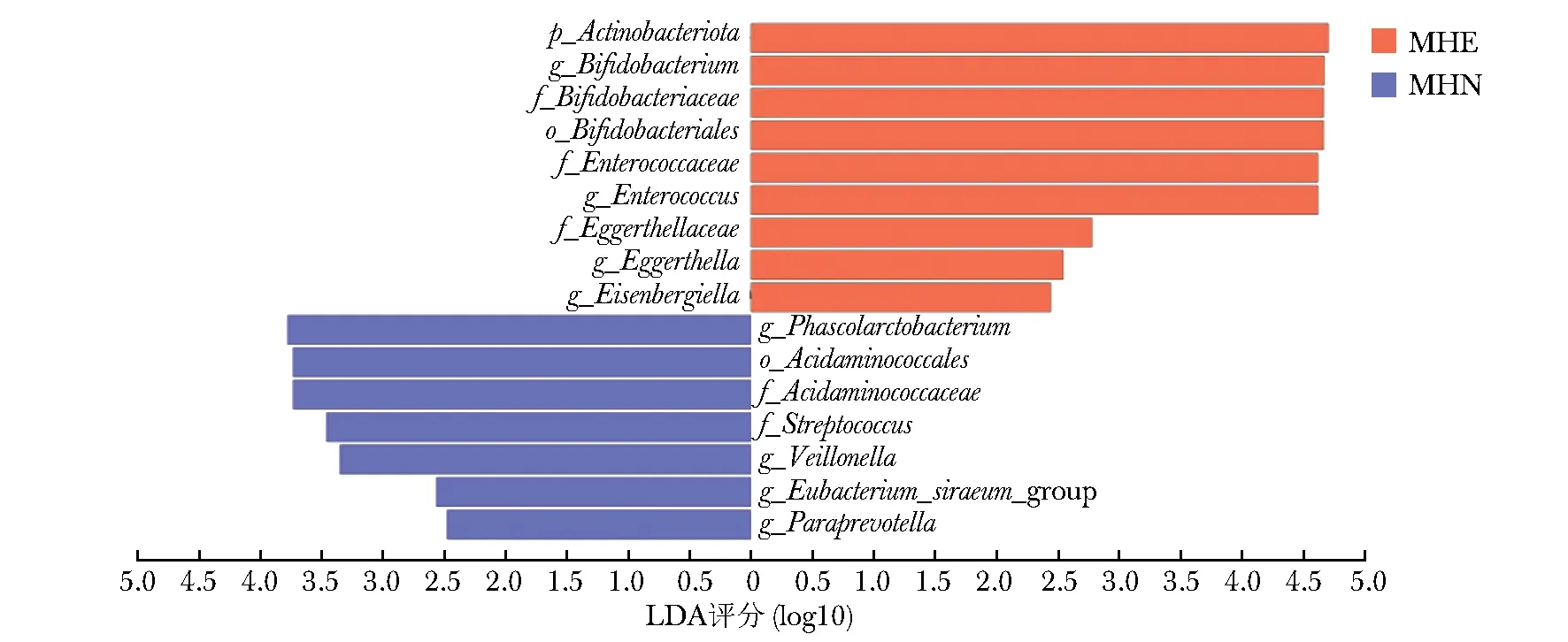
图3 MHE组与MHN组肠道菌群分布比较的LDA柱状图
3 讨论
基于肠道菌群16S rRNA测序结果,本研究对MHE和MHN的肠道菌群差异进行了分析。结果显示MHE组肠道菌群α多样性较MHN组降低,β多样性与MHN组存在差异;二者肠道菌群分布亦存在明显区别,主要表现为MHE组在门水平上疣微菌门、变形菌门、放线菌门,属水平上柯林斯氏菌属、梭杆菌属、双歧杆菌属等菌种表达增多,以及门水平上拟杆菌门,属水平上拟杆菌属、普氏菌属、粪杆菌属等菌种表达减少,可能在癫痫的发生中发挥促进作用。
人类肠道聚集的菌群总量为亿万级,约是人体细胞的1.3倍[8],几乎参与机体所有疾病的调控,因此肠道菌群被称为人体的“第二大脑”。肠道菌群可通过神经系统、内分泌系统以及免疫炎症反应等途径,影响神经递质合成与释放、迷走神经活性、微生物代谢,从而对大脑的生理、行为和认知功能产生显著影响,此种肠道与大脑之间的调控机制被称为“脑-肠轴”[7]。近年来,随着16S rRNA高通量测序技术的应用,临床对肠道菌群的认识不断提升,已有多项研究表明肠道菌群与帕金森病、多发性硬化、阿尔茨海默症等多种中枢神经系统疾病存在直接或间接关联性[1]。针对肠道菌群与癫痫的相关性,研究者已进行了多方面探索[9-10]。王世荣等[11]研究表明,肠道微生物可衍生多种神经递质,如乙酰胆碱(乳酸菌家族产生)、γ-氨基丁酸(双歧杆菌和乳酸菌家族产生)和5-羟色胺(肠球菌和链球菌家族产生),导致兴奋-抑制性中枢神经系统失衡,增加癫痫发生风险。Peng等[9]在一项病例对照研究中发现,与健康对照人群比较,癫痫患者肠道菌群在门水平和属水平均有明显改变,表现为一些罕见菌属如奈瑟菌属、粪球菌属、梭杆菌属、罗氏菌属等含量异常增加。Holmes等[12]通过小鼠模型证实,生酮饮食引发的肠道菌群改变可降低戊四唑诱发癫痫的易感性,为通过改变肠道菌群组成进行抗癫痫治疗提供了研究依据。2018年国内首次报道了粪菌移植成功治疗癫痫的案例,患者为一位合并克罗恩病的癫痫女性,经粪菌移植后停用抗癫痫药物20个月无癫痫发作,证实菌群移植可通过重塑肠道微生物治疗癫痫[13]。但肠道菌群受环境的影响较显著[14]。Li等[15]对不同海拔地区人群进行肠道菌群检测后发现,低氧、低气压的环境特点对肠道菌群的组成结构存在显著影响,表现为与平原地区汉族人群相比,高原汉族人群肠道菌群中的布劳蒂亚菌属、酸氨基球菌属、梭杆菌属等丰度增加,颤螺菌属和萨特斯菌属丰度显著减少,提示海拔可能是影响肠道菌群组成的关键环境因素之一。
α多样性、β多样性是评估菌群多样性的最常用指标之一。Gong等[16]比较了癫痫患者与健康人群肠道菌群多样性后发现,癫痫组Sobs、Shannon、Chao指数均降低。Cui等[17]研究发现,癫痫患者Simpson、Shannon、ACE指数均较健康人群降低。本研究以健康人群为对照,评估了中高海拔地区癫痫患者肠道菌群变化特征,以期为癫痫病因学研究提供思路。结果显示二者肠道菌群α多样性存在显著差异,表现为MHE组ACE指数、Chao指数、Shannon指数均较MHN组降低。ACE指数、Chao指数均为菌群丰度的评估指标,其数值越大表示菌群丰度越高;Shannon指数综合考虑了群落的丰富度和均匀度,其数值越高表明群落的多样性越高。α多样性分析提示,癫痫患者肠道菌群种类及丰度均降低,与既往研究结果基本一致[16-17]。在β多样性分析中,癫痫患者肠道菌群形成了不同于健康人群的群落,提示二者的菌群结构存在差异,肠道菌群可能参与了癫痫的发生与发展。
本研究进一步比较了MHE与MHN肠道菌群组成差异,结果显示相较于MHN组,MHE组在门、属水平存在多种差异性表达菌群,表现为疣微菌门、梭杆菌属、链球菌属、柯林斯氏菌属等丰度增高,提示癫痫患者肠道菌群处于明显紊乱状态,可能促进了该病发生。文献报道,疣微菌门[18]可促进粘蛋白降解,该功能可破坏肠道黏膜屏障完整性,导致细菌易位;通过肠黏膜进入血液的细菌可诱发全身炎症反应,导致血脑屏障功能障碍,以致癫痫发病的阈值降低。梭杆菌属是常见的机会致病菌、致癌菌,其在结直肠癌和肠炎患者中普遍存在[19]。研究表明[20-21],梭杆菌属可分泌多种具有致病性/侵入性毒素,引发肠道炎症,而炎症反应已被证实与癫痫存在因果关系。链球菌属是化脓性球菌中常见的革兰阳性球菌,其过度生长可产生过量肿瘤坏死因子α、白细胞介素(interleukin,IL)-6等炎症介质,不仅可引起持续性炎症反应,且肿瘤坏死因子α可促进Ca2+内流,导致神经元兴奋性增强,诱发癫痫发作[22-23]。柯林斯氏菌属具有诱导IL-17A表达的功能[24],而癫痫发作期间IL-17A水平与癫痫发作频率呈正相关[25-26]。双歧杆菌作为益生菌,其与癫痫的关系尚未明确。动物模型显示[27-28],生酮饮食干预后小鼠肠道中双歧杆菌及促炎免疫细胞Th17水平均减少,提示生酮饮食治疗难治性癫痫的机制可能与降低双歧杆菌丰度相关。本研究可见癫痫患者双歧杆菌属表达丰度增加,与既往研究结果一致[27,29]。
除多种菌群丰度增多外,本研究亦发现MHE组拟杆菌门、拟杆菌属、普氏菌属、粪杆菌属等菌种表达减少。粪杆菌、普氏菌、拟杆菌可产生丁酸盐、乙酸盐等短链脂肪酸(short-chain fatty acids,SCFAs)[30],而SCFAs与中枢神经系统免疫防御相关,此类菌种减少可降低SCFAs浓度,通过影响小胶质细胞成熟、神经递质水平、血脑屏障通透性,间接促进癫痫发生发展[27]。
本研究局限性:(1)样本例数相对较少,可能降低了检验效能;(2)未纳入民族、生活方式、饮食习惯等可能影响菌群特征的因素,可能导致研究结果存在偏倚;(3)缺乏相关机制的探索且由于仅为横断面研究,无法明确肠道菌群特征变化与癫痫发生的因果关系。期待未来增大样本量并在基因、代谢层面进一步验证肠道菌群特征与癫痫的相关性。
由于中高海拔地区独特的地理位置及气候特点,导致长期生活在该地区居民的肠道菌群分布与结构具有特异性,目前中高海拔地区癫痫人群肠道菌群多样性的相关研究仍相对空白。本研究首次揭示了中高海拔地区癫痫患者的肠道菌群分布特点,即疣微菌门、变形菌门、柯林斯氏菌属、梭杆菌属等菌种增多,拟杆菌门、拟杆菌属、普氏菌属、粪杆菌属等菌种减少。本研究从肠道菌群的角度出发,分析了中海拔地区癫痫发病的可能病理生理机制,为癫痫病因学研究及治疗策略制订提供了线索和理论依据。
作者贡献:郑美玲负责标本收集、文献查阅、数据分析及论文撰写;樊青俐负责研究设计与论文修订;钟莲梅负责论文审核。
利益冲突:所有作者均声明不存在利益冲突

